肾脏类器官的建立及其应用
2020-02-03吴杭迪综述刘志红审校
吴杭迪 王 钢 综述 刘志红 审校
类器官(Organoid)是一种由多能干细胞诱导分化形成的体外3D结构,包含多种细胞类型以及细胞外基质,在结构及功能上与体内器官相似[1]。相较于2D细胞培养,类器官的优势在于其不仅能表现出更接近生理条件下的细胞类型组成,而且能够反映细胞间以及细胞与细胞外基质间的相互作用。同时,相较于动物模型,类器官的优势在于其人类的基因背景,可有效减少物种间基因差异造成的实验结果偏差。鉴于类器官体外模型诸多的优势,其应用研究也日益增多,主要包括:疾病模型建立、药物有效性筛选及毒性检测、体外临床前试验、再生医学领域等。目前,类器官的研究已经在小肠[2]、肝脏[3]、肺[4]、胰腺[5]等多个方向展开。在肾脏领域,由多能干细胞诱导分化肾脏类器官的方法也基本建立,本文将对近期肾脏类器官的诱导方法及应用进行综述。
肾脏类器官诱导方法
体内肾脏发育起始于胚胎干细胞,经历前、中、后肾的发育过程,最终形成含有多种细胞类型的成熟器官。在体外诱导肾脏类器官,同样需要利用具有多能性的干细胞。2006年以前,只能利用胚胎干细胞(ESC)实现在体外分化得到不同类型细胞,但是由于伦理原因,胚胎干细胞的研究非常受限。在2006年以后,Takahashi等[6]通过将小鼠成纤维细胞重编程获得诱导多能干细胞(iPSC)。iPSC与ESC的多能性相当,都具有三胚层分化能力,2007年,该团队使用同样的方法,成功构建人诱导多能干细胞(hiPSC),为类器官构建的细胞来源打下基础。将ESC或iPSC诱导形成肾脏类器官需要模仿生理情况下的肾脏发育过程。在体内,起始于上胚层的原条后部首先分化发育形成中胚层。中胚层包括轴旁、侧板及中间中胚层[7],中间中胚层进一步分化,前部形成输尿管芽,后部形成后肾间充质。之后,输尿管芽与后肾间充质之间互相诱导分化,输尿管芽入侵、延伸,并在后肾间充质内不断形成分支,最终发育成为输尿管、肾盏以及皮髓质集合管,而后肾间充质则分化发育形成肾单位祖细胞,而后分化为肾小球、近端小管、髓袢及远端小管[8]。这一系列的发育过程需要许多信号通路参与调控。其中,Wnt信号通路在平衡肾脏祖细胞的扩增与分化、间质上皮转化等过程中起到关键作用[9-10]。此外,FGF信号通路在维持肾脏祖细胞干性中至关重要[11],而BMP4可抑制异位输尿管芽形成[12]。多个实验室建立的肾脏类器官诱导方法,均是通过在培养过程中的不同时间节点加入相应的诱导因子,以实现类器官的诱导。
Nishinakamura实验室方法2014年,日本学者Nishinakamura成功地将hiPSC诱导形成肾脏类器官[13]。在最初24h用骨形成蛋白4(BMP4)处理诱导出拟胚体,之后在激活素、骨形成蛋白4、Wnt通路激动剂(CHIR99021)、视黄酸及成纤维细胞生长因子2(FGF2)的联合诱导下,在培养的第11d形成中胚层后部。之后加入CHIR99021以及成纤维细胞生长因子9(FGF9),在第14d得到后肾间充质(图1A),与小鼠脊髓共培养,最终得到的类器官中可以观察到近端、远端小管以及足细胞样结构(图1B)。

图1 A:Nishinakamura实验室肾脏类器官诱导方法流程;B:hiPSC来源肾脏类器官成像图[13]BMP4:骨形成蛋白4;CHIR99021:Wnt通路激动剂;FGF2:成纤维细胞生长因子2;FGF9:成纤维细胞生长因子9;RA:视黄酸;a,b:肾小球标志基因表达情况,箭头所指为肾小球结构;c:近端小管标志基因表达情况,箭头所指为近端小管结构;d:远端小管标志基因表达情况,箭头所指为远端小管结构;hiPSC:人诱导多能干细胞
Bonventre实验室方法美国学者Bonventre等认为Nishinakamura的方法存在待改进之处,比如小鼠脊髓共培养中一些不明确的因子可能会对类器官用于疾病建模产生限制[14]。基于此,他们利用成分明确的培养诱导分子,分别在普通孔板进行贴壁培养以及低吸附孔板进行3D培养。其研究显示,人多能干细胞(hPSC,包括hESC以及hiPSC)用3~10 μM CHIR99021、激活素及成纤维细胞生长因子9处理,诱导出后肾间充质。此时需要开始进行3D培养,将细胞转至低吸附96孔板,用3 μM CHIR99021 以及成纤维细胞生长因子9同时处理2d,之后逐步撤去上述诱导因子,在培养的第21天可观察到肾脏类器官的形成(图2A)。类器官同时具有足细胞、近端小管、髓袢及远端小管结构[15-16](图2B)。但是,他们所诱导得到的类器官中并没有观察到内皮样细胞、间质成纤维样细胞及集合系统结构。2019年,该团队提出将类器官培养在流动环境中的微流控芯片中,可以得到更成熟的小球及小管结构,同时切应力可以增加类器官血管化[17]。
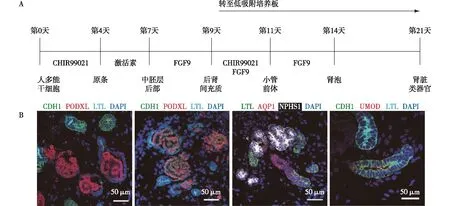
图2 A:Bonventre实验室肾脏类器官诱导方法流程;B:诱导第21~28天hPSC来源肾脏类器官成像图[15]足细胞标记基因:PODXL,NPHS1,WT1;近端小管标记基因:LTL,AQP1;髓袢标记基因:CDH1,UMOD,AQP1;远端小管标记基因:CDH1; CHIR99021:Wnt通路激动剂;FGF9:成纤维细胞生长因子9;hPSC:人多能干细胞
Freedman实验室方法美国学者Freedman和Bonventre在2015年提出一种利用了双层Matrigel(一种基质胶)制成的“三明治”结构来诱导肾脏类器官的方法[18]。经过几年的摸索,2019年,Freedman建立了更完善的培养方法。培养第1d,将hPSC培养在“三明治”结构中。第3天给予12 μM CHIR99021处理。36h后更换为RB培养基(Advanced RPMI+1X 谷氨酰胺+1X B27 Supplement),将培养时间延长至21d(图3A)。得到的类器官中可观察到足细胞、近端及远端小管及内皮样细胞,但未得到集合管样结构(图3B)。值得注意的是,Freedman团队发现,诱导得到的类器官中,存在神经元样细胞及其他一些非肾脏特异性细胞[19],这种“脱靶”现象也在另一项研究中被证实[20]。
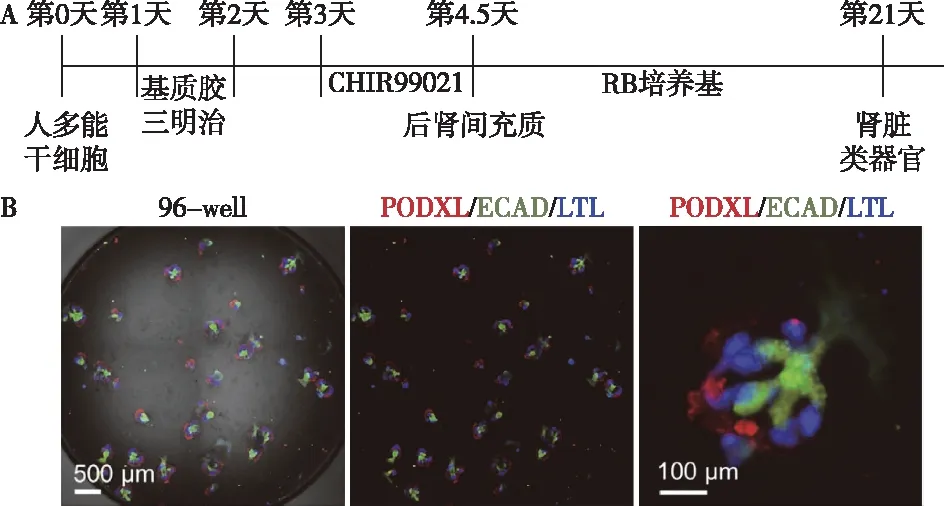
图3 A: Freedman实验室肾脏类器官诱导方法流程;B:诱导得到肾脏类器官成像图[19]足细胞标记基因:PODXL;近端小管标记基因:LTL;远端小管标记基因:ECAD;CHIR99021:Wnt通路激动剂
Xia实验室方法新加坡学者Xia的团队[21]首先用10 μM CHIR99021处理hPSC 4d,诱导出原条,之后,3d“无因子”培养诱导出中间中胚层,然后用3 μM CHIR99021及成纤维细胞生长因子9 联合处理诱导出肾单位祖细胞,在培养的第14天开始给予时间不等的1 μM CHIR99021处理以得到不同的球管比例,第20天之后肾脏类器官中可观察到足细胞、近端小管、远端小管等结构(图4),并且在这些肾单位结构旁,他们还观察到CD31+CD34+内皮细胞形成广泛网络。为了进一步验证,他们将人脐带静脉内皮细胞导入类器官,发现这些外源的人脐带静脉内皮细胞形成的网络与前述内皮网络无缝整合。Xia的团队同时做了类器官功能验证。体外葡聚糖吸收实验发现,类器官中肾小管结构具有重吸收葡聚糖的能力,并对分子量有一定选择性。体外诱导的类器官虽然存在内皮网络,但是并没有明显的血管形成,因而并不具备滤过功能。进一步将体外诱导的肾脏类器官移植入免疫缺陷小鼠肾包膜下,4周后注射不同分子量的葡聚糖,证实了类器官中肾小球的选择性滤过功能及肾小管的重吸收功能。
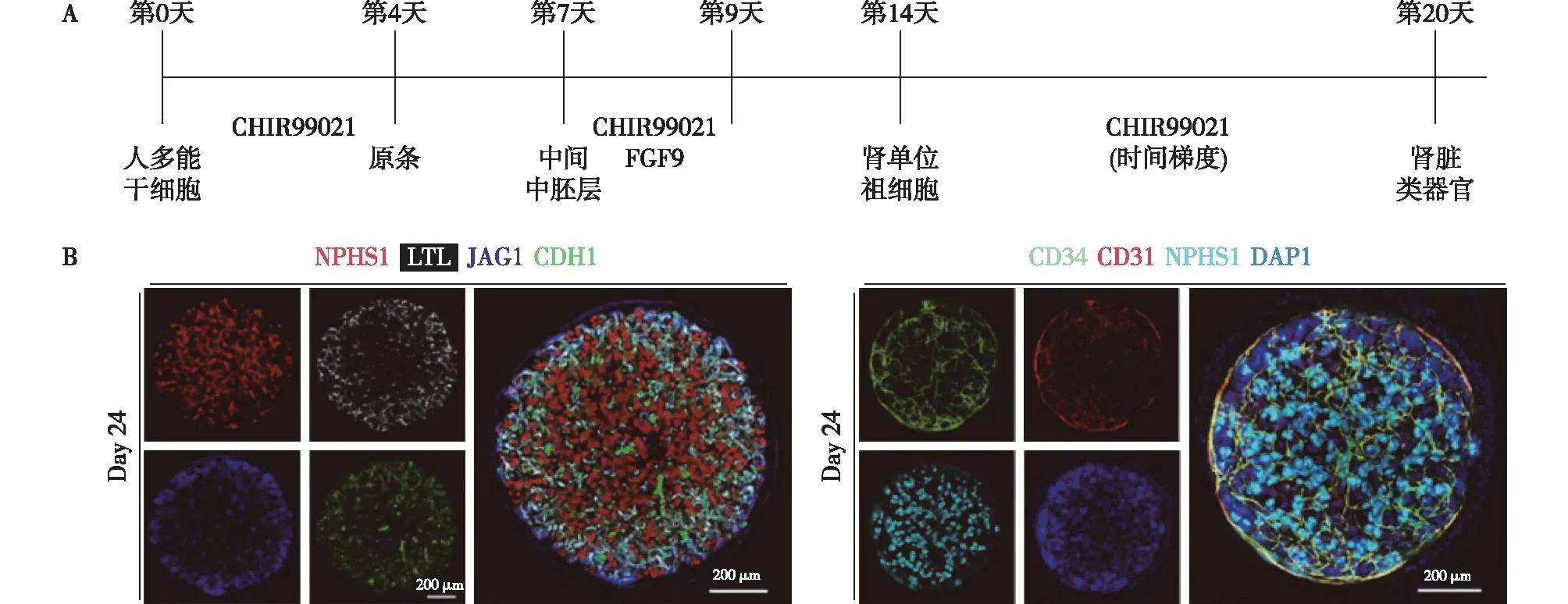
图4 A:Xia实验室肾脏类器官诱导方法流程;B:诱导第24天肾脏类器官成像图[21]足细胞标记基因:NPHS1;近端小管标记基因:LTL;中段小管标记基因:JAG1;内皮细胞标记基因:CD31,CD34;CHIR99021:Wnt通路激动剂;FGF9:成纤维细胞生长因子9

图5 A:Little实验室肾脏类器官诱导方法流程;B:transwell诱导方法第25天肾脏类器官成像[7]a:肾小球及其标记基因表达情况,空箭头所指为肾小球基膜结构;b:内皮标记基因表达情况;c:髓袢标记基因表达情况;d:近端小管标记基因表达情况;e:肾间质标记基因表达情况;f:集合管标记基因表达情况;CHIR99021:Wnt通路激动剂;FGF9:成纤维细胞生长因子9;MC:甲基纤维素;PVA:聚乙烯醇
Little实验室方法上述4个实验室获得的肾脏类器官中主要包含后肾间充质来源的细胞类型,澳大利亚学者Little提出一种类器官诱导方法[7],可以同时获得由后肾间充质及输尿管芽来源细胞类型。整个培养过程需要27d。在诱导中间中胚层这一步,他们发现CHIR99021及后续成纤维细胞生长因子9处理时间的长短比例可以决定分化轨迹,如果CHIR99021处理时间延长,将会得到更多肾单位结构,反之则会得到更多集合管结构。他们认为8 μM CHIR99021处理3~4d比较合适,之后换为成纤维细胞生长因子9及肝素的处理条件,在第7天将细胞转至装有tranwell小室的六孔板,并给予5 μM CHIR99021冲击处理1h,第12天撤去生长因子,最终得到的类器官不仅具有足细胞、近端及远端小管结构,还包括集合管、肾脏间质及内皮网络(图5)。单细胞转录组测序结果显示获得的肾脏类器官与胎儿早期肾脏非常相似[22]。2019年,该实验室将培养方法进一步优化[23],提出一种悬浮培养法。hPSC用7 μM CHIR99021处理4d后,接着用成纤维细胞生长因子9及1 μM CHIR99021处理3d,之后转入低吸附孔板进行悬浮培养,再处理5d之后撤去生长因子,第25天得到肾脏微型类器官。这种悬浮培养方法得到的类器官成球形,结构成分与前类似,但产量更高。
不同方法的比较肾脏类器官诱导技术仍在不断发展,仍需要通过组织学、免疫荧光、全量RNA测序以及单细胞RNA测序(scRNA-seq)等方法,来验证类器官结构和成分与天然成熟肾脏的一致性。其中scRNA-seq可以对一个样本中的所有细胞进行全面分类,无预判,无偏倚。通过单细胞层面的分析[24],研究者发现目前报道的几种不同诱导方法得到的肾脏类器官成熟度接近于8~17周胎儿肾脏。其中足细胞和近端小管细胞发育良好,而远端小管细胞分化程度欠佳。此外,一些肾脏关键细胞类型缺失(主细胞、闰细胞、免疫细胞、肾小球成熟内皮细胞),并存在各种脱靶细胞[25]。各个类器官中各种细胞类型所占的比例存在差别,而造成这种差别的因素包括iPSC细胞系差异[24]以及诱导批次差异[26]。研究还发现,将类器官移植到免疫缺陷小鼠肾包膜下可以减少脱靶细胞数量,促进血管网络的形成以及类器官的成熟[24]。另外,由不同iPSC细胞系诱导的肾脏类器官均检测到遗传性肾脏病相关基因的表达,证实了其对于遗传性肾脏病研究的应用价值[24]。
总体而言,在体外利用hPSC诱导获得肾脏类器官是可行的,但是在结构与功能上尚不成熟。因此,对于利用hPSC诱导获得肾脏类器官的方法还有待进一步完善,以克服目前存在的这些问题。
肾脏类器官的应用
类器官作为一种新的体外模型,相较于传统的2D细胞培养及模式动物,有更显著的优势。近年来,CRISPR/Cas9技术的成熟能更精准地实现基因编辑。两者结合,让肾脏类器官有了更广泛的应用价值,包括疾病建模,药物有效性及肾毒性检测,再生医学领域的应用等。
疾病建模遗传性多囊肾病(PKD)是导致终末期肾脏病的重要病因,按遗传方式分类为常染色体显性遗传性多囊肾病(ADPKD)以及常染色体隐性遗传性多囊肾病(ARPKD)。ARPKD发病率较低,1∶ 8 000~1∶ 26 500,在胎儿期即形成肾囊肿,致病基因为PKHD1。ADPKD发病率为1∶ 400~1∶ 1 000,多在成年后出现表型,致病基因为PKD1 或者PKD2[27-28]。目前PKD致病机制尚未完全明确。Freedman团队尝试利用肾脏类器官进行PKD体外建模。通过基因编辑技术,在hPSC上对PKD1以及PKD2进行双等位基因截短突变,将其诱导形成类器官,并最终在近端小管观察到囊肿形成[18]。但是,只有6%的类器官可以观察囊肿形成,效率较低。Xia的团队利用肾脏类器官实现了ARPKD体外建模[21]。首先将携带复合突变的ARPKD患者体细胞重编程获得iPSC,之后一部分正常诱导形成ARPKD类器官,一部分通过CRISPR/Cas9技术将其中一个突变位点修正之后诱导形成类器官。结果观察到ARPKD类器官有囊肿形成,但是和Freedman团队的结果一样,只有很少一部分ARPKD类器官观察到囊肿形成。但是,通过添加弗斯可林或者8-溴-环单磷酸腺苷(8-Br-cAMP)来增加胞内环单磷酸腺苷(cAMP)水平,ARPKD类器官相较于突变修正类器官有更显著的囊肿形成。
肾消耗病(NPHP)是一种常染色体隐性遗传间质性肾炎,是引起青少年慢性肾脏病最常见的一种单基因疾病,表现为小管基底膜损伤、小管扩张及间质纤维化等,其发病机制仍不明确。Little团队对1例NPHP先证者及其核心家系进行全外显子测序,在IFT140基因上发现了复合杂合突变。重编程及基因编辑后,得到先证者来源的携带突变iPSC以及突变修正iPSC,分别诱导形成肾脏类器官。观察到携带突变的类器官小管初级纤毛表现为异常的短杵状,而突变修正类器官没有这一表型。通过对这一疾病模型的进一步研究,该团队还阐释了可能的致病机制[29]。
先天性肾病综合征是一种较为严重的遗传性肾病,Nishinakamura团队对1例患者及其核心家系进行测序[30],发现患者父亲携带NPHS1基因大片段丢失,而其母亲携带NPHS1基因单个错义突变,该患者同时携带上述两种突变。该研究团队将患者皮肤成纤维细胞重编程获得iPSC并诱导形成肾脏类器官,发现在上述类器官的足细胞中,NPHS1编码的蛋白nephrin无法定位于细胞表面,从而影响裂孔膜的形成。将患者携带的错义突变纠正后重新诱导形成类器官,nephrin的细胞表面定位能力以及磷酸化状态都得到恢复,可以正常招募NEPH1以及podocin这两种蛋白,从而形成完整的裂孔膜结构。
药物有效性及肾毒性检测类器官有着个体化的人类基因背景,并能反映细胞间以及细胞与胞外基质间相互作用,对于药物有效性筛选及肾毒性检测有较好的应用前景。Freedman团队开发了一种高通量类器官平台来测试8种化合物对于PKD类器官的影响,意外发现了肌球蛋白通路在囊肿形成中的作用[31]。Xia等在有明显囊肿形成的ARPDK类器官上做了2种药物测试,胞内钙离子释放剂毒胡萝卜素(Thapsigargin)以及一种囊性纤维化跨膜传导调节抑制剂,两者均可抑制囊肿形成,并呈剂量依赖性[21]。Holm团队用半胱胺处理胱氨酸病类器官,发现胱氨酸水平减低,而mTOR通路抑制剂依维莫司可以减少凋亡及激活自噬,两种药物联合应用,发挥互补作用,同时在胱氨酸负荷、凋亡及自噬三方面改善疾病表型[32]。
肾毒性检测是新药研发的重要步骤。Little团队用5及20 μM顺铂处理肾脏类器官24h,均发现类器官中的成熟近端小管细胞(LTL+ECAD+)出现明显急性凋亡[22]。在另一项研究中,其用2.5及5 μg/ml 阿霉素处理肾脏类器官24h,观察到足细胞凋亡现象,qPCR结果提示呈药物剂量依赖性[23]。Bonventre团队用5 mg/ml庆大霉素处理肾脏类器官48h,发现LTL+近端小管细胞肾损伤分子1(KIM-1)表达。qPCR显示不同浓度药物剂量下KIM-1上调呈剂量依赖性[15]。但是目前只局限于1~2种药物,如果要评估基于肾脏类器官的药物筛选是否有应用价值,需要对更多的药物进行筛选,包括肾毒性药物以及无肾毒性的药物,同时需要与较成熟的模型如近端小管药物筛选模型进行结果比对。
再生医学领域哺乳动物的肾脏发育过程在子宫内或者出生后不久便终止,在成人,虽然肾小管上皮在损伤后有增殖及修复功能,但完整肾单位无法再生。许多终末期肾脏患者都需要进行肾移植,而匹配的肾源可能需要数年的等待,如果可以从待移植个体获得iPSC,并分化为免疫兼容的移植物,有望使更多患者获益。Dekel的团队将8周胎龄的肾脏移植到免疫缺陷小鼠肾被膜下,可以观察到肾脏有成熟的小球及小管结构形成,伴有血管化的发生,并能产生稀释尿液[33]。近2年,又有不同团队发表了类似研究[24,34-35],相比单独体外诱导,体内移植后的类器官在结构与功能上均更成熟,因此认为,在体外诱导肾脏类器官,能够添加的刺激信号模式有限,类器官的进一步成熟需要体内微环境的刺激,为后续肾脏类器官的移植提供了新思路。
肾脏类器官的机遇与挑战随着干细胞领域的发展以及基因编辑技术的成熟,肾脏类器官成为肾脏病领域学者近些年来关注的焦点之一。由hiPSC体外诱导而来的肾脏类器官作为区别于传统二维细胞培养以及模式动物之外的另一种全新研究手段,有许多优势及应用前景。但是同时肾脏类器官的研究也面临许多挑战。目前全球不同实验室的诱导方法得到的肾脏类器官均在结构与功能方面与成熟肾脏有较大差异。对于再生医学领域,如何确定最优移植时间窗,如何选择合适移植部位将肾脏类器官移植入体内并顺利与受体循环系统建立连接产生原尿,又如何与受体本身尿路对接将尿液顺利排泄都是亟待解决的问题。另一方面,目前部分方法诱导得到的类器官中有一些“脱靶”细胞,而这些细胞中如果有部分仍存在多能性,移植入人体内后则会形成畸胎瘤,产生生物安全性问题。因此如何提高类器官诱导的效率,获得更趋成熟和功能化的肾脏类器官,并将其应用于研究和完成临床转化,仍需要进一步的探索,我们仍任重而道远。
