短期不同耕作方式对水稻根际土壤细菌群落结构多样性的影响
2020-01-21周佳周灵芝劳承英申章佑李艳英胡泊黄渝岚韦本辉
周佳 周灵芝 劳承英 申章佑 李艳英 胡泊 黄渝岚 韦本辉
摘要:【目的】研究短期不同耕作方式對水稻根际土壤细菌群落结构多样性的影响,为阐释耕作对稻田土壤微生物多样性的形成机制提供科学依据。【方法】以旋耕、免耕和粉垄3种不同耕作方式下的水稻根际土壤为研究对象,采用Illumina MiSeq高通量测序技术结合土壤理化性质,分析不同耕作方式下水稻根际土壤细菌群落多样性特征及其与土壤理化因子的关系。【结果】旋耕、免耕和粉垄处理文库覆盖率均较高,分别为98.96%、98.93%和99.04%。Alpha多样性分析结果显示,粉垄处理水稻根际土壤细菌群落多样性Shannon指数显著高于免耕处理(P<0.05,下同)。旋耕、免耕和粉垄处理分别获得2747、2734和2813个OTUs,处理间无显著差异(P>0.05)。各样本共检测到细菌类群206个种,隶属于47门48纲85目134科217属。物种群落组成分析表明变形菌门、绿弯菌门、酸杆菌门和硝化螺旋菌门是水稻根际土壤细菌主要优势菌群,共占比69.96%~73.51%;不同耕作处理水稻根际土壤细菌群落结构差异主要表现在菌群的相对丰度上,变形菌门、硝化螺旋菌门、浮霉菌门、放线菌门和绿菌门的相对丰度在3种耕作方式间差异显著。旋耕和免耕处理间OTU水平相似性较高。主成分分析结果显示,第一主成分(PC1)和第二主成分(PC2)菌群结构的差异性贡献率分别为43.15%和23.79%,细菌群落结构表现为粉垄处理受PC1影响明显、旋耕和免耕处理受PC2影响明显。冗余分析结果表明前2个排序轴共解释69.09%细菌群落变化;速效磷、碱解氮和pH是影响细菌群落的重要因子,与变形菌门、硝化螺旋菌门、浮霉菌门、放线菌门和绿菌门的群落分布显著相关。【结论】短期不同耕作方式可在一定程度上改变稻田土壤细菌群落多样性,不同耕作方式间的差异主要体现在细菌群落相对丰度上;土壤速效磷、碱解氮和pH是影响水稻根际土壤细菌群落分布的重要因素。从土壤微生物群落形成角度考虑,粉垄栽培优于旋耕和免耕。
关键词: 水稻;粉垄栽培;旋耕;免耕;土壤细菌;群落结构多样性;高通量测序
中图分类号: S154.3;S341.1 文献标志码: A 文章编号:2095-1191(2020)10-2401-11
Effects of short-term different tillage methods on the diversity of bacterial community in rice rhizosphere soils
ZHOU Jia, ZHOU Ling-zhi, LAO Cheng-ying, SHEN Zhang-you, LI Yan-ying,
HU Po, HUANG Yu-lan, WEI Ben-hui*
(Cash Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
Abstract:【Objective】In order to provide scientific basis for elucidating the formation mechanisms of soil microbial diversity in paddy soils by tillage,the present experiment was conducted to study the effects of short-term different tillage practices on the diversity of bacterial community in rice rhizosphere soils. 【Method】Rice rhizosphere soils under different cultivation modes of rotary tillage,no tillage and Fenlong cultivation were studied by Illumina MiSeq high-throughput sequencing,combined with soil physiochemical traits,to analyze the bacterial diversity characteristics and major microbial communities of rice rhizosphere soils under different cultivation modes,and the correlation between bacterial communities and soil physiochemical traits. 【Result】The results of high-throughput sequencing analysis showed that the library covera-ge of rotary tillage,no tillage and Fenlong cultivation treatments were 98.96%,98.93% and 99.04%,respectively. Alpha diversity analysis showed that the Shannon index of bacterial community diversity of soil rhizosphere in Fenlong cultivation treatment was significantly higher than in no tillage treatment(P<0.05,the same below). The Venn diagram analysis showed that 2747,2734,and 2813 bacterial OTUs were obtained from rotary tillage,no tillage and Fenlong cultivation treatments,respectively,with no significant differences among three treatments. A total of 206 species of bacteria were detected in the samples,belonging to 47 phyla,48 classes,85 orders,134 families,217 genera. The analysis of the species community composition showed that Proteobacteria,Chloroflexi,Acidobacteria and Nitrospirae were the dominant flora of rice rhizosphere soils,totaling about 69.96%-73.51%. The relative abundance of Proteobacteria,Nitrospirae,Planctomycetes,Actinobacteria and Chlorobi were significantly different among three tillage treatments. Cluster analysis showed a high OTU level similarity between rotary tillage and no tillage treatments. Principal component analysis of soil bacterial community at the OTU level showed that the contribution rates of principal component 1(PC1) and principal component 2(PC2) flora structure were 43.15% and 23.79%,respectively,and the bacterial flora structure was influenced by PC1 in the Fenlong cultivation treatment and by PC2 in the rotary tillage and no tillage. Redundancy analysis revealed that the first two ranking axes together explained 69.09% of the variation in the bacterial community. Available phosphorus,alkaline nitrogen and pH value were important factors affecting the bacterial community,which were significantly correlated with the community distribution of Proteobacteria,Nitrospirae,Planctomycetes,Actinobacteria and Chlorobi. 【Conclusion】Short-term differences in tillage practices can alter the diversity of bacterial communities in rice paddies to some extents,and the differences between tillage practices are mainly reflected in the relative abundance of bacterial flora. The available phosphorus,alkaline nitrogen and pH of the rhizosphere soils in rice are important factors influencing the distribution of bacterial communities. From the perspective of soil microbial community formation,Fenlong cultivation is pre-ferable to rotary tillage and no tillage.
Key words: rice; Fenlong cultivation; rotary tillage; no tillage; soil bacteria; diversity of community structure; high-throughput sequencing
Foundation item: Guangxi Natural Science Foundation(2018GXNSFAA281012); Guangxi Science and Technology Key Project(Guike AA16380017); Science and Technology Development Project of Guangxi Academy of Agricultural Sciences(Guinongke 2016JZ02)
0 引言
【研究意义】土壤微生物作为土壤生态系统中最活跃的部分,通过分解动植物残体参与土壤微生态的营养物质转化循环和能量传递,是衡量土壤肥力的重要指标之一(Brussaard et al.,2007;Heijden and Wagg,2013)。土壤细菌作为土壤微生物中最大的类群(Nacke et al.,2011),约占微生物总量的70%~90%,可调节土壤结构与肥力的稳定性、养分利用效率和植物生长发育等(Sims et al.,2013;Edwards et al.,2015)。同时,土壤细菌比较敏感,其群落结构组成及多样性易受土壤类型、土壤理化性质、施肥方式、耕作方式和植被类型等多方面因素的影響(钟文辉和蔡祖聪,2004;Gil et al.,2011;刘昌等,2018;袁仁文等,2020)。已有研究表明,少免耕、轻耕、旋耕、翻耕和深松等耕作措施能不同程度改变土壤微生物学特性(樊晓刚等,2010;路丹等,2015;陈力力等,2018;潘孝晨等,2019)。因此,研究稻田短期不同耕作方式对水稻根际土壤细菌群落结构组成和多样性的影响,对解析水稻根际土壤微生物的形成机制及水稻种植耕作方式的选择具有重要意义。【前人研究进展】近年来,不同耕作方式研究已从宏观的作物产量和养分效率等逐渐转向微观的土壤微生态方面。但由于土壤微生物对环境条件非常敏感,采样时期、土壤耕作年限、土壤深度及研究方法等不同也导致研究结果对土壤微生物数量、微生物生物量碳氮和多样性等的影响各不相同(景依葶和毛宁,2018;潘孝晨等,2019)。Minoshima等(2007)研究认为耕作可改变土壤微生物群落的动力学特征;陈冬林等(2010)研究表明耕翻可增加好气性细菌并减少嫌气性细菌的数量;孔凡磊等(2011)研究发现,长期免耕处理土壤微生物生物量碳在0~5 cm土层增加,翻耕和旋耕处理则在5~10和10~20 cm土层显著增加;姬艳艳等(2013)采用Biolog-ECO微平板检测法研究发现,免耕处理的土壤微生物功能多样性指数、优势度指数和丰富度指数比翻耕和旋耕处理显著增加;郭梨锦等(2013)研究表明,与翻耕相比,短期免耕表层土壤革兰氏阳性菌/阴性菌显著提高、Shannon-Winner指数显著降低;路丹等(2015)采用高通量测序研究发现,免耕和垄作有利于提高稻田土壤微生物多样性指数;赵亚丽等(2015)研究表明,深松耕作对土壤微生物多样性影响最大,微生物多样性指数表现为深松耕作>传统旋耕>免耕; 程教擘等(2017)采用平板培养计数法研究发现免耕土壤的细菌总量高于翻耕;陈力力等(2018)研究发现稻田免耕和翻耕处理间的细菌多样性指数和菌群物种相对丰度差异不显著;刘洪坤和严贤春(2019)研究结果显示,果园土壤细菌数量表现为翻耕>旋耕>免耕,且不同耕作方式间差异显著。可见,不同耕作方式间土壤微生物数量、群落结构及多样性和微生物生物量均存在一定差异,也必然影响土壤微生物多样性,特别是在土壤中占比最高的细菌类群。关于短期耕作对土壤微生物变化的影响,有学者认为短期耕作可改变土壤微生物群落的动力学特征、细菌和真菌的生物量(Minoshima et al.,2007;郭梨锦等,2013),但也有研究认为土壤微生物多样性相对稳定,短期耕作不会对其产生影响,只有长期耕作才能改善土壤微生物的群落结构和多样性(Luo et al.,2015;孙瑞波等,2015)。【本研究切入点】粉垄耕作是一种新型全耕层深耕深松耕作技术,已有研究证实,粉垄耕作能降低土壤容重、增加土壤蓄水量(杨雪等,2013),可改变土壤团聚体颗粒组成、增加土壤孔隙度(王世佳等,2020),同时提高作物产量和养分效率,且其优势可保持多年(韦本辉等,2012;甘秀芹等,2014;Zhai et al.,2017,2019)。目前,关于粉垄耕作栽培对水稻根际土壤微生物影响的研究较少,也缺乏短期耕作条件下粉垄与其他耕作方式对水稻根际土壤细菌群落多样性影响的对比研究。【拟解决的关键问题】利用Illumina MiSeq高通量测序技术,研究短期不同耕作方式下水稻根际土壤细菌多样性的变化差异,探索耕作方式对水稻根际土壤主要优势细菌群落结构和多样性的影响,为阐释耕作对稻田土壤微生物多样性的形成机制提供科学依据,也为今后水稻种植耕作方式的选择提供参考。
1 材料与方法
1. 1 试验材料
试验于2017年2—7月在广西农业科学院经济作物研究所试验基地进行(东经107°86′,北纬23°03′)。供试水稻品种为H两优991,购自广西兆和种业有限公司。供试土壤为红壤,耕作前采集0~15 cm土层土壤,测定土壤理化性质:pH 6.12(土水比1∶2.5),有机质含量26.73 g/kg,全氮1.46 g/kg,全磷0.88 g/kg,全钾13.62 g/kg,碱解氮71.80 mg/kg,速效磷48.03 mg/kg,速效钾181.74 mg/kg。
1. 2 试验方法
1. 2. 1 试验方法 试验采用大田小区试验,小区面积30 m2(5 m×6 m),小区四周用宽42 cm的塑料隔板隔开(隔板插入土壤约30 cm深),随机区组排列,3次重复。设旋耕、免耕和粉垄等3种耕作处理:旋耕,即常规浆耕,移栽前1 d在稻田灌水后用传统拖拉机一次性进行浆耙耕作,深度约15 cm;免耕,即不进行耕作,于移栽前1 d 进行稻田灌水软土;粉垄,干田时使用自走式粉垄深耕深松机械(广西五丰机械有限公司)进行耕作整地,耕作深度28 cm,移栽前1 d灌水至干土吸饱水并保持约5 cm水层。
水稻于3月21日采用塑盘浆播进行育秧,秧苗3叶1心时进行抛秧,抛栽密度为30万蔸/ha。水稻生育期内共施用N 225.0 kg/ha、P2O5 112.5 kg/ha和K2O 270.0 kg/ha,分为基肥和3次追肥(抛秧后7和12 d、幼穗分化前7 d)分次施入。水分干湿交替管理,除种植前耕作方式不同外,其他田间管理措施一致。
1. 2. 2 土壤样品采集 在水稻成熟期,各处理随机采集5株水稻根际土壤。具体方法:先去掉表层1 cm 左右的土壤,从土中挖出水稻植株抖掉根系上松散的土,然后刷下与根系紧密结合的土即为根际土壤,土样在田间充分混匀,并剔除动植物残体、石块等杂物后,用四分法取适量过20目筛,装入无菌离心管后立即用液氮速冻,存放于-80 ℃冰箱用于土壤细菌群落结构多样性分析,其余土壤置于通风处风干用于测定土壤pH、有机质和速效氮磷钾等养分。每处理各设3个生物学重复。
1. 2. 3 MiSeq文库制备及高通量测序 采用 MIO-BIO PowerSoil DNA Isolation Kit试剂盒提取不同处理的水稻根际土壤基因组DNA,经1.2%琼脂糖凝胶电泳检测后送至微基生物科技(上海)有限公司进行文库构建和Illumina MiSeq高通量测序。采用两步PCR扩增构建文库:采用特异引物515F(5'-GTGCC AGCMGCCGCGGTAA-3')和926R(5'-CCGTCAA TTCMTTTGAGTTT-3')扩增16S rRNA序列的V4~V5目的片段,将目的片段用AxyPrep DNA凝胶回收试剂盒进行胶回收,以回收产物为模板进行二次PCR扩增,再次进行二次PCR扩增产物胶回收;采用FTC-3000TM real-time PCR仪对回收产物进行实时荧光定量PCR检测土壤基因组DNA拷贝数;最后,进行Illumina MiSeq 2x300 bp高通量测序。
1. 2. 4 测序数据生物信息学分析 对MiSeq测序得到的PE reads首先根据Barcode区分每个样本,接着对序列质量进行质控和过滤,再根据重叠关系进行拼接,拼接后的序列再次进行质控和过滤,最后得到优化序列。利用USEARCH将拼接好的优化序列在97%相似性下进行聚类,得到各样品OTU的代表序列,利用Mothur和Adobe Illustrator CS6绘制Venn图。通过Mothur将OTU代表序列在Silva 128、Greengene和RDP数据库中进行物种注释分析,分别统计各样品在不同分类水平上的序列数。同时采用Mothur对OTU进行Alpha多样性分析,计算Chao、ACE、Shannon和Simpson指数;基于分类学信息分析其Beta多样性,运用主成分分析方差分解将多组数据的差异反映在二维坐标图上,坐标轴取能最大反映方差值的2个特征值,即有效反映样品间的差异和距离。经Weighted UniFrac分析后,使用非加权组平均法(UPGMA)构建样品树状结构聚类图,对各样品OTU的组成情况进行相似性分析。此外,采用Canoco 4.5对土壤优势细菌门群落和土壤理化性质进行冗余(RDA)分析。
1. 2. 5 土壤理化性质测定 土壤pH采用酸度计法(土水比为1∶2.5)测定,土壤有机质采用重铬酸钾容量法测定,土壤全氮采用半微量開氏法测定,土壤全磷采用NaOH熔融钼锑抗比色法测定,土壤全钾采用NaOH熔融火焰光度法测定,土壤碱解氮采用碱解扩散法测定,土壤速效磷采用NH4F/HCl浸提钼锑抗比色法测定,土壤速效钾采用醋酸铵浸提火焰光度法测定。
1. 3 统计分析
土壤理化性质试验数据采用Excel 2019进行整理,并以SPSS 22.0进行方差分析(ANOVA)、细菌丰度差异显著性分析及细菌菌群与土壤理化性质间的Pearson相关分析。
2 结果与分析
2. 1 不同耕作处理水稻根际土壤细菌群落高通量文库评价结果
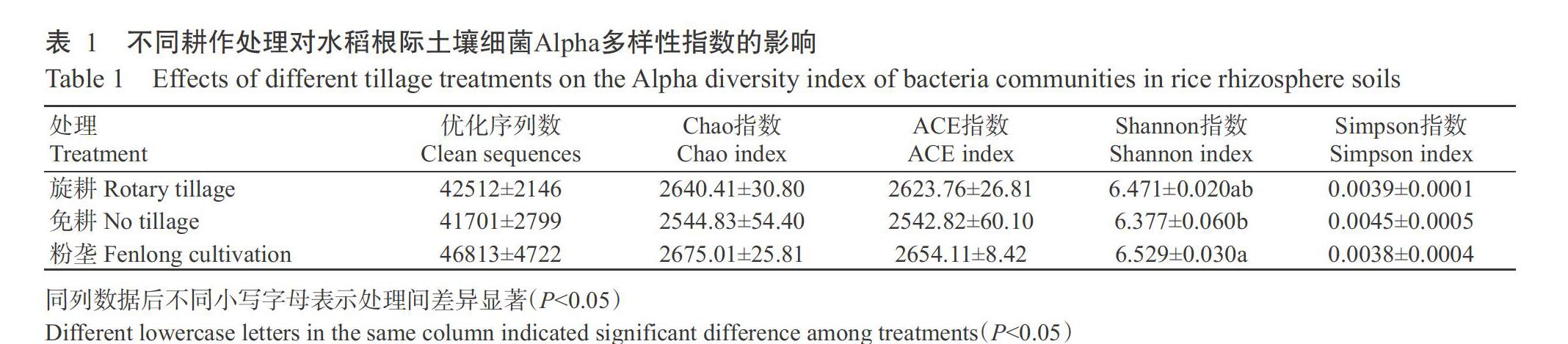
基于细菌16S rRNA序列分析,从各处理中共得到有效序列687725条,对原始数据进行Barcode标签序列过滤后,旋耕、免耕和粉垄处理分别得到优化序列42512条(有效率69.13%)、41701条(有效率69.15%)和46813条(有效率68.16%)(表1)。旋耕、免耕和粉垄处理样品文库覆盖率均较高,分别为98.96%、98.93%和99.04%,说明即使开展更深的测序几乎也不会产生更多OTUs,即样品土壤的测序文库已达饱和状态,所构建文库包含样品中大部分细菌种类,能较好地反映土壤细菌群落结构。
2. 2 水稻根际土壤细菌Alpha多样性分析结果
为了解旋耕、免耕和粉垄处理下水稻根际土壤细菌多样性差异,分别对细菌菌群丰富度(Chao指数和ACE指数)和细菌群落多样性(Shannon指数和Simpson指数)进行分析。结果(表1)显示,3种耕作处理水稻根际土壤细菌的Chao指数范围在2544.83~2675.01,ACE指数范围在2542.82~2654.11,Simpson指数范围在0.0038~0.0045,以上Alpha多样性指数在不同处理间的差异均未达显著水平(P>0.05,下同);Shannon指数范围在6.377~6.529,排序为粉垄>旋耕>免耕,粉垄与免耕处理间差异显著(P<0.05,下同)。说明不同耕作方式下水稻根际土壤细菌群落丰富度差异不明显,但粉垄处理的细菌群落多样性高于免耕处理。
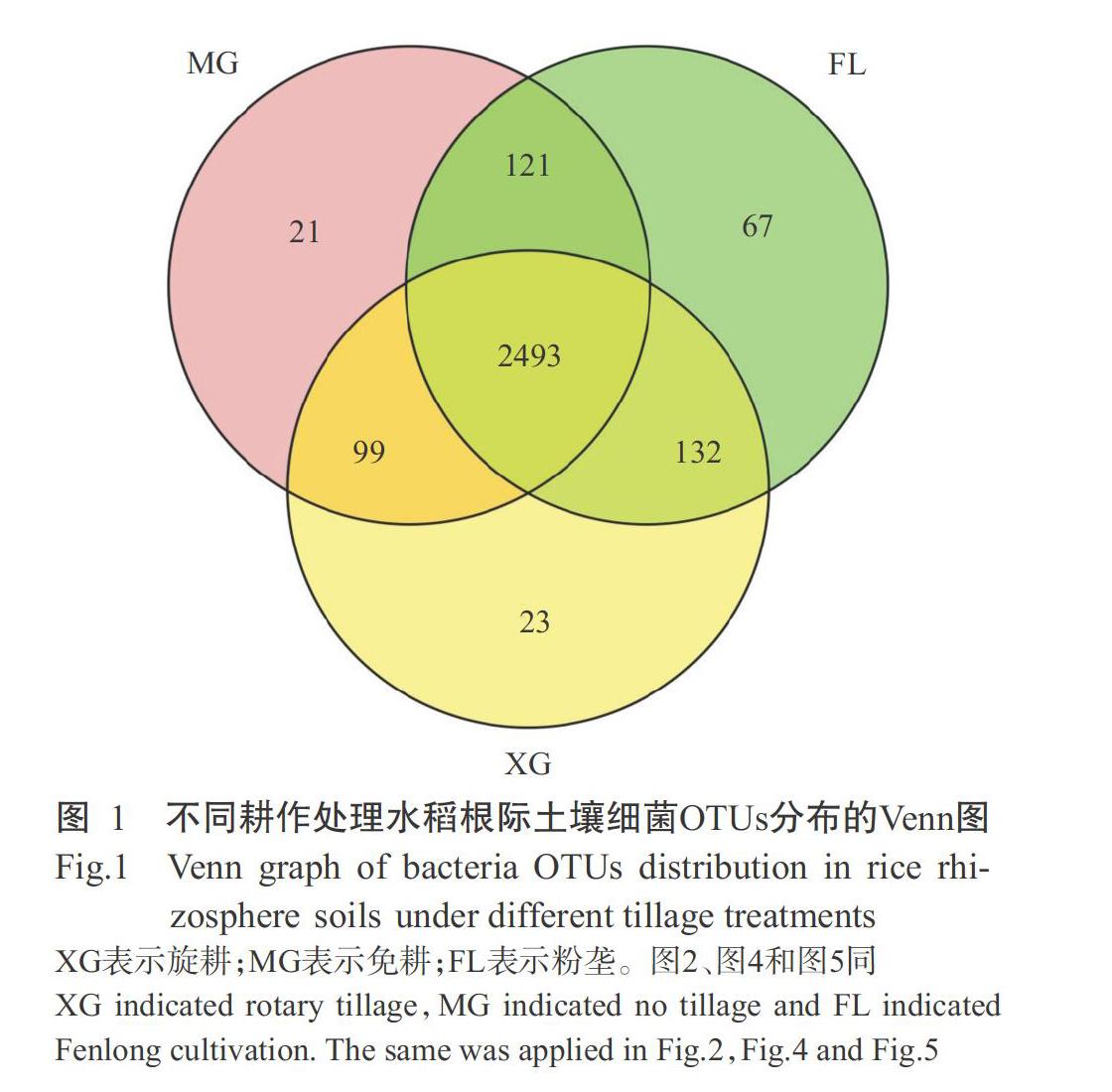
2. 3 不同耕作处理水稻根际土壤细菌OTUs分布情况
对有效序列进行质控、拼接和优化,通过RDP数据库注释及对97%相似水平下的OTU进行生物信息统计分析,结果表明,在旋耕、免耕和粉垄处理水稻根际土壤中分别获得2747、2734和2813个OTUs。OTU均一化处理后绘制Venn图(图1),发现3个耕作处理共有OTU为2493个,旋耕、免耕和粉垄处理特有OTU分别为23、21和67个,旋耕和粉垄处理共有132个OTUs,免耕和粉垄处理共有121个OTUs,旋耕和免耕处理共有99个OTUs。说明3种耕作处理的水稻根际土壤中细菌群落OTU分布既有共性又存在差异。
2. 4 基于物种分类的水稻根际土壤细菌群落结构组成及多样性分析结果
利用Illumina MiSeq高通量测序技术和物种分类分析土壤细菌群落,结果显示,3种耕作处理水稻根际土壤微生物细菌群落共得到206个种,隶属于47门48纲85目134科217属。
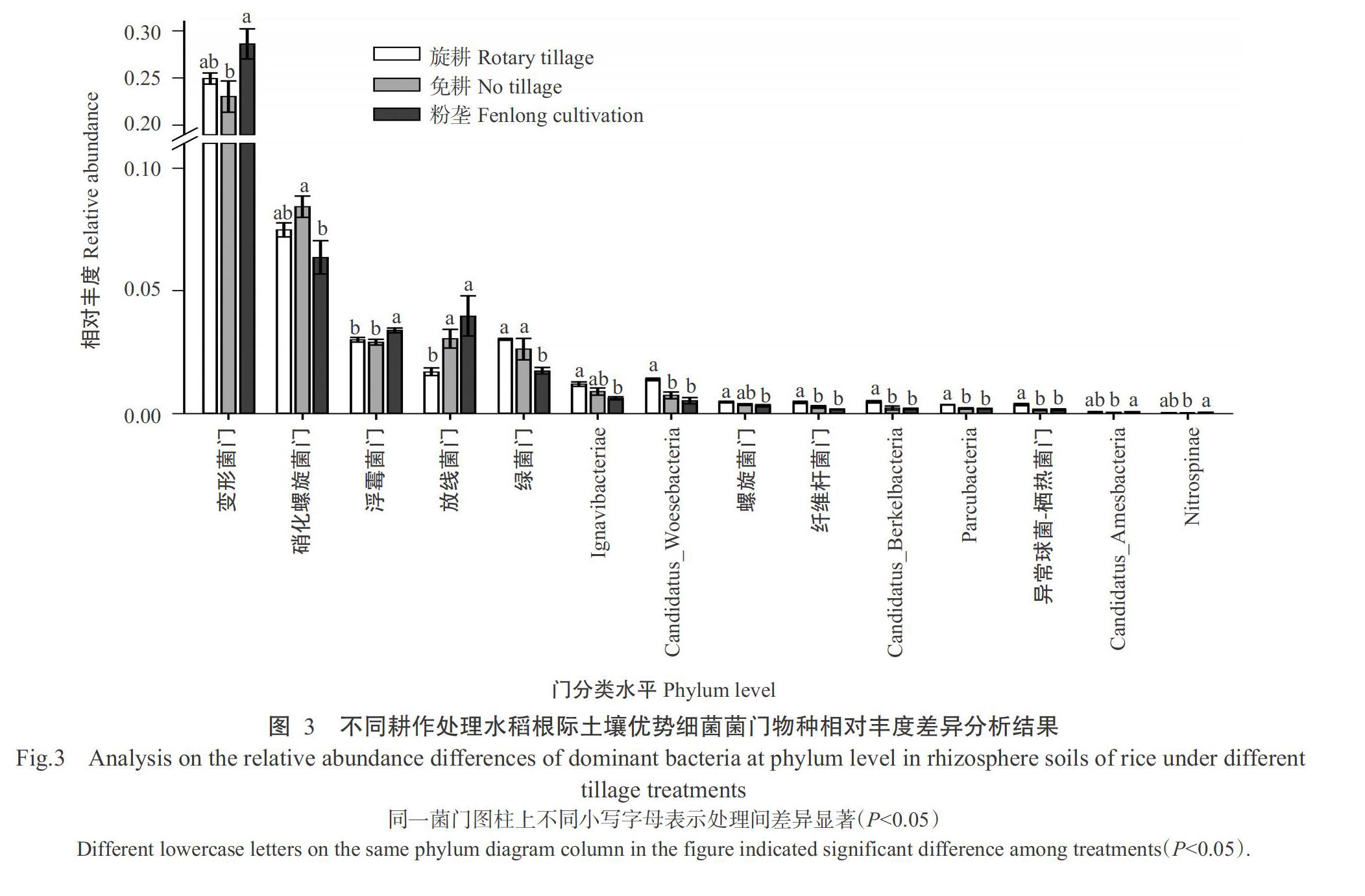
为了解不同耕作处理下水稻根际土壤物种群落组成多样性,在门分类水平上对细菌群落组成和相对丰度进行分析,结果(图2)显示,旋耕、免耕和粉垄处理水稻根际土壤微生物细菌群落组成多样性丰富,3种耕作方式下细菌物种总相对丰度分别为98.05%、98.23%和98.32%,主要含有变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、硝化螺旋菌门(Nitrospirae)、绿菌门(Chlorobi)、装甲菌门(Armatimonadetes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、Latescibacteria、浮霉菌门(Planctomycetes)和疣微菌门(Verrucomicrobia)等12个已知菌门,共占比90.88%~93.81%。其中,变形菌门(占比平均数23.06%~28.63%)、绿弯菌门(占比平均数21.32%~25.92%)、酸杆菌门(占比平均数9.53%~15.88%)和硝化螺旋菌门(占比5.11%~7.49%)在3种处理耕作土壤细菌群落结构中占主导地位,是最主要的细菌类群,共占比69.96%~73.51%。
从门分类水平上对物种相对丰度进行Duncans多重比较分析,结果(图3)显示,旋耕、免耕和粉垄处理有14个菌门存在显著差异,分别为变形菌门、硝化螺旋菌门、放线菌门、浮霉菌門、绿菌门、Ignavibacteriae、Candidatus_Woesebacteria、螺旋菌门(Spirochaetae)、纤维杆菌门(Fibrobacteres)、Candidatus_Berkelbacteria、Parcubacteria、异常球菌—栖热菌门(Deinococcus-Thermus)、Candidatus_Amesbacteria和Nitrospinae。其中,变形菌门、硝化螺旋菌门、浮霉菌门、放线菌门和绿菌门等主要优势菌门的相对丰度在3种耕作方式间差异显著,具体表现:变形菌门相对丰度为粉垄(28.63%)显著高于免耕(23.06%);硝化螺旋菌门相对丰度为免耕(8.43%)显著高于粉垄(6.35%);浮霉菌门相对丰度为粉垄(3.37%)显著高于旋耕(2.99%)和免耕(2.89%);放线菌门相对丰度为粉垄(3.97%)和免耕(3.04%)显著高于旋耕(1.70%);绿菌门相对丰度为旋耕(3.01%)和免耕(2.62%)显著高于粉垄(1.74%);Ignavibacteriae和螺旋菌门相对丰度为旋耕(1.18%和0.46%)显著高于粉垄(0.61%和0.31%),免耕(0.88%和0.36%)与其他2种耕作方式间无显著差异;Candidatus_Woesebacteria、Candidatus_Berkelbacteria、纤维杆菌门、Parcubacteria和异常球菌—栖热菌门5个细菌门都是旋耕显著高于免耕和粉垄;Candidatus_Amesbacteria和Nitrospinae相对丰度为粉垄显著高于免耕,旋耕与其他2种耕作方式间无显著差异。说明不同耕作处理水稻根际土壤的细菌门水平群落结构组成基本相同,但其群落相对丰度差异较明显。
2. 5 水稻根际土壤细菌群落Beta多样性分析结果
2. 5. 1 基于系统发育的相似度聚类分析 Weighted UniFrac展示各样品间的关系,即组成越相似的样品,其聚类关系越近。聚类分析结果(图4)表明,相同耕作方式土壤样品的OTU水平相似,不同耕作方式下旋耕和免耕样品的相似性较高,粉垄与旋耕和免耕的相似性相对较低。
2. 5. 2 基于OTU的主成分分析 为了解不同耕作方式下水稻根际土壤微生物群落组成的结构特征,通过分析不同样品OTU(97%相似性)组成,对不同耕作处理水稻根际土壤细菌群落数据进行主成分分析。由图5可看出,3种不同耕作处理的水稻根际土壤样品分布离散,并未聚在一起,表明样品间细菌群落存在差异。以纵横坐标轴的零基准线为参考进行主成成分分析,第一主成分(PC1)样品中菌群结构的差异性贡献率为43.15%,粉垄处理与PC1轴相距较近,说明粉垄处理水稻根际土壤细菌菌群结构受PC1影响明显;第二主成分(PC2)的样品中菌群结构的差异性贡献率为23.79%,旋耕和免耕与PC2轴相距均较近,说明旋耕和免耕处理根际土壤细菌菌群结构受PC2影响明显。因此,通过主成分分析可知,细菌群落PC1和PC2共解释66.94%的样品间差异性,旋耕、免耕和粉垄处理的水稻根际土壤细菌群落结构存在明显差异。
2. 6 水稻根际土壤细菌主要群落与理化性质的关系
2. 6. 1 不同耕作处理水稻根际土壤理化性质分析
由表2可知,3种耕作处理水稻根际土壤的pH为4.48~4.95,均偏酸性,表现为粉垄处理显著高于旋耕和免耕处理;土壤有机质含量为22.68~27.04 g/kg,粉垄处理显著低于旋耕和免耕处理;土壤碱解氮含量为81.86~100.16 mg/kg,粉垄处理显著低于旋耕和免耕处理;土壤速效磷含量为36.36~69.94 mg/kg,旋耕处理最高,粉垄处理最低,各处理间差异显著;土壤速效钾含量为171.45~246.80 mg/kg,免耕处理最高,旋耕处理最低,各处理间差异显著。由此可知,不同耕作方式处理下水稻根际土壤理化性质存在明显差异。
2. 6. 2 不同耕作处理水稻根际土壤细菌优势菌群与土壤理化性质的RDA分析 为了解旋耕、免耕和粉垄3种不同耕作方式下水稻根际土壤细菌群落与土壤理化性质的关系,将pH、有机质、碱解氮、速效磷和速效钾土壤理化因子与土壤优势细菌门进行RDA分析。结果(图6)显示,RDA1和RDA2的特征值分别为45.05%和24.04%,说明前2个排序轴共解释69.09%细菌群落变化。土壤pH与RDA1轴呈正相关,碱解氮、速效磷、速效钾和有机质则与RDA1轴呈负相关;5个土壤因子均与RDA2轴呈负相关。不同耕作处理的样品分布在不同象限内,粉垄处理与土壤pH分布在同一象限内,免耕和旋耕處理与碱解氮、速效磷和有机质等土壤因子更接近,说明不同耕作处理水稻根际土壤细菌群落分布受不同土壤环境因子的影响。
2. 6. 3 不同耕作处理水稻根际土壤细菌主要菌群与土壤理化性质的Pearson相关分析 为进一步明确不同耕作方式下水稻根际土壤细菌群落与土壤理化性质的相关性,对门分类水平相对丰度大于0.5%的主要细菌群落与土壤理化因子间进行Pearson相关分析,结果(表3)表明,在14个主要细菌门中,有8个细菌门与土壤理化性质显著相关。其中,变形菌门与pH呈显著正相关、与碱解氮呈显著负相关;硝化螺旋菌门和芽单胞菌门与碱解氮呈显著或极显著(P<0.01,下同)正相关;浮霉菌门与pH呈显著正相关、与有机质呈极显著负相关、与碱解氮和速效磷呈显著负相关;放线菌门与速效磷呈显著负相关;绿菌门与有机质和速效磷呈显著或极显著正相关、与pH呈显著负相关;Ignavibacteriae与速效磷呈极显著正相关;Candidatus_Woesebacteria与速效磷呈显著正相关、与速效钾呈显著负相关。可见,pH、碱解氮和速效磷是影响细菌群落的重要因子,而速效钾对细菌群落的影响最小。
3 讨论
土壤微生物多样性丰富有利于维持土壤生态系统的稳定(Cardinale et al.,2006)。土壤微生物群落多样性评价的重要指标就是多样性指数,多样性指数越高说明微生物群落多样性越丰富、菌群分布更均匀(Caporaso et al.,2010)。本研究的Alpha多样性指数分析结果表明,不同耕作处理的水稻根际土壤细菌群落丰富度指数差异不显著,群落组成分析结果也表明旋耕、免耕和粉垄3种耕作方式下细菌物种总相对丰度分别为98.05%、98.23%和98.32%,无明显差异,说明不同耕作方式下的水稻根际土壤细菌群落物种数量无显著差异。土壤细菌群落丰富度差异不显著可能与试验周期较短有关,微生物繁殖增殖和物种数量的提升需经过一定周期,同时存在不同微生物群落间丰度上升和下降的相互抵消,导致短期不同耕作方式处理的细菌群落物种数量无显著差异。土壤细菌群落的Shannon指数表现为粉垄处理显著高于免耕处理,表明粉垄处理较免耕处理其细菌群落更具多样性,与郭梨锦等(2013)研究指出短期免耕显著降低稻田土壤微生物群落Shannon-Winner多样性指数的结果一致,可能与不同耕作方式造成根际土壤通气状况不同有关,免耕处理有较强的厌氧条件,而短期粉垄耕作改善了土壤通气状况,因此造成不同耕作方式下微生物群落丰度的差异。
土壤细菌群落结构组成受种植作物和土壤环境的影响,不同农田生态系统中细菌种群的组成和丰度存在一定差异(Niu et al.,2017)。路丹等(2015)研究发现,稻田短期免耕和垄作土壤优势微生物为变形菌门、绿弯菌门、硝化螺杆菌门和酸杆菌门等10个菌门。袁红朝等(2015)研究表明变形菌门、酸杆菌门和绿弯菌门为稻田土壤细菌主要类群。陈力力等(2018)研究显示,水稻—油菜双序列复种免耕和翻耕稻田土壤细菌中主要优势菌群依次为绿弯菌门、变形菌门、酸杆菌门、放线菌门和硝化螺杆菌门。本研究的细菌群落组成分析结果表明,3种不同耕作方式下水稻根际土壤细菌主要菌门为绿弯菌门、变形菌门、酸杆菌门、硝化螺旋菌门等菌群,与路丹等(2015)、袁红朝等(2015)、陈力力等(2018)对稻田土壤细菌群落的研究结果相似;3种不同耕作处理水稻根际土壤的细菌群落结构组成差异分析显示变形菌门、硝化螺旋菌门、浮霉菌门、放线菌门和绿菌门等14个菌门在相对丰度上存在显著差异;种群相对丰度变化趋势分析发现,最大优势菌门变形菌门相对丰度表现为粉垄显著高于免耕。此外,菌纲水平差异分析显示3种耕作处理间主要是变形菌门的β变形菌纲(β-Proteobacteria)差异显著。变形菌门是细菌中的最大菌门,包含多种代谢种类的细菌,其中β变形菌具有共生性,与许多营养物的利用有关(Li et al.,2016)。免耕处理水稻根际土壤中的硝化螺旋菌门相对丰度明显高于粉垄,旋耕居中,硝化螺旋菌门是亚硝化反应的主要微生物,可将亚硝酸盐氧化成硝酸盐,在氮循环中具有不可替代的生态作用(You et al.,2009;曹雁等,2017)。浮霉菌门相对丰度为粉垄显著高于旋耕和免耕处理,浮霉菌门可利用亚硝酸盐氧化铵离子生成氮气以获得能量,对全球氮循环具有重要意义(曹雁等,2017)。故推测变形菌门、硝化螺旋菌门和浮霉菌门的相对丰度变化可能参与调节不同耕作方式下水稻根际土壤中氮素的循环利用。放线菌门是植物根际土壤中重要的类群,在促进植物生长及防止病害等方面发挥重要作用(Doumbou et al.,2001;Roopa and Gadag,2019)。本研究中,放线菌门相对丰度在旋耕处理(1.70%)中显著低于粉垄(3.97%)和免耕(3.04%)处理,具体功能还有待深入研究。
土壤理化性状差异能显著影响微生物群落组成(Wu et al.,2008;秦红灵等,2011)。本研究中,不同耕作方式下水稻根际土壤微生物群落结构与环境因子关系的RDA和相关分析结果表明,pH、碱解氮、速效磷、速效钾和有机质均是影响土壤细菌群落分布的因素,其中pH、碱解氮和速效磷是影响细菌群落的重要因子。pH是影响土壤微生物群落结构的重要因素(Lauber et al.,2009)。不同耕作方式下,水稻根际土壤中变形菌门、浮霉菌门和绿菌门相对丰度与pH均有显著相关性;种植前耕层土壤pH为6.12,种植后3种耕作处理水稻根际土壤pH较耕层土壤明显降低,同时粉垄处理的Shannon多样性指数显著高于免耕处理,与Hartman等(2008)研究认为在土壤pH低于6.5时,微生物多样性会随pH降低而减少的结果吻合。曹雁等(2017)研究表明,变形菌门、浮霉菌门和硝化螺旋菌门是脱氮细菌,与氮素利用相关。本研究发现3种耕作处理水稻根际土壤的碱解氮含量表现为免耕最高、粉垄最低,变形菌门相对丰度表现为粉垄处理显著高于免耕处理,浮霉菌门相对丰度表现为粉垄处理显著高于旋耕和免耕处理,硝化螺旋菌门相对丰度则是免耕处理显著高于粉垄处理,相关分析结果也显示变形菌门和浮霉菌门相对丰度与碱解氮含量呈负相关、硝化螺旋菌门相对丰度与碱解氮含量呈正相关,说明变形菌门、硝化螺旋菌门和浮霉菌门可能与土壤氮素的利用相关。此外,本研究中的放线菌门和浮霉菌门相对丰度与土壤速效磷含量呈显著负相关,粉垄处理水稻根际土壤速效磷含量较低,放线菌门和浮霉菌门菌门相对丰度较旋耕和免耕处理增加,说明粉垄处理速效磷含量降低能激发放线菌门和浮霉菌门的增殖增长,与李金融等(2018)研究复垦土壤多样性时发现放线菌门菌群与速效磷、速效钾和有机质含量呈负相关,放线菌门喜低水分、低营养土壤环境的结果一致,但与马垒等(2019)研究认为放线菌门、浮霉菌门和拟杆菌门相对丰度随着磷肥施入逐渐升高的结果不同,可能与二者土壤环境条件差异较大有关。马垒等(2019)的研究对象为砂姜黑土,而本研究是在多呈厌氧的水田。此外,本研究中部分优势菌群与不同耕作处理间的养分指标变化具有相关性,且对种植后耕层土壤的养分分析结果也表明,免耕处理多种养分主要在表层富集,粉垄处理的土壤养分则为上层降低、下层增加,而旋耕处理中碱解氮和速效磷与免耕相比也有在深层增加的趋势。因此推测不同耕作方式间部分菌群相对丰度的差异,可能与不同耕作处理改变细菌群落可利用的养分状况,而引起不同菌群特征发生改变有关。
4 结论
短期不同耕作方式可在一定程度上改变水稻根际土壤细菌群落结构分布和多样性,不同耕作方式间的差异主要体现在细菌群落相对丰度上,而主要优势菌门群落结构组成种类基本相似。土壤pH、碱解氮和速效磷是影响不同耕作方式下水稻根际土壤细菌群落分布的重要因素。从土壤微生物群落形成角度考虑,粉垄栽培优于旋耕和免耕。
参考文献:
曹雁,王桐屿,秦玉洁,韩彬,任君怡. 2017. 厌氧氨氧化反应器脱氮性能及细菌群落多样性分析[J]. 环境科学,38(4):1544-1550. [Cao Y,Wang T Y,Qin Y J,Han B,Ren J Y. 2017. Nitrogen removal characteristics and diversity of microbial community in ANAMMOX reactor[J]. Environmental Science,38(4):1544-1550.]
陈冬林,易镇邪,周文新,屠乃美. 2010. 不同土壤耕作方式下秸秆还田量对晚稻土壤养分与微生物的影响[J]. 环境科学学报,30(8):1722-1728. [Chen D L,Yi Z X,Zhou W X,Tu N M. 2010. Effects of straw return on soil nutrients and microorganisms in late rice under different soil tillage systems[J]. Acta Scientiae Circumstantiae,30(8):1722-1728.]
陈力力,刘金,李梦丹,杨伊磊,邹应斌,黄敏. 2018. 不同耕作方式稻田土壤细菌的多样性[J]. 微生物学杂志,38(4):62-70. [Chen L L,Liu J,Li M D,Yang Y L,Zou Y B,Huang M. 2018. Diversity of bacterial community in paddy fields with different tillage styles[J]. Journal of Microbiology,38(4):62-70.]
程教擘,陈力力,李梦丹,刘金,邹应斌. 2017. 不同耕作方式对稻田土壤微生物的影响[J]. 湖南农业科学,(8):8-10. [Cheng J B,Chen L L,Li M D,Liu J,Zou Y B. 2017. Effects of different tillage methods on soil microorga-nisms in rice field[J]. Hunan Agricultural Sciences,(8):8-10.]
樊晓刚,金轲,李兆君,荣向农. 2010. 不同施肥和耕作制度下土壤微生物多样性研究进展[J]. 植物营养与肥料学报,16(3):744-751. [Fan X G,Jin K,Li Z J,Rong X N. 2010. Soil microbial diversity under different fertilization and tillage practices:A review[J]. Plant Nutrition and Fertilizer Science,16(3):744-751.]
甘秀芹,韦本辉,刘斌,申章佑,劳承英,李艳英,胡泊,吴延勇. 2014. 粉垄后第6季稻田土壤变化与水稻产量品质分析[J]. 南方农业学报,45(9):1603-1607. [Gan X Q,Wei B H,Liu B,Shen Z Y,Lao C Y,Li Y Y,Hu P,Wu Y Y. 2014. Effects of smash-ridging cultivation on soil properties,yield and quality of the sixth season of rice[J]. Journal of Southern Agriculture,45(9):1603-1607.]
郭梨锦,曹凑贵,张枝盛,刘天奇,李成芳. 2013. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响[J]. 农业环境科学学报,32(8):1577-1584. [Guo L J,Cao C G,Zhang Z S,Liu T Q,Li C F. 2013. Short-term effects of tillage practices and wheat-straw returned to rice fields on topsoil microbial community structure and microbial diversity in central China[J]. Journal of Agro-Environment Science,32(8):1577-1584.]
姬艳艳,张贵龙,张瑞,刘玉升,杨殿林,王彩灵. 2013. 耕作方式对农田土壤微生物功能多样性的影响[J]. 中国农学通报,29(6):117-123. [Ji Y Y,Zhang G L,Zhang R,Liu Y S,Yang D L,Wang C L. 2013. Effects of different til-lage modes on metabolic functional diversity of soil microbial community[J]. Chinese Agricultural Science Bu-lletin,29(6):117-123.]
景依葶,毛寧. 2018. 免耕稻田不同剖面土壤微生物多样性及酶活性研究[J]. 陇东学院学报,29(1):54-60. [Jing Y T,Mao N. 2018. Microbial diversity and enzyme activity in different soil profiles of non-tillage paddy fields[J].Journal of Longdong University,29(1):54-60.]
孔凡磊,张明园,范士超,张海林,陈阜. 2011. 耕作方式对长期免耕农田土壤微生物生物量碳的影响[J]. 中国生态农业学报,19(2):240-245. [Kong F L,Zhang M Y,Fan S C,Zhang H L,Chen F. 2011. Effect of tillage practices on soil microbial biomass carbon in the field with long-term non-tillage[J]. Chinese Journal of Eco-Agriculture,19(2):240-245.]
李金融,侯湖平,王琛,张绍良,马静,丁忠义,黄磊,董健,杨永均. 2018. 基于高通量测序的复垦土壤细菌多样性研究[J]. 环境科学与技术,41(12):148-157. [Li J R,Hou H P,Wang C,Zhang S L,Ma J,Ding Z Y,Huang L,Dong J,Yang Y J. 2018. Soil bacteria diversity of reclaimed soil based on high throughput sequencing[J]. Environmental Science & Technology,41(12):148-157.]
刘昌,黄莺,陈雪,喻奇伟,夏忠文,熊晶,谢志勇. 2018. 有机、无机肥配施比例对植烟土壤细菌组成及烤烟产质量的影响[J]. 河南农业科学,47(6):52-58. [Liu C,Huang Y,Chen X,Yu Q W,Xia Z W,Xiong J,Xie Z Y. 2018. Effects of proportion of organic and inorganic fertilizers on tobacco-planting soil bacteria composition,yield and quality of flue-cured tobacco[J]. Journal of Henan Agricultural Sciences,47(6):52-58.]
刘洪坤,严贤春. 2019. 不同耕作方式对果园土壤养分和微生物活性的影响[J]. 西南农业学报,32(3):499-504. [Liu H K,Yan X C. 2019. Variation of soil nutrients and soil microbial activity of different tillage system in orchard[J]. Southwest China Journal of Agricultural Sciences,32(3):499-504.]
路丹,雷靜,韦燕燕,沈方科,黄雁飞,顾明华. 2015. 短期免耕和垄作对稻田土壤微生物群落及多样性指数的影响[J]. 西南农业学报,28(4):1670-1674. [Lu D,Lei J,Wei Y Y,Shen F K,Huang Y F,Gu M H. 2015. Effect of microbial community and diversity index of paddy soil under short no-tillage and ridge tillage[J]. Southwest China Journal of Agricultural Sciences,28(4):1670-1674.]
马垒,郭志彬,王道中,赵炳梓. 2019. 长期三水平磷肥施用梯度对砂姜黑土细菌群落结构和酶活性的影响[J]. 土壤学报,56(6):1459-1470. [Ma L,Guo Z B,Wang D Z,Zhao B Z. 2019. Effect of long-term application of phosphorus fertilizer on soil bacterial community structure and enzymatic activity in lime concretion black soil relative to P application rate[J]. Acta Pedologica Sinica,56(6):1459-1470.]
潘孝晨,唐海明,肖小平,李超,汤文光,汪柯,程凯凯. 2019. 不同土壤耕作方式下稻田土壤微生物多样性研究进展[J]. 中国农学通报,35(23):51-57. [Pan X C,Tang H M,Xiao X P,Li C,Tang W G,Wang K,Cheng K K. 2019. Paddy soil microbial diversity under tillage practices:Research progress[J]. Chinese Agricultural Science Bulletin,35(23):51-57.]
秦红灵,袁红朝,张慧,朱亦君,吴敏娜,魏文学.2011. 红壤坡地利用方式对土壤细菌群落结构的影响[J]. 土壤学报,48(3):594-602. [Qin H L,Yuan H Z,Zhang H,Zhu Y J,Wu M N,Wei W X. 2011. Soil bacteria community structure upland red soil in relation to land use pattern[J]. Acta Pedologica Sinica,48(3):594-602.]
孙瑞波,郭熙盛,王道中,褚海燕. 2015. 长期施用化肥及秸秆还田对砂姜黑土细菌群落的影响[J]. 微生物学通报,42(10):2049-2057. [Sun R B,Guo X S,Wang D Z,Chu H Y. 2015. The impact of long-term application of chemical fertilizers and straw returning on soil bacterial community[J]. Microbiology China,42(10):2049-2057.]
王世佳,蔣代华,朱文国,张蓉蓉,李军伟,韦本辉. 2020. 粉垄耕作对农田赤红壤团聚体结构的影响[J]. 土壤学报,57(2):326-335. [Wang S J,Jiang D H,Zhu W G,Zhang R R,Li J W,Wei B H. 2019. Effect of deep vertical rotary tillage on aggregate structure in farmland of lateritic red soil[J]. Acta Pedologica Sinica,57(2):326-335.]
韦本辉,刘斌,甘秀芹,申章佑,胡泊,李艳英,吴延勇,陆柳英. 2012. 粉垄栽培对水稻产量和品质的影响[J]. 中国农业科学,45(19):3946-3954. [Wei B H,Liu B,Gan X Q,Shen Z Y,Hu P,Li Y Y,Wu Y Y,Lu L Y. 2012. Effect of Fenlong cultivation on yield and quality of rice[J]. Scientia Agricultura Sinica,45(19):3946-3954.]
杨雪,逄焕成,李轶冰,任天志,董国豪,郭智慧,王湘峻. 2013. 深旋松耕作法对华北缺水区壤质黏潮土物理性状及作物生长的影响[J]. 中国农业科学,46(16):3401-3412. [Yang X,Pang H C,Li Y B,Ren T Z,Dong G H,Guo Z H,Wang X J. 2013. Effects of deep rotary sub-soiling tillage on the physical properties and crop growth of the sticky loamy soil in north China[J]. Scientia Agricultura Sinica,46(16):3401-3412.]
袁红朝,吴昊,葛体达,李科林,吴金水,王久荣.2015.长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报,26(6):1807-1813. [Yuan H Z,Wu H,Ge T D,Li K L,Wu J S,Wang J R. 2015. Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils[J]. Chinese Journal of Applied Ecology,26(6):1807-1813.]
袁仁文,刘琳,张蕊,范淑英. 2020. 植物根际分泌物与土壤微生物互作关系的机制研究进展[J]. 中国农学通报,36(2):26-35. [Yuan R W,Liu L,Zhang R,Fan S Y. 2020. The interaction mechanism between plant rhizosphere secretion and soil microbe:A review[J]. Chinese Agricultural Science Bulletin,36(2):26-35.]
赵亚丽,郭海斌,薛志伟,穆心愿,李潮海. 2015. 耕作方式与秸秆还田对土壤微生物数量、酶活性及作物产量的影响[J]. 应用生态学报,26(6):1785-1792. [Zhao Y L,Guo H B,Xue Z W,Mu X Y,Li C H. 2015. Effects of tillage and straw returning on microorganism quantity,enzyme activities in soils and grain yield[J]. Chinese Journal of Applied Ecology,26(6):1785-1792.]
钟文辉,蔡祖聪.2004. 土壤管理措施及环境因素对土壤微生物多样性影响研究进展[J]. 生物多样性,12(4):456-465.[Zhong W H,Cai Z C. 2004. Effect of soil management practices and environmental factors on soil microbial diversity:A review[J]. Biodiversity Science,12(4): 456-465.]
Brussaard L,de Ruiter P C,Brown G G. 2007. Soil biodiversity for agricultural sustainability[J]. Agriculture, Ecosystems & Environment,121(3):233-244.
Caporaso J G,Kuczynski J,Stombaugh J,Bittinger K,Bushman F D,Costello E K,Fierer N,Pe?a A G,Goodrich J K,Gordon J I,Huttley G A, Kelley S T,Knights D,Koenig J E,Ley R E,Lozupone C A,McDonald D,Muegge B D,Pirrung M,Reeder J,Sevinsky J R,Turnbaugh P J,Walters W A,Widmann J,Yatsunenko T,Zaneveld J,Knight R. 2010. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods,7:335-336.
Cardinale B J,Srivastava D S,Duffy J E,Wright J P,Dow-ning A L,Sankaran M,Jouseau C. 2006. Effects of biodiversity on the functioning of trophic groups and ecosystems[J]. Nature,443:989-992.
Doumbou C L,Sallove M K H,Crawford D L,Beaulieu C. 2001. Actinomycetes,spromising tools to control plant diseases and to promote plant growth[J]. Phytoprotection,82(3):85-102.
Edwards J,Johnson C,Santos-Medellín C,Lurie E,Podishetty N K,Bhatnagar S, Eisen J A. 2015. Structure,variation,and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences of the United States of America,112(8):E911-E920.
Gil S V,Meriles J,Conforto C,Basanta M,Radl V,Hagn A,Schloter M,March G J. 2011. Response of soil microbial communities to different management practices in surface soils of a soybean agro-ecosystem in Argentina[J]. European Journal of Soil Biology,47:55-60.
Hartman W H,Richardson C J,Vilgalys R,Bruland G L.2008. Environmental and anthropogenic controls over bacterial communities in wetland soils[J]. Proceedings of the National Academy of Sciences of the United States of America,105(46):17842-17847.
Heijden M G A V D,Wagg C. 2013. Soil microbial diversity and agro-ecosystem functioning[J]. Plant and Soil,363:1-5.
Lauber C L,Hamady M,Knight R,Fierer N. 2009. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J]. Applied and Environmental Microbiology,75(15):5111-5120.
Li Y C,Li Z,Li Z W,Jiang Y H,Weng B Q,Lin W X. 2016. Variations of rhizosphere bacterial communities in tea (Camellia sinensis L.)continuous cropping soil by high-throughput pyrosequencing approach[J]. Journal of Applied Microbiology, 121:787-799.
Luo P Y,Han X R,Wang Y,Han M,Shi H,Liu N,Bai H Z. 2015. Influence of long-term fertilization on soil micro-bial biomass,dehydrogenase activity,and bacterial and fungal community structure in a brown soil of northeast China[J]. Annals of Microbiology,65:533-542.
Minoshima H,Jackson L E,Cavagnaro T R,Moreno S S,Ferris H,Temple S R,Goyal S,Mitchell J P. 2007. Soil food webs and carbon dynamics in response to conservation tillage in California[J]. Soil Science Society of America Journal,71(3):952-963.
Nacke H,Thürmer A,Wollherr A,Will C,Hodac L,Herold N,Sch?ning I,Schrumpf M,Daniel R. 2011. Pyrosequen-cing-based assessment of bacterial community structure along different management types in German forest and grassland soils[J]. PLoS One,6(2):e17000.
Niu J J,Chao J,Xiao Y H,Chen W, Zhang C,Liu X D,Rang Z W,Yin H Q,Dai L J. 2017. Insight into the effects of different cropping systems on soil bacterial community and tobacco bacterial wilt rate[J]. Journal of Basic Microbiology,57(1):3-11.
Roopa K P,Gadag A S. 2019. Management of soil-borne disea-ses of plants through some cultural practices and actinobacteria[J]. Plant Health Under Biotic Stress,1:129-145.
Sims A,Zhang Y Y,Gajaraj S,Brown P B,Hu Z Q. 2013. Toward the development of microbial indicators for wetland assessment[J]. Water Research,47(5):1711-1725.
Wu T H,Chellemi D O,Graham J H,Martin K J,Rosskopf E N. 2008. Comparison of soil bacterial communities under diverse agricultural land management and crop production practices[J]. Microbial Ecology,55:293-310.
You J,Das A,Dolan E M,Hu Z Q. 2009. Ammonia-oxidizing archaea involved in nitrogen removal[J]. Water Research,43(7):1801-1809.
Zhai L C,Xu P,Zhang Z B,Li S K,Xie R Z,Zhai L F,Wei B H. 2017. Effects of deep vertical rotary tillage on dry matter accumulation and grain yield of summer maize in the Huang-Huai-Hai Plain of China[J]. Soil and Tillage Research,170:167-174.
Zhai L C,Xu P,Zhang Z B,Wei B H,Jia X L,Zhang L H. 2019. Improvements in grain yield and nitrogen use efficiency of summer maize by optimizing tillage practice and nitrogen application rate[J]. Agronomy Journal,111(2):666-676.
(責任编辑 王 晖)
