袋料种植淮山药根际土壤细菌多样性的高通量测序分析
2020-01-21劳承英韦本辉周灵芝申章佑李艳英胡泊黄渝岚周佳
劳承英 韦本辉 周灵芝 申章佑 李艳英 胡泊 黄渝岚 周佳

摘要:【目的】比較淮山药袋料种植方法与常规定向结薯种植方法的根际土壤微生物种群多样性,为利用微生物多样性指导淮山药袋料种植提供科学依据。【方法】采集常规淮山药定向结薯种植的根际土壤样品(记为CK3)和袋料种植的根际土壤样品(记为A3),对土壤样品中细菌的16S rDNA序列V4高变区进行PCR扩增,并对扩增产物进行高通量测序,分析土壤样品中细菌群落的多样性及其分布规律。【结果】CK3的pH为6.21,有机质含量为32.2 g/kg;A3的pH为5.98,有机质含量为30.0 g/kg。2种不同种植方法下淮山根际土壤样品中共检测出细菌41门100纲147目292科530属。淮山药根际土壤细菌在门水平上的主要优势类群有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes);在纲水平上的主要优势类群有α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、β-变形菌纲(Betaproteobacteria)、放线菌纲(unidentified-Actinobacteria)和δ-变形菌纲(Deltaproteobacteria)等。在门和纲分类水平上,2种种植方法淮山药根际土壤样品中细菌的优势菌群相似,相对丰度差异不显著(P>0.05),CK3的细菌多样性高于A3。【结论】淮山药袋料种植方法可行,可在旱坡地和石山地等非耕地应用。
关键词: 淮山药;袋料种植;根际土壤;细菌多样性;高通量测序
中图分类号: S632.1 文献标志码: A 文章编号:2095-1191(2020)10-2367-07
High-throughput sequencing analysis of rhizosphere soil bacterial diversity of yam planting in bag material
LAO Cheng-ying, WEI Ben-hui, ZHOU Ling-zhi, SHEN Zhang-you,
LI Yan-ying, HU Po, HUANG Yu-lan, ZHOU Jia*
(Cash Crops Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
Abstract:【Objective】The microbial population diversity in rhizosphere soil between bag material and conventional orientation in yam planting was compared in order to provide scientific basis on the utilization of soil microbial diversity to plant yam in bag material. 【Method】Rhizosphere soil samples from conventional orientation planting method of yam(marked as CK3) and from bag material planting method of yam(marked as A3) were collected in the field. The 16S rDNA sequence V4 high-variable region of rhizosphere soil bacteria in two kinds of different planting methods were amplified by PCR,and then the products of PCR amplification were sequenced with high throughput to analyze the diversity and distribution of bacterial community in soil. 【Result】The pH value of CK3 sample was 6.21,organic matter content was 32.2 g/kg;the pH value of A3 was 5.98,organic matter content was 30.0 g/kg. A total of 530 genera,292 families,147 orders,100 classes and 41 phyla of bacteria were detected in the two soil samples. The advantage groups in rhizosphere soils of yam were Proteobacteria,Acidobacteria,Actinobacteria,Chloroflexi and Gemmatimonadetes on the phylum level. The advantage groups in rhizosphere soils of yam were Alphaproteobacteria,Gammaproteobacteria,Betaproteobacteria,unidentified-Actinobacteria and Deltaproteobacteria on the class level. The structure and composition of bacterial community in rhizosphere soil samples of different planting methods were similar, the relative abundance of the different planting methods had not significant difference on the phylum and class level(P>0.05). Bacterial diversity of CK3 was higher than that of A3. 【Conclusion】The bag material planting method of yam is feasible, and can be applied in uncultivated areas such as dry slope land and stony hillside.
Key words: yam; bag material planting method; rhizosphere soil; bacteria diversity; high throughput sequencing
Foundation item: National Natural Science Foundation of China(31860347); Guangxi Natural Science Foundation(2018GXNSFAA281012); Science and Technology Development Project of Guangxi Academy of Agricultural Sciences(Guinongke2017JM21)
0 引言
【研究意义】淮山药(Dioscorea opposita Thunb.)隶属于薯蓣科薯蓣属,为一年生或多年生单子叶缠绕性藤本植物,可食用部分为肥厚的块茎,药食同源(Hsu et al.,2003),是美味滋补的佳肴,具有较好的经济价值和市场前景(赵令敏等,2019)。但淮山药茎块多数是在疏松的土壤条件下垂直向下生长,种植和采收均需挖深沟,耗时费力(韦本辉,2013)。为降低种植和采收难度,减少种植和收获成本,韦本辉等(2005)发明了淮山定向结薯栽培方法,该方法种植的淮山药商品薯率高,可促进淮山药产量增加、品质改善,并可较大幅度节约人工和成本投入。目前,该方法已在南方淮山药产区大面积推广使用。淮山药袋料种植方法是韦本辉等(2016)在定向结薯栽培方法基础上的另一种创新,该方法能按照品种、种植密度和生态区域的不同,设计不同规格的袋料,在袋料上种植淮山药,并获得产量。土壤微生物可作为土壤肥力的重要衡量指标,对维持土壤生态功能起到重要作用(Nannipieri et al.,2003),同时也是评价土壤质量和生产力水平的重要指标(Kennedy and Smith,1995),因而袋料的肥力状况可通过袋料中土壤微生物进行评价。研究表明,影响土壤微生物种群结构和多样性的因素有多种,可分为自然因素和人为因素两大类。自然因素包括土壤类型、植被类型、温度、湿度和pH等;人为因素包括施肥、除草、农药施用、间套种等人类对土壤的管理利用(赵柏霞,2012)。不同的土壤处理方式、土地耕作方法和管理方式等对土壤微生物多样性的影响不同,Sun等(2004)对6个农业生态系统的土壤进行施用有机肥、化肥和石灰等处理的研究,以未经处理的土壤微生物群落为对照,施用有机肥的土壤微生物群落多样性与对照相似,施用石灰对微生物群落多样性的影响较小,但施用化肥的土壤微生物群落多样性与对照存在明显差异。传统耕作土壤中细菌的数量和多样性均低于免耕土壤,耕作可显著降低土壤中的细菌多样性,且对非根际土壤中细菌的影响比对根际土壤中细菌的影响更显著(Lupwayi et al.,1998)。淮山药袋料种植方法通过人为铺设的塑料膜,为淮山药的生长发育创造了一个与常规方式(淮山药定向结薯种植方法)相对不一样的半封闭环境,这种土壤环境的改变,对土壤微生物的生长生存造成一定影响。因此,探讨淮山药袋料种植方法和定向种植方法下淮山药根际土壤酸度、有机质含量及微生物的种群多样性,对拓宽淮山药的种植用地范围,避免与主要粮食作物抢占耕地具有重要意义。【前人研究进展】高通量测序技术具有可全面、准确获得微生物群落结构信息的特点,已广泛应用于微生物研究中(赵帅等,2016;戴雅婷等,2017;李岩等,2018;任天宝等,2018)。刘元等(2018)采用高通量测序技术分别对怀山药和菜山药根茎中的内生细菌16S rDNA V4区域进行扩增和测序,结果显示怀山药内生菌多样性大于菜山药,怀山药和菜山药根茎中的优势菌属均为狭义梭菌属(Clostridium sensu stricto 1)。康捷等(2019)应用高通量测序技术对麻山药在苗期、花期和收获期时根际土壤微生物群落结构变化进行研究,结果表明细菌多样性和丰富度在麻山药不同生长时期内变化不显著,麻山药根际细菌群落的最优势菌群是变形菌门和酸杆菌门。雷锋杰等(2019)使用第二代高通量测序技术分析野生抚育模式、农田栽参模式和伐林栽参模式3种不同栽培模式下人参根部内生细菌和真菌的丰度和多样性,结果显示野生抚育模式下人参根部内生细菌和真菌的Chao1、ACE和Shannon指数值均高于伐林栽参模式,农田栽参模式下这3种指数均最低,表明栽培模式能显著影响人参根部内生菌的形成和多样性。许姗姗等(2019)通过高通量测序方法研究云南昭通苹果栽培模式与根际土壤微生物菌群的关系,结果表明不同栽培模式影响根际土壤微生物种群,从而影响苹果的生长。张红霞等(2019)采集山药连作2年的植株根际土壤及根茎,采用高通量测序技术研究根际土壤细菌多样性,结果表明山药根际土壤细菌优势群落为变形菌、绿弯菌、酸杆菌和放线菌。【本研究切入点】高通量测序技术可产生测序覆盖度更高的基因数据,在细菌群落组成研究中能真实地反映環境中细菌群落的丰度和多样性。目前,针对不同种植方法下淮山药根际土壤细菌多样性的高通量测序分析研究鲜见报道。【拟解决的关键问题】基于Illumina HiSeq测序平台,采用双末端测序(Paired-End)的方法,对淮山药根际土壤细菌的16S rDNA序列V4高变区进行PCR扩增,并对扩增产物进行高通量测序,分析淮山药袋料种植与常规定向种植方法下淮山药根际土壤细菌群落多样性和分布规律,了解2种不同种植方法下淮山药根际土壤细菌群落的结构、物种组成及差异,探究根际土壤细菌与淮山药的相互关系,为利用微生物多样性指导淮山药袋料种植提供科学依据。
1 材料与方法
1. 1 试验材料
供试材料为桂淮2号淮山药。
1. 2 淮山药种植
1. 2. 1 淮山药定向种植 起垄后在距垄斜面15 cm左右深处铺设塑料薄膜或其他硬质材料,其斜度与水平面成35°左右,在硬质材料上覆土3 cm左右后播种淮山药种薯,淮山药结薯时块茎将顺着硬质材料定向伸长生长。
1. 2. 2 淮山药袋料种植 先在土壤上开出一条深20~30 cm,长1.0~1.2 m、坡度10~15°的种植槽,种植槽内铺设经裁制好的塑料膜,并用圆形木条或铁管压紧,然后填满细松土并在膜内施入肥料,混合形成袋料,最后将塑料膜交叠呈袋状,头部的塑料膜上种植种薯,种薯上覆盖土壤6~8 cm。
1. 3 土壤样品采集
于收获期(2018年4月15日)从广西南宁市隆安县那桐镇大滕村采集淮山药根际土壤。采自淮山药定向种植的土壤样品标记为CK3,采自淮山药袋料种植的土壤样品标记为A3,2种栽培方式的田间管理一致。采集20 cm深的根际土壤,每个小区随机选取5个点的土壤混合成1个样品置于50 mL的无菌管中,并迅速放在液氮中运回实验室。土壤样品过2 mm筛,去除淮山药土壤样品中的杂物后分为2份,一份冻存于-80 ℃冰箱,用于高通量测序进行土壤微生物分析;另一份用于土壤pH和有机质含量测定。
1. 4 土壤样品pH和有机质含量测定
采用电极电位法测定土壤样品pH,用水合热重铬酸钾氧化—比色法测定土壤样品有机质含量(鮑士旦,2000)。
1. 5 土壤样品细菌16S rDNA扩增子V4高变区测序及多样性分析
提取土壤的总DNA,针对细菌16S rDNA扩增子序列V4区域,利用Illumina HiSeq测序平台进行双末端测序。通过对Reads拼接过滤、操作分类单元(OTUs)聚类、物种注释和丰度进行分析,根据物种注释结果,选择每个土壤样品在不同分类水平上丰度排名靠前的物种绘制相对丰度柱形图;再对OTUs进行Alpha多样性指数等的统计和分析。样品测序服务委托北京诺禾致源科技股份有限公司完成。
2 结果与分析
2. 1 土壤样品pH和有机质含量测定结果
2种淮山药种植方法土壤样品的测定结果显示,CK3的pH为6.21,有机质含量为32.2 g/kg;A3的pH为5.98,有机质含量为30.0 g/kg。经方差检验分析,2种种植方法的土壤样品pH存在显著差异(P<0.05,下同),而有机质含量差异不显著(P>0.05,下同)。
2. 2 土壤样品细菌种群多样性分析结果
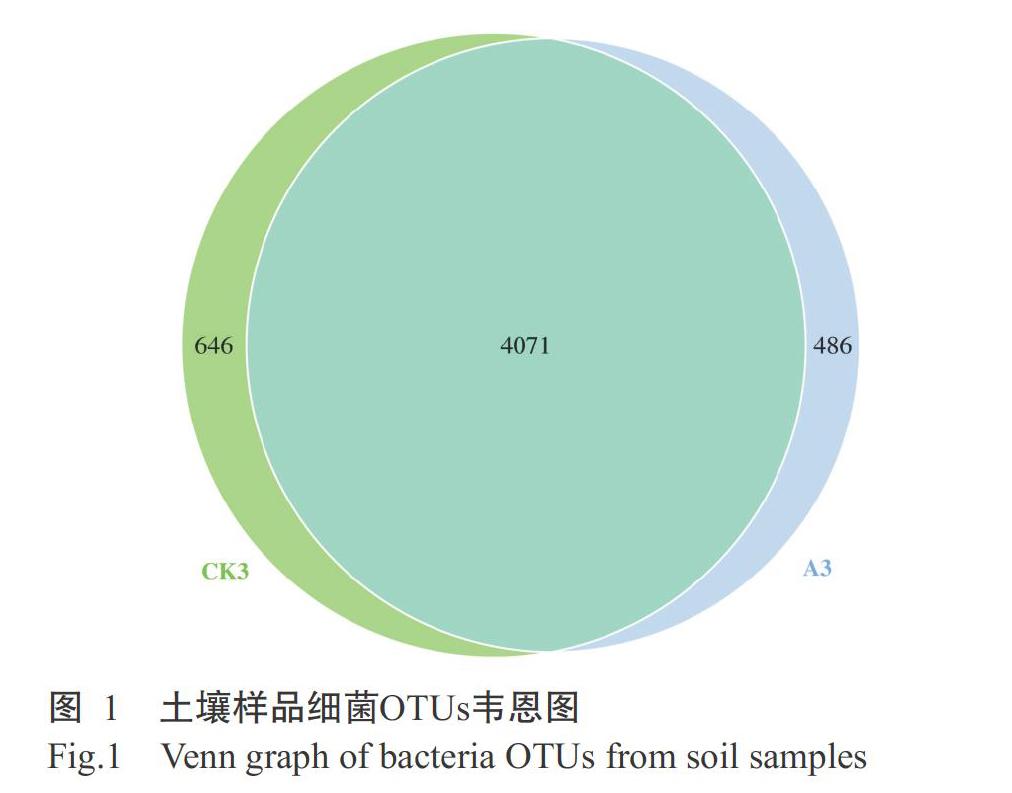
2. 2. 1 OTU分析结果 对所有样品的有效数据进行聚类,以97%的一致性将序列聚类成为OTUs,共获得5203个OTUs,其中,CK3包含4717个OTUs,A3包含4557个OTUs。为分析不同样品间共有和特有的OTUs,将所有样品进行均一化处理后绘制韦恩图(图1)。图1显示,CK3和A3有4071个共有OTUs,CK3和A3特有的OTUs分别为646和486个,表明淮山药定向种植的土壤细菌多样性高于袋料种植。
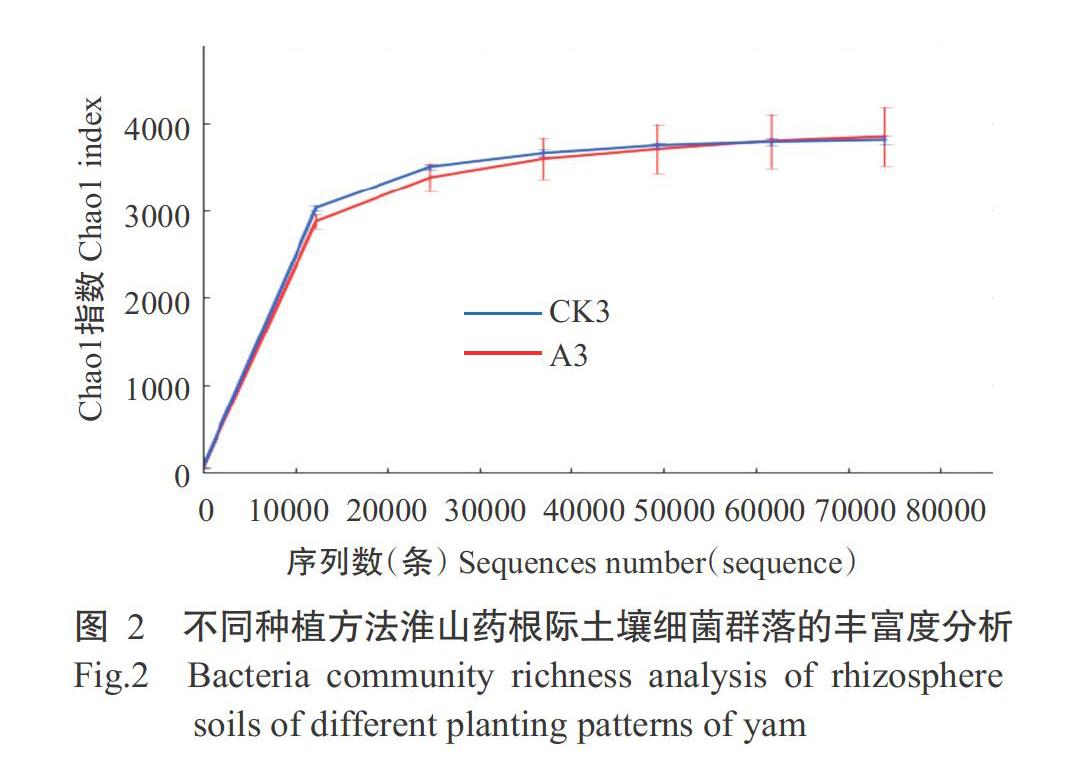
2. 2. 2 淮山药根际土壤细菌多样性分析结果 Chao1指数表示细菌群落的丰富度,其值越高表示细菌群落物种的丰富度越高,细菌数量越多。图2显示2个样品的细菌群落丰富度均随着测序深度的增加而增加并逐渐趋于平缓,说明测序数据量足够反映出土壤样品中的物种组成特征。Shannon指数表示样品的细菌多样性程度,指数越高表示细菌群落的物种多样性越高,分布也越均匀。图3显示,当2个样品的Shannon指数曲线最终趋于平缓时,定向种植的土壤细菌多样性程度高于袋料种植。
2. 2. 3 在门水平上的细菌群落丰度分析结果 在门水平上,CK3共获得41个类群,A3共获得36个类群。其中,变形菌门(Proteobacteria)、酸杆菌门(Aci-dobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和芽单胞菌门(Gemmatimonadetes)为主要优势类群,5个优势类群在CK3和A3中的相对丰度分别为40.90%和40.77%、14.40%和16.36%、14.84%和12.93%、9.08%和9.45%、3.88%和4.52%,CK3和A3的土壤样品中5个优势细菌门的相对丰度之和分别占土壤样品细菌总丰度的83.10%和84.03%。图4为门水平下相对丰度水平位于前10的细菌群落。
将门水平上平均相对丰度<1%的类群归类为其他,CK3共获得10个类群,A3共获得11个类群。经方差检验分析,2种种植方法的根际土壤样品细菌群落在门水平上各类群平均相对丰度差异不显著。
2. 2. 4 在纲水平上的细菌群落丰度分析结果 在纲水平上,CK3获得98个类群,A3获得91个类群,二者合计共100个类群。其中,α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、β-变形菌纲(Betaproteobacteria)、放 线 菌 纲(unidentified-Actinobacteria)和δ-变形菌纲(Deltaproteobacteria)等5个细菌纲为主要优势类群,这5个优势类群在CK3和A3中的相对丰度分别为15.99%和16.84%、11.10%和9.99%、9.33%和9.50%、9.71%和8.15%、4.42%和4.38%,CK3和A3的土壤样品中5个优势细菌纲的相对丰度之和分别占土壤样品细菌总丰度的50.55%和48.86%。图5为纲水平下相对丰度水平位于前20的细菌群落。
将纲水平上平均相对丰度<1%的类群归类为其他,CK3共获得21个类群,A3共获得22个类群。经方差检验分析,2种种植方法的根际土壤样品细菌群落在纲水平上各类群平均相对丰度差异不显著。
2. 2. 5 在目水平上的细菌群落丰度分析结果 在目水平上,CK3共获得144个类群,A3共获得134个类群,二者合计共147个类群。其中,黄单胞菌目(Xanthomonadales)、红螺菌目(Rhodospirillales)、根瘤菌目(Rhizobiales)、伯克氏菌目(Burkholderiales)和芽单胞菌目(Gemmatimonadales)等5个细菌目的相对丰度较高,5个细菌目在CK3和A3的相对丰度分别为8.80%和8.27%、6.26%和6.68%、5.46%和5.85%、4.48%和4.00%、3.78%和4.38%,CK3和A3的土壤样品中5个细菌目的相对丰度之和分别占土壤样品细菌总丰度的28.78%和29.18%。图6为在目水平下相对丰度水平位于前30的细菌群落。
2. 2. 6 在科水平上的细菌群落丰度分析结果 在科水平上,CK3获得282个类群,A3获得265个类群,二者合计共292个类群。其中,黄单胞菌科(Xanthomonadaceae)、芽单胞菌科(Gemmatimonadaceae)、酸杆菌科(Acidobacteriaceae)、Solibacteraceae、小单孢菌科(Micromonosporaceae)和鞘脂单胞菌科(Sphingomonadaceae)等6个细菌科的相对丰度较高,6个细菌科在CK3和A3的相对丰度分别为6.08%和5.29%、3.78%和4.38%、3.65%和4.19%、2.92%和4.43%、3.37%和3.10%、3.01%和3.11%,CK3和A3的土壤样品中6个细菌科的相对丰度之和分别占土壤样品细菌总丰度的22.81%和24.50%。图7为在科水平下相对丰度水平位于前30的细菌群落。
2. 2. 7 在属水平上的细菌群落丰度分析结果 在属水平上,CK3获得500个类群,A3獲得449个类群,二者合计共530个类群。其中,水恒杆菌属(Mizugakiibacter)、鞘氨醇单胞菌属(Sphingomonas)、热酸菌属(Acidothermus)、不动杆菌属(Acinetobacter)、Bryobacter、Candidatus solibacter、Burkholderia-Paraburkholderia、Haliangium、芽单胞菌属(Gemmatimonas)和Rhizomicrobium等10个细菌属的相对丰度较高,10个细菌属在CK3和A3的相对丰度分别为3.65%和3.66%、2.61%和2.95%、2.10%和2.03%、1.80%和2.26%、1.42%和2.16%、1.30%和2.01%、1.58%和1.40%、1.33%和1.58%、1.50%和1.38%、0.95%和1.37%,CK3和A3的土壤样品中10个细菌属的相对丰度之和分别占土壤样品细菌总丰度的18.24%和20.80%。图8为在属水平下相对丰度水平位于前30的细菌群落。
3 讨论
本研究采用高通量测序对淮山药定向种植和袋料种植方法的根际土壤细菌多样性及其分布规律进行研究,分析2种不同种植方法淮山药根际土壤细菌在门、纲、目、科、属不同分类水平上的优势类群,研究共检测出包含变形菌门、酸杆菌门和放线菌门等优势菌门在内的41门细菌,其中变形菌门的相对丰度最高,该结果与Constancias等(2015)、Docherty等(2015)的研究结果一致;也与康捷等(2019)对麻山药不同生长时期根际土壤微生物多样性的研究结果一致。本研究中,定向种植方法土壤样品的变形菌门相对丰度为40.90%,稍高于袋料种植的40.77%,但定向种植中的酸杆菌门相对丰度(14.40%)低于袋料种植(16.36%)。逄好胜(2016)研究认为,变形菌门属于嗜营养菌,能在含碳量高的环境中快速生长,而酸杆菌门是贫营养菌,其数量受土壤酸碱度的影响,与土壤有机碳含量呈反比。本研究定向种植土壤样品的pH为6.21,有机质含量为32.2 g/kg,而袋料种植土壤样品的pH为5.98,有机质含量为30.0 g/kg,说明定向种植的土壤有机质含量稍高,变形菌门的相对丰度也稍高,而袋料种植的土壤有机质含量和pH稍低,因此酸杆菌门的相对丰度稍高,该结果与逄好胜(2016)的研究结果相吻合。
本研究共检测出包含α-变形菌纲和γ-变形菌纲等优势菌纲在内的100纲;黄单胞菌目和红螺菌目等优势菌目在内的147目,黄单胞菌科和芽单胞菌科等优势菌科在内的292科,水恒杆菌属和鞘氨醇单胞菌属等优势菌属在内的530属。在属水平上相对丰度最高的水恒杆菌属隶属于变形菌门伽马变形菌纲黄单胞菌目,2014年鉴定命名,此属已鉴定1种,属名中的水恒指的是日本国山梨县水恒湖,菌名中或可加上“湖”(万云洋等,2017),但未查阅到Rhizomicro-bium相关特性的报道。在门和纲分类水平上,2种种植方法土壤样品细菌群落各优势类群的相对丰度差异不显著,表明2种不同种植方法土壤中细菌的优势类群相似,但整体上看,定向种植的根际土壤细菌群落多样性高于袋料种植。
4 结论
与常规定向种植相比,袋料种植方法的淮山药根际土壤有机质和pH略低,在门和纲分类水平上,2种种植方法土壤样品细菌群落各优势类群的相对丰度差异不显著,细菌的优势类群相似。实际应用中可选择合适的土壤进行袋料种植,并施用有机肥料,从而促进淮山药的生长。因此,淮山药袋料种植方法可行,可在旱坡地和石山地等非耕地应用,以拓宽淮山药的种植用地范围,不与主要粮食作物抢占耕地,丰富淮山药栽培方法。
参考文献:
鲍士旦. 2000. 土壤农化分析[M]. 第3版. 北京:中国农业出版社. [Bao S D. 2000. Soil and agricultural chemistry analysis[M]. The 3rd Edition. Beijing:China Agriculture Press.]
戴雅婷,闫志坚,解继红,吴洪新,徐林波,侯向阳,高丽,崔艳伟. 2017. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J]. 土壤学报,54(3):735-748. [Dai Y T,Yan Z J,Xie J H,Wu H X,Xu L B,Hou X Y,Gao L,Cui Y W. 2017. Soil bacteria diversity in rhizosphere under two types of vegetation restoration based on high throughput sequencing[J]. Acta Pedologica Sinica,54(3):735-748.]
康捷,章淑艳,韩韬,孙志梅. 2019. 麻山药不同生长时期根际土壤微生物多樣性及群落结构特征[J]. 生物技术通报,35(9):99-106.[Kang J,Zhang S Y,Han T,Sun Z M. 2019. Microbial diversity and community structure chara-cteristics of yam rhizosphere soil at different development periods[J]. Biotechnology Bulletin,35(9):99-106.]
雷锋杰,才丽,张爱华,徐周扬. 2019. 不同栽培模式人参根内生菌群落多样性分析[J]. 吉林农业大学学报,41(4):426-431. [Lei F J,Cai L,Zhang A H,Xu Z Y. 2019. Diversity of entophyte communities from ginseng roots under different cultivation patterns[J]. Journal of Jilin Agricultural University,41(4): 426-431.]
李岩,杨晓东,秦璐,吕光辉,何学敏,张雪妮. 2018. 两种盐生植物根际土壤细菌多样性和群落结构[J]. 生态学报,38(9):3118-3131. [Li Y,Yang X D,Qin L,Lü G H,He X M,Zhang X N. 2018. The bacterial diversity and community structures in rhizosphere soil of two halophytes,Lycium ruthenicum and Kalidium capsicum[J]. Acta Ecologica Sinica,38(9): 3118-3131.]
刘元,文春南,刘淼,李文,洪利亚,麻兵继. 2018. 基于高通量测序技术的怀山药与菜山药内生细菌多样性比较[J].浙江农业科学,59(10):1754-1759. [Liu Y,Wen C N,Liu M,Li W,Hong L Y,Ma B J. 2018. Diversity of entophyte communities from two kinds of yam varieties with high throughput sequencing[J]. Journal of Zhejiang Agricultural Sciences,59(10): 1754-1759.]
逄好胜. 2016. 大兴安岭南坡植被退化对土壤微生物群落多样性的影响[D]. 哈尔滨:东北林业大学. [Pang H S. 2016. Effects of forest degradation on soil microbial diversity in southern slope of Daxingan Mountains[D]. Harbin:Northeast Forestry University.]
任天宝,杨艳东,高卫锴,李宙文,阎海涛,王省伟,刘国顺. 2018. 基于高通量测序的生物炭施用量对植烟土壤细菌群落的影响[J]. 河南农业科学,47(12):64-69. [Ren T B,Yang Y D,Gao W K,Li Z W,Yan H T,Wang S W,Liu G S. 2018. Effects of application amount of biochar on soil bacterial community in tobacco fields based on high-throughput sequencing[J]. Journal of Henan Agricultural Sciences,47(12):64-69.]
万云洋,吉田孝,韩淑琴. 2017. 与日本有关的一些原核微生物种属的规范和分类[J]. 微生物学杂志,37(2):107-112. [Wan Y Y,Yoshida T,Han S Q. 2017. Classification and criterion for species and genera of prokaryotes related with Japan[J]. Journal of Microbiology,37(2):107-112.]
韦本辉. 2013. 中国淮山药栽培[M]. 北京:中国农业出版社. [Wei B H. 2013. Yam cultivation techniques of China[M]. Beijing: China Agriculture Press.]
韦本辉,甘秀芹,周佳,劳承英,申章佑,刘斌,李艳英,周灵芝,韦元波,胡泊,吴延勇. 2016. 淮山粉垄袋料的种植方法:中国,CN201610241942.8[P]. 2016-08-03. [Wei B H,Gan X Q,Zhou J,Lao C Y,Shen Z Y,Liu B,Li Y Y,Zhou L Z,Wei Y B,Hu P,Wu Y Y. 2016. Fenlong tilla-ge and bag material planting method of yam: China,CN201610241942.8[P]. 2016-08-03.]
韦本辉,韦威泰,甘秀芹,宁秀呈,覃维治. 2005. 淮山定向结薯栽培方法:中国,CN200510018294.1[P]. 2005-09-07. [Wei B H,Wei W T,Gan X Q,Ning X C,Qin W Z. 2005. Directional cultivation method of yam: China,CN200510018294.1[P]. 2005-09-07.]
许姗姗,杨光柱,阚望,孔宝华,李毅,马钧,李云国,蔡兆翔,谭安超,曹克强. 2019. 应用高通量测序分析云南昭通不同栽培模式苹果园根际土壤微生物种群[J]. 西南农业学报,32(7):1512-1517. [Xu S S,Yang G Z,Kan W,Kong B H,Li Y,Ma J,Li Y G,Cai Z X,Tan A C,Cao K Q. 2019. Analysis on rhizosphere soil microbiological populations of apple orchard in different cultivation modes with high throughput sequencing in Zhaotong,Yunnan[J]. Southwest China Journal of Agricultural Sciences,32(7): 1512-1517.]
张红霞,张舒雅,张玉涛,张天缘. 2019. 山药根际土壤微生物16S rRNA多样性及影响因素[J]. 土壤学报,56(5):1235-1246. [Zhang H X,Zhang S Y,Zhang Y T,Zhang T Y. 2019. Genetic 16S rRNA diversity of soil microbes in rhizosphere of Chinese yam and its influencing factors[J]. Acta Pedologica Sinica,56(5):1235-1246.]
赵柏霞. 2012. 蔬菜根际土壤微生物多样性及拮抗菌调控研究[D]. 沈阳:沈阳农业大学. [Zhao B X. 2012. Studies on microbial diversity of vegetables rhizosphere soil and regulation antagonistic actinomycetes[D]. Shenyang: Shen-yang Agricultural University.]
赵令敏,邵盈,张艳芳,敖兰吉亚,季祥,苏彩霞,霍秀文. 2019. 山药块茎膨大期淀粉合成关键酶活性及调控基因的表达分析[J]. 河南农业大学学报,53(6):847-854. [Zhao L M,Shao Y,Zhang Y F,Aolan J Y,Ji X,Su C X,Huo X W. 2019. Analysis of key enzyme activity and gene expression in starch synthesis during tuber expansion of yam[J]. Journal of Henan Agricultural University,53(6):847-854.]
趙帅,周娜,赵振勇,张科,田长彦. 2016. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律[J]. 微生物学报,56(6):1000-1008. [Zhao S,Zhou N,Zhao Z Y,Zhang K,Tian C Y. 2016. Endophytic bacterial diversity and dynamics in root of Salicornia europaea estimated via high throughput sequencing[J]. Acta Microbiologica Sinica,56(6): 1000-1008.]
Constancias F,Saby N P,Terrat S,Dequeit S,Horrigue W,Nowak V,Guillemen J P,Luc B D,Nicolas C P,Ranjard L. 2015. Contrasting spatial patterns and ecological attributes of soil bacterial and archaeal taxa across a landscape[J]. Microbiology Open,4(3):518-531.
Docherty K M,Borton H M,Espinosa N,Gebhardt M,Juliana G L,Jessica L M,Maes P W,Mott B M,Parnell J J,Purdy G,Rodrigues P A,Stanish L F,Walser O N,Gallery R E. 2015. Key edaphic properties largely explain temporal and geographic variation in soil microbial communities across four biomes[J]. PLoS One,10(11):e0135352.
Hsu C L,Chen W,Weng Y M,Tseng C Y. 2003. Chemical composition,physical properties,and antioxidant activities of yam flours as affected by different drying methods[J]. Food Chemistry,83(1): 85-92.
Kennedy A C,Smith K L. 1995. Soil microbial diversity and the sustainability of agricultural soils[J]. Plant and Soil,170(1): 75-86.
Lupwayi N Z,Rice W A,Clayton G W. 1998. Soil microbial diversity and community structure under wheat as influenced by tillage and crop rotation[J]. Soil Biology and Biochemistry,30(13): 1733-1741.
Nannipieri P,Ascher J,Ceccherini M T,Landi L,Pietramellara G,Renella G. 2003. Microbial diversity and soil functions[J]. European Journal of Soil Science,54(4): 655-670.
Sun H Y,Deng S P,Raun W R. 2004. Bacterial community structure and diversity in a century-old manure-treated agroecosystem[J]. Applied and Environmental Microbio-logy,70(10):5868-5874.
(责任编辑 麻小燕)
