肥胖多囊卵巢综合征患者血脂异常的相关危险因素分析
2020-01-19石文婧赵琪赵雪何冰
石文婧,赵琪,赵雪,何冰
(中国医科大学附属盛京医院内分泌科,沈阳 110000)
多囊卵巢综合征(PCOS)是好发于青春期及育龄期女性的一种生殖内分泌代谢性疾病,患病率约为6%~10%[1]。以稀发或无排卵、高雄激素症状和/或高雄激素血症以及多囊卵巢为特征,临床主要表现为月经失调、不孕、多毛和痤疮,远期并发2型糖尿病、心血管疾病及子宫内膜癌等风险增加[2]。脂代谢异常为PCOS常见的合并症,肥胖PCOS患者血浆总胆固醇(TC)和甘油三酯(TG)水平与非肥胖PCOS患者和正常人群相比增高[3]。超重/肥胖人群血脂谱随体重指数(BMI)增高表现为TC、TG和低密度脂蛋白(LDL)水平升高,高密度脂蛋白(HDL)水平降低[4]。肥胖与PCOS相互作用,目前探讨肥胖PCOS与普通肥胖患者血脂异常的研究较少且没有明确结论。本研究比较了肥胖PCOS与肥胖非PCOS患者血脂水平及体脂分布差异,旨在探究肥胖PCOS患者脂代谢异常的特点及其影响因素。
资料与方法
一、研究对象
选取2017年12月至2018年6月于中国医科大学附属盛京医院内分泌科门诊就诊的56例18岁以上肥胖PCOS患者作为研究对象(肥胖PCOS组),年龄为18~35(25.21±5.02)岁,排除糖代谢异常者,排除17-羟孕酮>6.36nmol/L者。PCOS诊断采用鹿特丹标准:满足稀发排卵或无排卵、高雄激素表现和卵巢多囊性改变三者中的两项,并且排除其他可能引起高雄激素血症和卵巢功能异常的疾病。根据中国成人超重和肥胖症预防控制指南,将体重指数(BMI)≥28kg/m2的PCOS患者定义为肥胖型PCOS。
另选取同年龄段30例BMI≥28kg/m2非PCOS患者作为对照(肥胖非PCOS组)。
二、方法
1.一般情况测量:对所有研究对象进行身高、体重测定,并计算BMI。
2.盆腔超声检查:已婚者选用经阴道超声,未婚者选用经直肠超声检测卵巢大小及卵泡数目。稀发排卵患者若有直径>10mm的卵泡或有黄体出现,在下个周期进行复查。
3.体脂分布检查:使用InBody770体脂仪(Biospace,韩国)检测两组研究对象的腰围、腰臀比(WHR)、脂肪百分比和内脏脂肪面积。
4.生化指标检查:于月经周期第2~5天清晨空腹抽采肘静脉血,采用日立7600全自动生化分析仪检测TC、TG、LDL、HDL、小而密低密度脂蛋白(sd-LDL)、载脂蛋白 A1(ApoA1)和载脂蛋白 B(ApoB)水平。采用化学发光免疫分析仪(贝克曼库尔特,美国)检测FSH、LH、睾酮(T)、性激素结合蛋白(SHBG)、AMH、游离三碘甲状腺原氨酸(FT3)、血清游离甲状腺素(FT4)、促甲状腺素(TSH)、25羟维生素D[25(OH)VD]与空腹胰岛素(FIns)水平。应用免疫投射比浊法(贝克曼库尔特,美国)测定超敏C反应蛋白(hsCRP)。用葡萄糖氧化酶法(贝克曼库尔特,美国)测定空腹血糖(FPG)水平。采用胰岛素抵抗指数(HOMA-IR)评价胰岛素抵抗程度,HOMA-IR=FPG×FIns/22.5。游离雄激素指数(FAI)=T×100/SHBG。血脂异常标准参照我国2016年修订的中国成人血脂异常防治指南推荐,TC≥6.2mmol/L,和(或)TG≥2.3mmol/L,和(或)LDL-C≥4.1mmol/L,和 (或)HDL-C<1.0mmol/L为血脂异常[5]。
三、统计学方法
采用SPSS 22.0统计软件进行统计分析。计量资料用均数±标准差()表示,采用独立样本t检验进行差异性分析。相关分析采用Pearson相关和偏相关分析。P<0.05为差异有统计学意义。应用SPSS软件中的宏命令PROCESS检验中介效应,并采用Sobel检验判断中介效应的显著性。以P<0.05为中介效应显著。
结 果
一、两组临床特点及生化指标比较
1.两组查体相关指标比较:肥胖PCOS组与肥胖非PCOS组间BMI、脂肪百分比、内脏脂肪面积、WHR及腰围的差异均无统计学意义(P>0.05)(表1)。
2.两组脂代谢相关指标比较:肥胖PCOS组TC、LDL、ApoB均显著高于肥胖非PCOS组(P<0.05)(表2)。
3.两组激素水平及代谢相关指标比较:肥胖PCOS组LH、FSH、LH/FSH、T、FAI均显著高于肥胖非PCOS组(P<0.05),而肥胖PCOS组的FT4水平显著低于肥胖非PCOS组(P<0.05)(表3)。
二、TC、LDL、ApoB与两组各差异指标间的相关分析
T、FAI、LH、FSH 与 TC呈正相关,T、LH 与LDL呈正相关,T与ApoB呈正相关,均有统计学意义(P<0.05)(表4)。
表1 两组查体相关指标比较()
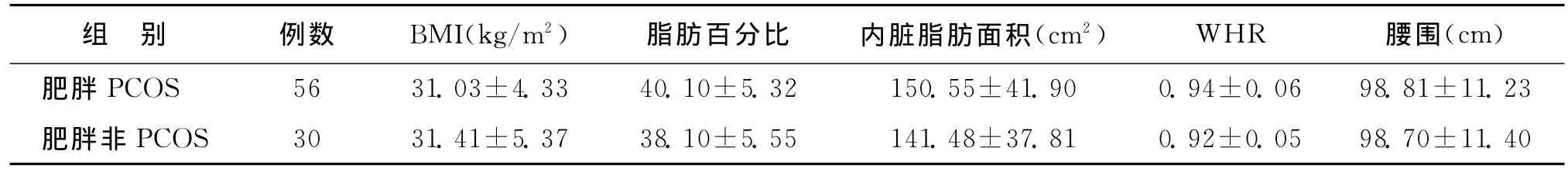
表1 两组查体相关指标比较()
组 别 例数 BMI(kg/m2) 脂肪百分比 内脏脂肪面积(cm2) WHR 腰围(cm)肥胖PCOS 56 31.03±4.33 40.10±5.32 150.55±41.90 0.94±0.06 98.81±11.23肥胖非PCOS 30 31.41±5.37 38.10±5.55 141.48±37.81 0.92±0.05 98.70±11.40
表2 两组脂代谢相关指标比较()
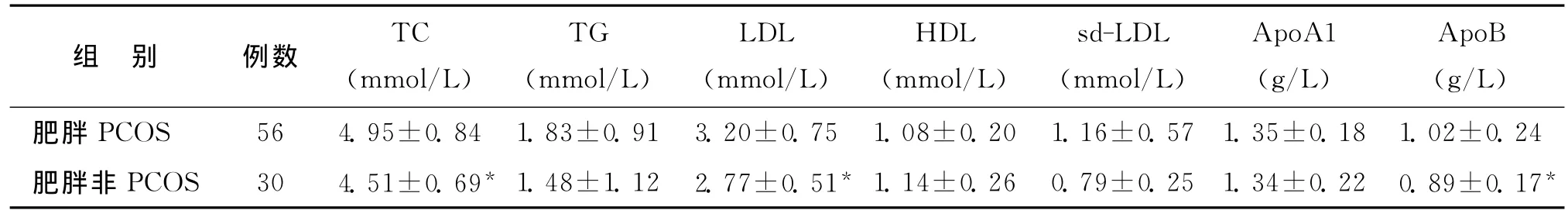
表2 两组脂代谢相关指标比较()
注:与肥胖PCOS组比较,*P<0.05
ApoB(g/L)肥胖PCOS 56 4.95±0.84 1.83±0.91 3.20±0.75 1.08±0.20 1.16±0.57 1.35±0.18 1.02±0.24肥胖非PCOS 30 4.51±0.69* 1.48±1.12 2.77±0.51* 1.14±0.26 0.79±0.25 1.34±0.22 0.89±0.17组 别 例数 TC(mmol/L)TG(mmol/L)LDL(mmol/L)HDL(mmol/L)sd-LDL(mmol/L)ApoA1(g/L)*
表3 两组激素水平及代谢相关指标比较()
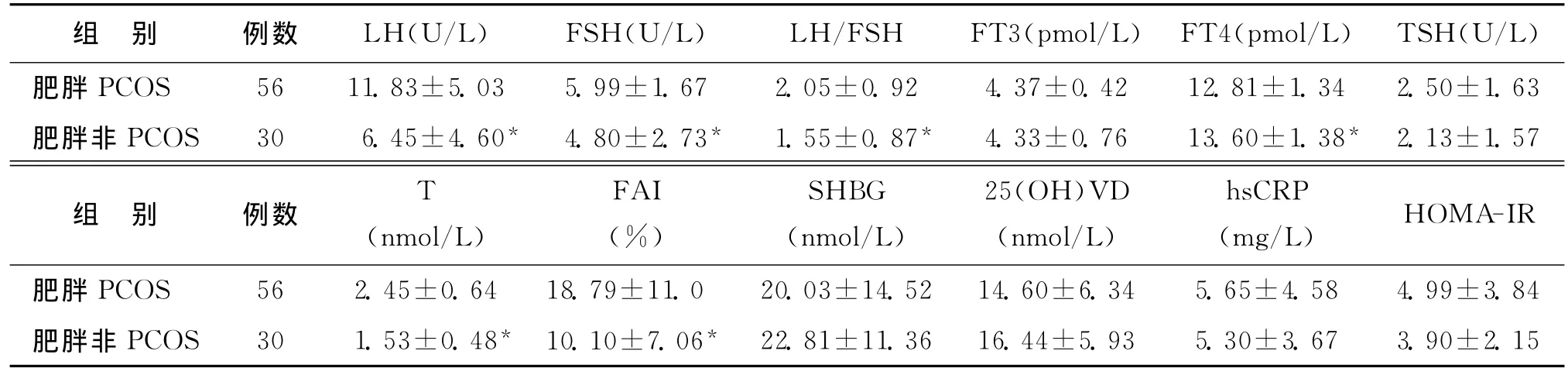
表3 两组激素水平及代谢相关指标比较()
注:与肥胖PCOS组比较,*P<0.05
组 别 例数 LH(U/L) FSH(U/L) LH/FSH FT3(pmol/L) FT4(pmol/L) TSH(U/L)肥胖PCOS 56 11.83±5.03 5.99±1.67 2.05±0.92 4.37±0.42 12.81±1.34 2.50±1.63肥胖非PCOS 30 6.45±4.60* 4.80±2.73* 1.55±0.87* 4.33±0.76 13.60±1.38* 2.13±1.57组 别 例数 T(nmol/L)FAI(%)SHBG(nmol/L)25(OH)VD(nmol/L)hsCRP(mg/L) HOMA-IR肥胖PCOS 56 2.45±0.64 18.79±11.0 20.03±14.52 14.60±6.34 5.65±4.58 4.99±3.84肥胖非PCOS 30 1.53±0.48* 10.10±7.06* 22.81±11.36 16.44±5.93 5.30±3.67 3.90±2.15
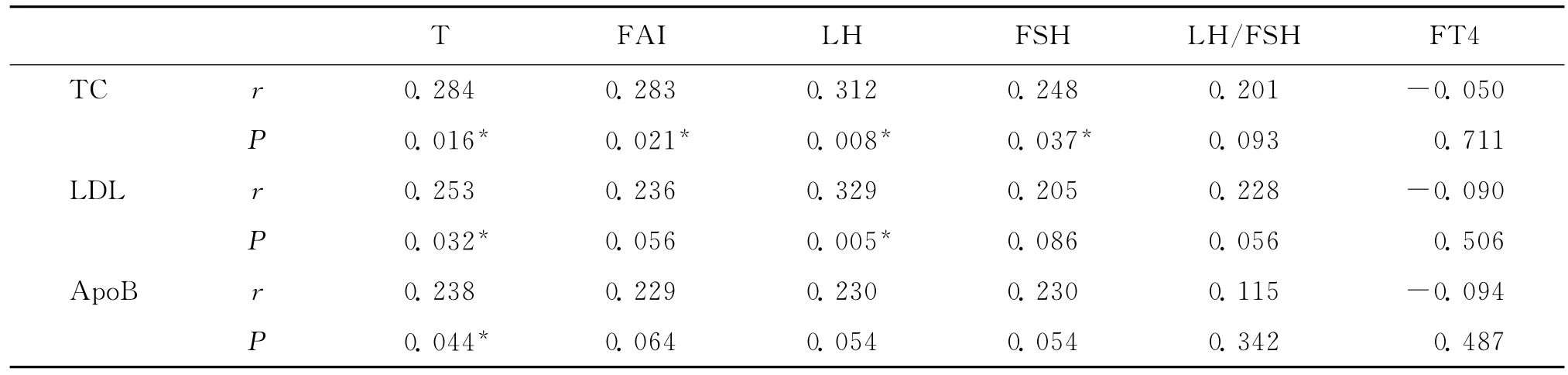
表4 TC、LDL、ApoB与差异性指标之间的相关分析结果
三、控制T与FAI后对LH与TC、LDL及ApoB的偏相关分析
LH与TC、LDL、ApoB均呈正相关(r=0.332,P=0.010;r=0.374,P=0.003;r=0.315,P=0.012)。雄激素对LH和差异血脂的中介效应检验提示T在LH与TC、LDL、ApoB之间的中介效应均不 显 著 (Effect=0.012,P=0.22;Effect=0.007,P=0.40;Effect=0.003,P=0.26)。FAI在LH与TC、LDL、ApoB之间的中介效应均不显著(Effect=0.007,P=0.22;Effect=0.004,P=0.39;Effect=0.001,P=0.35)。
四、肥胖PCOS患者脂代谢异常影响因素的相关分析
内脏脂肪面积、HOMA-IR、hsCRP与腰围均呈正相关;T与内脏脂肪面积呈正相关;腰围、内脏脂肪面积、HOMA-IR、hsCRP与BMI呈正相关;TG与FAI呈正相关;HDL与hsCRP呈负相关,均有统计学意义(P<0.05)(表5)。

表5 肥胖PCOS患者各种参数间的Pearson相关分析结果
讨 论
PCOS是女性常见的内分泌代谢障碍性疾病,50%以上的PCOS患者合并肥胖,而超重和肥胖均为脂代谢异常的危险因素。肥胖与超重患者的血脂异常共同特点是 TG、TC、LDL增高,HDL降低[6]。一个包含35项研究的Meta分析[7]结果提示,与健康对照组相比,即使将两组体重匹配,PCOS组仍存在明显的代谢异常。本研究通过差异性分析发现,与肥胖非PCOS组相比,肥胖PCOS组血脂TC、LDL、ApoB水平升高明显。此外,PCOS患者LH、FSH、LH/FSH、T、FAI显著增高,FT4水平降低,与上述Meta分析结果一致。我们进一步分析了TC、LDL、ApoB与上述差异性指标之间的相关性,结果发现 T、FAI、LH、FSH 与 TC呈正相关,T、LH与LDL呈正相关,T与ApoB呈正相关,提示肥胖非PCOS和肥胖PCOS患者血脂差异可能与PCOS患者垂体前叶分泌过多的LH和雄激素有关。本研究没有发现两组患者体脂分布差异。
高雄激素血症是PCOS主要特征之一,正常女性睾酮仅1%在血循环中以游离形式存在并发挥生物活性,80%与性激素结合球蛋白,19%与白蛋白结合而不具备活性。由于游离睾酮测量难度较高,临床常结合FAI来判断女性高雄激素[8]。PCOS患者卵巢及肾上腺合成的雄激素增多,同时肝脏SHBG分泌受抑制,游离雄激素浓度升高,雄激素生物活性增加[9-10]。Skarra等[11]发现,用来曲唑诱导的雌性小鼠在1周后出现T、LH增高,5周后TC、TG水平升高,并表现出胰岛素抵抗和肥胖。与其他方法建立的动物实验模型相比,来曲唑诱导小鼠因在早期受肥胖和胰岛素抵抗的影响较少,更加适合用于研究超重/肥胖PCOS表型高雄状态下的血脂变化。睾酮影响LDL的机制尚不确定,研究表明,睾酮可以拮抗雌激素刺激肝脏LDL受体表达的能力,从而导致肝脏LDL受体的减少和血浆LDL水平的升高[12]。Pinola等[13]的研究结果显示,高雄PCOS患者的TC及LDL水平均高于普通人群。目前对高雄激素血症进行对症治疗是否可以改善PCOS患者血脂异常没有定论,这可能是以后研究的一个方向。
ApoB是非高密度脂蛋白的结构蛋白,也是LDL的重要组成部分,两者之间显著正相关[14]。在人体ApoB主要有ApoB48和ApoB100两种,ApoB48分布于小肠乳糜颗粒,ApoB100多存在肝脏LDL和极低密度脂蛋白中。Vine等[15]将18名青春期肥胖PCOS患者与12名肥胖青春期对照人群的ApoB与雄激素回归分析,发现T、FAI均与ApoB48显著正相关。其机制可能与雄激素诱导肠道分泌的胰高血糖素样肽-2有关,后者可增强肠上皮细胞对脂类的吸收与 ApoB48-CM 的分泌。PCOS患者垂体对下丘脑GnRH的敏感性增加,导致垂体分泌LH增加,刺激卵泡间质和卵泡膜细胞分泌过多的雄激素[16]。本研究发现LH与TC、LDL、ApoB均呈正相关,排除雄激素影响后LH与TC、LDL、ApoB正相关关系仍存在,通过检验中介效应否定了LH通过升高雄激素间接影响血脂的作用,LH影响肥胖患者脂代谢的机制还需要进一步探讨。
另外,对肥胖PCOS患者血脂异常影响因素的相关分析结果提示,腰围、BMI与内脏脂肪面积两两呈正相关,表明PCOS患者肥胖以腹部脂肪堆积为主,并且随着BMI的增大,腹型肥胖越严重[17]。腹部脂肪可分为皮下脂肪和内脏脂肪,内脏脂肪与代谢紊乱的关系更加密切。脂肪组织分布受性激素影响,过量雄激素加重内脏脂肪堆积与腹部肥胖,并进一步受脂肪因子和炎症介质的作用进而产生更多的雄性激素,或通过代偿性高胰岛素血症与胰岛素抵抗间接影响卵巢和肾上腺的功能分泌雄激素,形成恶性循环[18]。通过运动干预、服用减肥药物等减重手段可以有效改善肥胖PCOS患者内脏脂肪面积[19]。有研究报道,131例肥胖PCOS受试者口服奥利司他60mg 24周后,内脏脂肪面积与基线相比下降15.7%[20]。血清TG水平随着雄激素增多而增高,Couto等[21]的研究结果也证实了腹型肥胖的PCOS女性具有与血清雄激素相关的甘油三酯水平的升高。外周血中的雄激素在脂肪组织芳香化酶的作用下转化为雌酮与雌二醇,二者在血浆中的水平与脂肪含量密切相关。高雄激素血症时SHBG的浓度下降,体内游离雌二醇增加,雌激素与脂肪组织中的雌激素受体结合后,使脂肪细胞生长分裂,导致甘油三酯水平升高。
胰岛素抵抗(IR)作为公认的PCOS主要内分泌特征之一,在肥胖PCOS患者中的发生率为70%~80%[22],参与PCOS的发生和进展。本研究结果提示,肥胖PCOS患者的 HOMA-IR与BMI、腰围正相关。戴加乐等[23]对500多例PCOS患者回顾分析血脂异常与胰岛素抵抗的关系,发现IR组与非IR组患者相比有较高水平的TG、TC、LDL和较低水平的HDL,IR组中血脂异常发生率高于非IR组患者,且血脂异常的发生率随HOMA-IR增大而增大。周莉 等[24]发 现 当 TG≥1.025mmol/L 时PCOS患者IR风险显著增加,所以血清TG水平在一定程度上可以作为PCOS患者IR的预测指标。本研究分析所得的结果是HOMA-IR与血脂水平并不显著相关,结论不同可能与研究选择的人群及分组标准等的差异有关,需要进一步扩大研究样本量明确。
肥胖属于慢性炎症状态,肥胖患者的肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、IL-17、IL-18等炎性因子水平升高[25]。Salama等[26]对超重和肥胖的PCOS患者进行抗炎饮食干预,hsCRP含量下降35%的同时,患者的体重平均减少了6.3kg(7.9%),BMI下降7.1%,腰围减少了6.6%。本研究结果也证实PCOS患者hsCRP与腰围及体重指数呈正相关,同时发现hsCRP与HDL水平呈显著负相关。包含hsCRP在内的炎性细胞因子可通过抑制脂蛋白脂肪酶的活性降低 HDL-C的含量[27]。
本研究显示肥胖PCOS患者血脂异常程度比普通肥胖患者更严重,前者血清TC、LDL、ApoB水平显著高于后者,高雄激素可能是导致血脂差异的重要原因。目前已有的文献还无法解释PCOS女性过多的雄激素对血脂影响的具体机制,有待进一步研究来补充完善。除高雄激素血症外,慢性炎症状态也会在一定程度上引起血脂异常,肥胖与炎症相关,因此减重可能是治疗肥胖PCOS患者脂代谢异常的一种积极有效方式。血脂异常已被公认为心血管疾病的独立危险因素之一。临床工作中,为了预防远期并发症,对肥胖PCOS患者进行疾病治疗的同时,也要及早关注患者脂质代谢异常并予以干预。
