代谢时间对直肠癌患者18F-FDG PET检查SUV和MTV的影响分析
2020-01-18陆皓程祝忠王俊陈世容王潇雄赵檬
陆皓,程祝忠,王俊,陈世容,王潇雄,赵檬
四川省肿瘤医院 PET/CT中心,成都 四川 610041
引言
18F-FDG PET检查是将放射性同位素18F标记的人体代谢物脱氧葡萄糖(β-2-[18F]-Fluoro-2-Deoxy-D-Glucose,18F-FDG)作为示踪剂注入患者体内,代谢一段时间后采集成像的检查方法。代谢时间过短,病灶组织特异性吸收示踪剂不饱和;代谢时间过长,同位素衰变又会对整个影像质量及定量指标大小造成影响[1]。在实际的临床应用中,常常使用50~70 min作为首次采集的代谢时间,但是某种特定的肿瘤究竟有没有其最佳的代谢时间却鲜有报道[2]。本研究旨在通过分析不同代谢时间对直肠癌这一特定肿瘤PET影像最大标准率摄取值(Max Standard Uptake Value,SUVmax)、靶区/本底标准率摄取值之比(target/background Standard Uptake Value,SUVt/b)、代谢组织体积(Metabolic Tissue Volume,MTV)的影响,从而得出此类肿瘤的最佳PET采集代谢时间,指导今后的临床工作。
1 资料和方法
1.1 患者资料
选取2018年10月至2018年12月间病理确诊直肠癌为了解全身情况来四川省肿瘤医院PET/CT中心检查患者20例,其中男性14例,女性6例,年龄48~55岁,平均年龄(51.15±2.25)岁,患者体重为53~69 kg,均值为(60.93±5.10)kg,按0.15 mCi/kg计算,给药剂量在7.95~10.35 mCi,平均(9.14±1.53)mCi。血糖浓度控制在(5.38±0.85)mmoL/L[3]。患者无其他基础代谢疾病,检查依从性良好。
1.2 设备资料
使用SIEMENS公司Biograph mCT-64 PET/CT扫描仪进行采集,光电装换介质LSO+SiPM阵列,晶体单元数52,轴向视野22.3 cm,孔径78 cm,时间分辨率360 ps,患者全身采集6~7床位,床位重叠率30%,1.5 min/床位,采用迭代算法配合时间飞跃技术重建,迭代次数3次,子集数21。高斯滤波函数的半高宽(Full Width at Half Maximum,FWHM)为5 mm。设备每日质控项目:采用68Ge桶源行11项自动化日常质控,消除因设备性能波动,偏离而导致的测量误差[4]。患者行时间点采集:自给药起60 min节点采集全身PET影像用于临床诊断,40、50、70、80 min采集病灶部位两个床位影像用于本次实验数据测量,全过程均采用一次全身CT影像作为衰减校准数据,患者较常规临床PET检查无辐射剂量增加,符合伦理学相关规定。
1.3 图像处理
采用SIEMENS TrueD核医学图像融合软件行图像后处理,利用三维自动目标感兴趣区域(Region of Interest,ROI)病灶轮廓识别技术分别对各时间点进行病灶靶区勾画,自动生成不同时间点病灶区域SUVmax,采用阈值为40%的自动边界勾画病灶技术测量MTV值[5]。采用体积为0.1 cm3的球形ROI测量不同时间点病灶最大层面血池SUVmax作为本底,计算出病灶的SUVt/b,见图1。
1.4 统计学分析
将同一病灶不同代谢时间点的SUVmax值、SUVt/b值、MTV值采用折线图分析,找出折线图走势规律以及是否出现拐点,将拐点处值与前后各一个时间点值分别进行统计学分析,P0.05时差异具有统计学意义。
2 结果
20例患者29处病灶SUVmax值折线图,见图2。可以看出,随着代谢时间的延长,病灶SUVmax值呈现上升趋势或峰谷波动上升趋势,并未见明显的拐点。在引入血池SUVmax这一测量值并计算出病灶与血池的靶本比后,图3曲线中明显看出在代谢70 min时,折线出现峰值拐点,且70 min各病灶靶本比较60 min及80 min差异均具有统计学意义(P0.05),见表1。病灶取40%阈值后测得的MTV值折线图见图4,从图4可以看出29条折现均在60 min代谢时间节点出现峰值拐点,且通过统计学分析,60 min数据与50 min及70 min数据相比,差异具有统计学意义(P0.05),见表2。
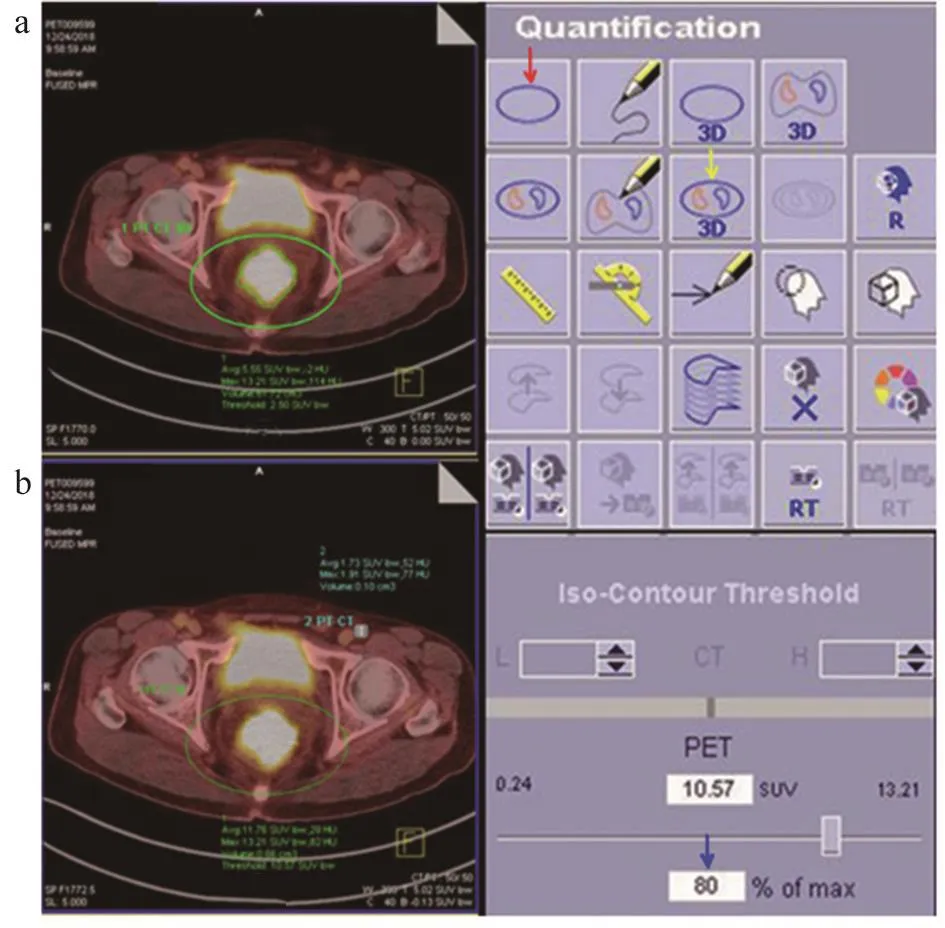
图1 TrueD图像后处理操作界面
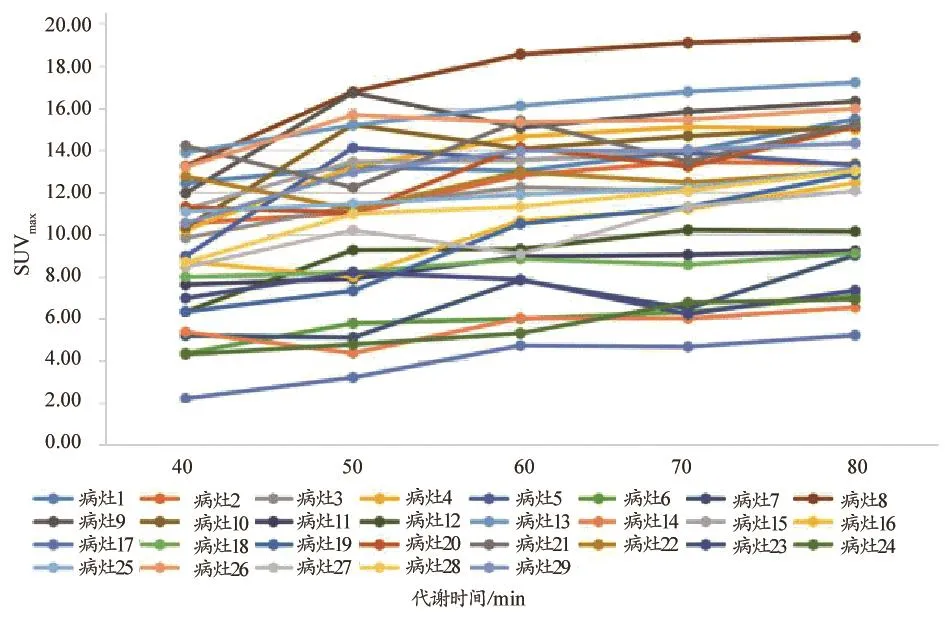
图2 患者病灶不同代谢时间SUVmax值折线图
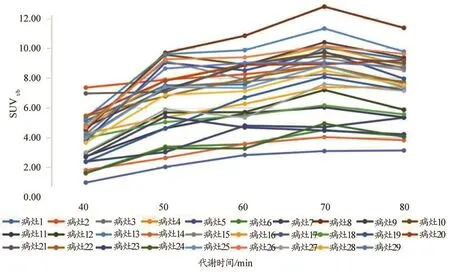
图3 患者病灶不同代谢时间SUVt/b值折线图

表1 病灶SUVt/b值拐点与前后时间点差异统计表
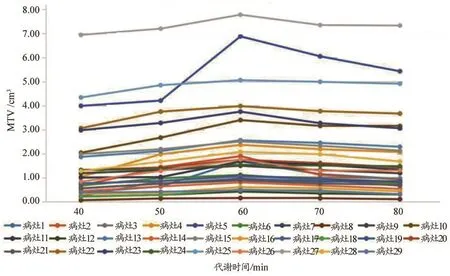
图4 患者病灶不同代谢时间MTV值折线图
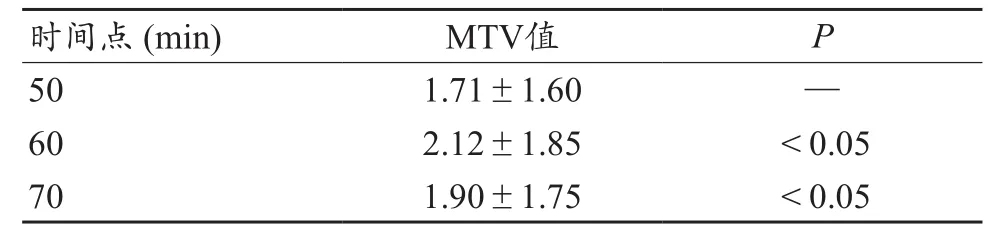
表2 病灶MTV值拐点与前后时间点差异统计表
3 讨论
3.1 本次试验的补充说明
使用ROI勾画病灶轮廓时,会掺杂一些人为因素的影响,以往实验中经常使用的一种降低人为因素影响的方法是采取富有经验的不同技师分别勾画ROI或同一操作技师多次勾画后取平均值作为实验数据。而本次实验中,SIEMENS后处理工作站TrueD核医学图像融合软件具有三维ROI自动勾画功能,此功能通过综合计算ROI所勾画的三维范围内PET影像的SUV差异和CT影像的密度差值法确定病灶生物边界,且不需要逐层勾画,软件即可在三维空间内锁定病灶的真实轮廓[6-7]。技师在操作中只需要确保病灶在ROI圈内,其他生理性高代谢器官(如膀胱)不在ROI圈内即可,降低了经验不足技师操作难度,避免了人为因素对实验数据的影响。但是在本底勾画中,此功能并不适用,因为正常组织或血池,无论是SUV值或CT值都较为接近,ROI智能边界锁定会出现误判断[8]。在综合其他文献后本实验采取的是病灶最大层面作为血池本底测量层,且每次勾画时固定ROI体积为0.1 cm3,保证测量值的准确性[9-10]。 虽然目前PET/CT的应用已从简单定性分析发展到定量分析,但是由于各定量参数的计算会受到成像过程中散射校正方法、衰减校正方法,正电子药物制备过程中的放化纯度以及患者血糖、自身基础代谢率等相关因素的影响[11]。因此越来越多的科研及临床报告选择病灶靶区与本底之间的比值来作为更加准确的定量依据。通常被选择的本底对象为病灶所在器官的健侧正常组织值、病灶临近的骨骼肌、肝脏血池、大动脉血池等[12-13]。本次研究病灶距离肝脏较远,采集范围未包全肝脏,直肠的解剖结构亦不具备健侧正常组织对比(如脑组织),而临近骨骼肌通常被认为是骨骼类相关疾病的本底最佳选择[14]。因此通过集体讨论,本实验利用动脉血池作为本底采集对象。
3.2 实验结果的分析与临床意义
PET/CT检查作为分子影像学的排头兵,被越来越多的用于肿瘤疗效评价以及大数据多模态指导下的精确放疗中,作者团队所在的PET/CT中心在日常工作中发现了一些直肠癌患者治疗后其他影像学检查结果提示疗效显著但PET定量指标却提示相反的案例。在比较患者治疗前后PET/CT显像记录后发现患者的循环时间不一致,进而设计了此次试验。通过实验数据可以看出,随着代谢时间的延长,病灶SUV呈现出波动升高的趋势,如果两次检查患者的循环时间不一致,可导致患者SUV代谢的差异抵消因治疗干预而出现的差异,造成PET/CT报告误诊。虽然SUVt/b和MTV有统计学意义的峰值,但是如果代谢时间没有精确把握,两次检查的代谢时间点分布在峰值点同侧或两侧,距峰值时间点的长短直接会影响两次测量结果的高低,也会出现此类误诊情况。
在直肠癌患者18F-FDG PET采集中,SUVmax值因为没有一个相对固定的拐点,因此在患者多次检查时一定要保证多次检查代谢时间的一致性,而SUVt/b,MTV的测量应在特定的代谢时间点采集的基础上进行,确保测量值的准确性。在今后的此类患者采集中,操作技师应在检查前对临床开单医生的检查目的做充分的了解,根据检查目的不同采用最精确的代谢时间:① 对于需要明确诊断或是疗效评价的患者,可给药后70 min再上机采集,此代谢时间下采集所得的影像可以精确计算出病灶的最大摄取率靶本比值,增加诊断的准确率[15];② 对于需要PET定位辅助放疗靶区勾画的患者,可在给药后60 min再上机采集,确保病灶MTV值最真实的反映出病灶的代谢组织体积大小。在指导放疗靶区勾画时,范围更加精准,降低射线对患者的辐射损伤,将患者辐射利益最大化[16]。
