合成条件对电解锰渣制备沸石过程中沸石种类和性能的影响
2020-01-18李昌新喻源张庆武汪洋钟宏王帅
李昌新,喻源,张庆武,汪洋,钟宏,王帅
(1.南京工业大学安全科学与工程学院,江苏南京,211816;2.中南大学化学化工学院,湖南长沙,410083;3.中南大学锰资源高效清洁利用湖南省重点实验室,湖南长沙,410083)
我国电解锰工业在迅速发展的同时,也引发了严重的环境污染问题,其中锰渣污染尤为突出。锰渣的大量堆存必然占用大片的土地,增加了企业生产成本,制约了行业的可持续发展,同时,锰渣长时间暴露于自然环境下会使得其中一部分有害物质进入土壤、水体中,进而对生态系统造成危害,锰渣中的重金属对土壤和水环境的影响重大[1-2]。因此,如何有效地利用电解锰渣成了当今亟待解决的问题。沸石分子筛是一种多孔的硅铝酸盐晶体材料,具有优良的离子交换能力、催化能力和热稳定性,广泛应用于国民生活中的各行各业。目前,以工业废弃物为原料制备沸石材料是沸石材料的研究领域中一个重要的方向,粉煤灰[3-4]、煤矸石[5]、赤泥[6]、高炉渣[7]等固体废弃物已被用来制备沸石分子筛。LI等[8]制备了电解锰渣基沸石材料,但是,关于不同合成条件对沸石生成的影响的研究较少。在此,本文作者以电解锰渣为原料,通过碱融-水热合成法制备沸石分子筛,研究硅铝物质的量比、反应温度、反应时间等合成条件对沸石材料的种类及性能的影响,优化沸石材料制备的工艺条件,对电解锰渣的有效利用开拓新的途径。
1 实验
1.1 材料
本实验所用锰渣为湘西某电解锰厂渣库中堆存的废渣,pH为5.50,水溶性物质约为24.43%(质量分数)。锰渣中主要化学成分(质量分数)为SiO2(24.6%),Al2O3(12.25%),MnO(4.6%),Fe2O3(7.9%)和CaO(8.6%),锰渣的物相构成非常复杂,其主要物相为石英(SiO2)和石膏(CaSO4·2H2O)。实验用偏铝酸钠、氢氧化钠为分析纯,水为去离子水。
1.2 实验方法
电解锰渣采用浓度为2 mol/L HNO3溶液于80℃下活化2 h后,过滤得到浸出渣及浸出液[9]。以活化处理后所得浸出渣为原料制备锰渣沸石材料,具体步骤如下:
1)按浸出渣与氢氧化钠质量比1∶1.3在坩埚中均匀混合,在600℃下焙烧90 min;
2)冷却后称取一定质量的焙烧产物加入25 mL 2.0 mol/L氢氧化钠溶液,搅拌均匀后,继续加入50 mL一定浓度的偏铝酸钠溶液,于100℃下反应1 h后,晶化6 h[8-9];
3)将产品取出过滤,水洗滤饼至中性,在80℃干燥2 h,得到电解锰渣沸石材料。
1.3 测试分析方法
锰渣化学组成采用荷兰PANalytical公司Axios型X线荧光光谱仪(XRF)测定;采用德国Bruker公司D8 Discover 2500 X线粉末衍射仪测定锰渣及沸石产品的物相组成;采用捷克TESCAN公司Mira3型扫描电子显微镜进行产品微观形貌分析;锰渣沸石材料CEC的测定方法如下[10]:准确称取浸出渣合成沸石0.4 g于250 mL锥形瓶中,用移液管准确加入50 mL 0.1 mol/L氯化铵溶液,在100℃、机械搅拌下反应48 h;反应结束后,静止,过滤,滤液经稀释后,然后按纳氏试剂法测定交换前后溶液中氨浓度,并计算合成沸石的CEC。
2 结果和讨论
2.1 反应体系初始硅铝物质的量比的影响
硅铝物质的量比是合成沸石最重要的参数之一,其变化与合成沸石的品质和应用价值直接相关,本实验通过偏铝酸钠溶液掺量调节反应体系初始硅铝物质的量比。当反应温度为100℃,反应时间为1 h时,不同初始硅铝物质的量比合成的沸石产品的XRD图谱如图1所示,锰渣浸出渣XRD图谱如图2所示。由图1和图2可知,锰渣浸出渣主要物相为石英和云母石,沸石产品的衍射峰位置与浸出渣的衍射峰位存在明显的差异,说明反应后有新的晶型矿物生成。当反应体系中初始硅铝物质的量比为1.5时,沸石产品主要是Na-A沸石,伴有少量的Na-P沸石,其中非晶质包峰不明显,合成沸石的纯度较高,结晶度较好。随着反应硅铝物质的量比增加,Na-A沸石的峰值逐渐减弱,取而代之的是Na-P沸石和石英。因此,随着初始硅铝物质的量比增加,合成产品中Na-A沸石纯度降低,Na-P沸石纯度增加,说明初始硅铝物质的量比对生成沸石的种类具有显著的影响。
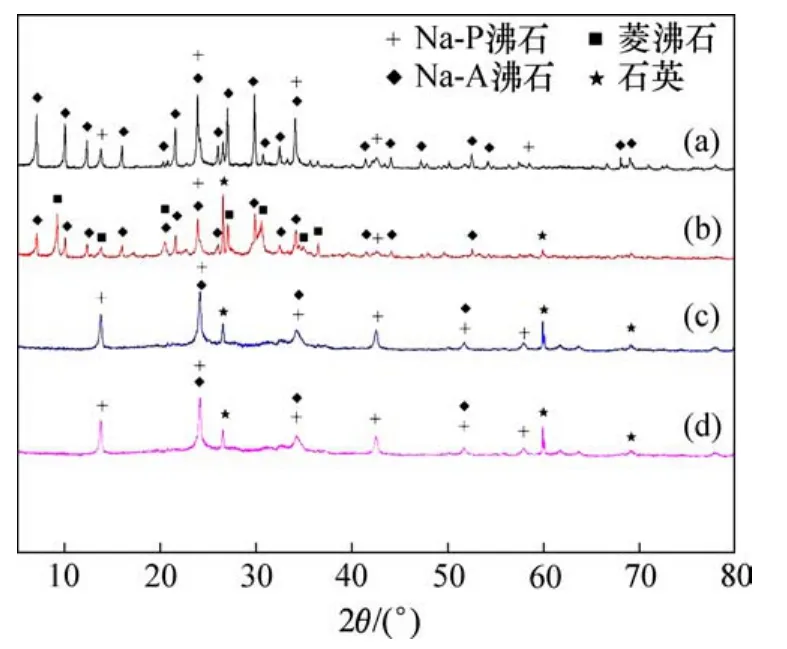
图1 不同初始硅铝物质的量比合成的沸石产品的XRD图谱Fig.1 XRD patterns of synthesized zeolites with various initial molar ratio of Si toAl

图2 锰渣浸出渣XRD图谱Fig.2 XRD patterns of leaching residue of EMR
不同初始硅铝物质的量比合成产品的CEC测定结果如图3所示。由图3可知,随着初始硅铝物质的量比的增加,沸石产品的CEC降低,这主要是由于低硅铝物质的量比的沸石产品中Al2O3含量高,一般具有较高的CEC和吸附容量,因此,Na-A型沸石被广泛用于吸附剂[11-13],而随着硅铝物质的量比的增加,低硅铝物质的量比的Na-A沸石纯度降低,高硅铝物质的量比的Na-P沸石纯度增加,因此,在以锰渣制备沸石材料过程中控制初始硅铝物质的量比为1.5左右是较适宜的。

图3 初始硅铝物质的量比对合成沸石产品的阳离子交换容量的影响Fig.3 Influence of initial molar ratio of Si toAl on CEC of synthesized zeolite
2.2 反应温度的影响
反应温度会影响沸石分子筛的结晶与生长,控制反应体系初始硅铝物质的量比为1.5,于40~100℃下反应1 h制备沸石分子筛。不同反应温度下合成沸石产品的XRD图谱结果见图4。由图4可知,反应温度显著影响沸石产品的形成。当反应温度在100℃时,沸石产品中Na-A沸石衍射峰数量最多,峰强最强,表明Na-A沸石含量最高,结晶度亦较好;当反应温度逐渐降低时,沸石产品中相继生成方钠石、斜霞石、Na-P沸石等其他沸石,当温度降低至40℃时,沸石产品主要由二氧化硅和斜霞石组成,这主要是由于基于沸石的液相转化机理;当反应温度升高时,沸石的结晶速度加快,结晶时间缩短,产品的结晶度较高,同时,在反应过程中,反应温度升高有利于合成体系中产生更多的富铝硅铝酸盐沉淀,从而促进沸石的成核与晶化[14-15]。
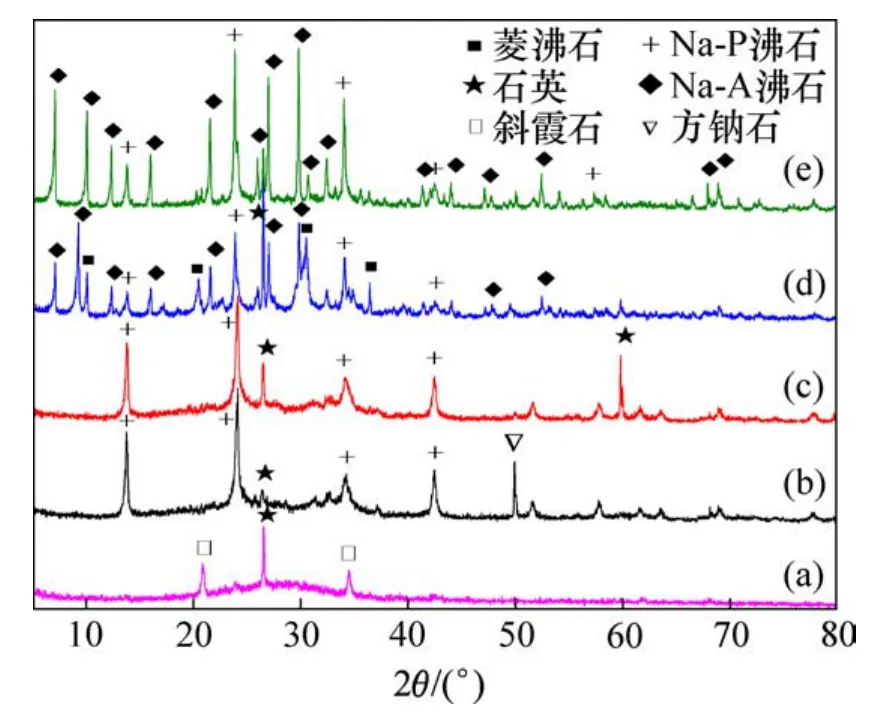
图4 不同反应温度沸石产品的XRD图谱Fig.4 XRD patterns of synthesized zeolites at various reaction temperatures
不同温度下合成沸石产品的CEC如图5所示。从图5可以看出,随着反应温度的升高,沸石产品的CEC快速增加,虽然在反应温度较低时(如反应温度为40℃时)所得产品的CEC相较于反应原料锰渣浸出渣(CEC为0.015 mmol/g)而言均有显著提升,但其产品的物相中含有未反应完全的二氧化硅,沸石纯度不高,因此,从沸石产品的纯度和CEC方面考虑,适宜的反应温度应为100℃左右。
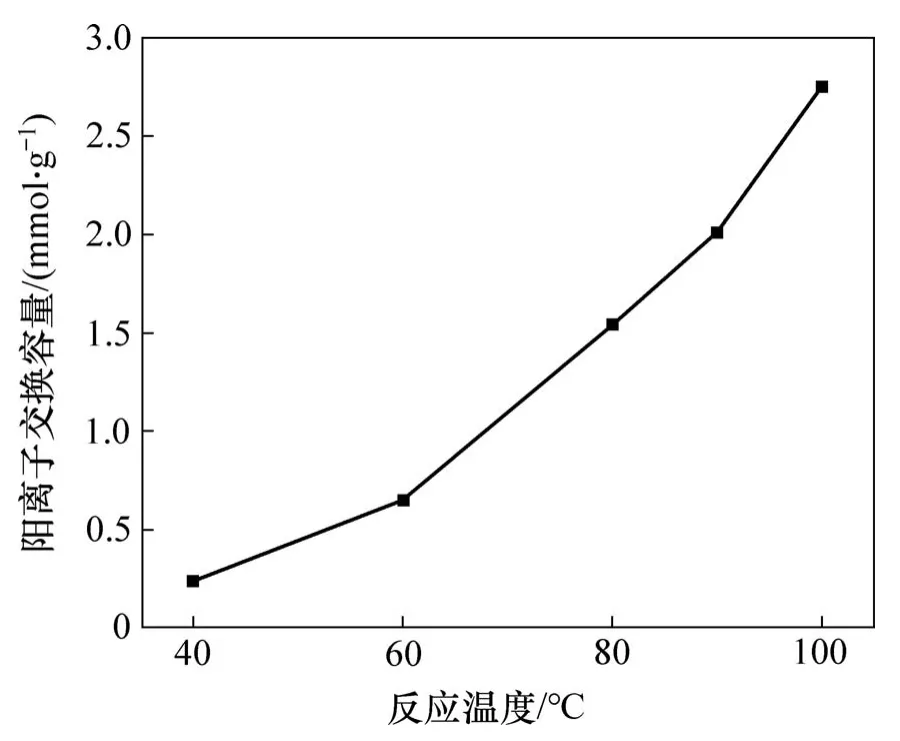
图5 反应温度对合成沸石产品的阳离子交换容量的影响Fig.5 Influence of reaction temperature on CEC of synthesized zeolite
2.3 反应时间的影响
控制反应体系初始硅铝物质的量比为1.5,于100℃下反应0.5~2.0 h制备沸石分子筛,探讨反应时间对其沸石产品的种类和CEC的影响。不同反应时间下合成沸石产品的XRD图谱结果见图6。从图6可以看出,当反应时间为0.5 h时,合成产品主要以未反应完全的石英为主,随着反应时间的增加,产品中沸石含量逐步提高,且主要是Na-A沸石,当反应时间增至1.5 h后,继续延长反应时间对产品中沸石种类及含量影响不大。反应时间对合成沸石产品的阳离子交换容量的影响如图7所示。由图7可见:随着反应时间的延长,产物CEC逐渐增加,当反应时间升至1.5 h时,CEC趋于稳定,继续增加反应时间CEC仅略有增加。从节能方面考虑,适宜的反应时间为1.5 h。

图6 不同反应时间沸石产品的XRD图谱Fig.6 XRD patterns of synthesized zeolites for various reaction time

图7 反应时间对合成沸石产品的阳离子交换容量的影响Fig.7 Influence of reaction time on CEC of synthesized zeolite
由以上实验可知,以电解锰渣制备沸石材料的适宜条件为:初始硅铝物质的量比1.5,反应温度100℃,反应时间1.5 h。
3 微观结构分析
3.1SEM分析
在反应温度为100℃,反应时间为1.5 h条件下,分别对初始硅铝物质的量比1.5和2.5制备所得的锰渣沸石材料进行微观形貌分析,其SEM结果如图8所示。从图8可知,当初始硅铝物质的量比为2.5时,沸石材料主要由球状颗粒晶体组成(见图8(a)),而当初始硅铝物质的量比为1.5时,沸石材料则主要由立方体状颗粒晶体组成(见图8(b)),且晶体形貌清晰,表面光滑,晶型较为完整,粒径较为一致。从形态上说,立方体状和球状颗粒分别对应于Na-A和Na-P沸石[16-17],因此,SEM分析结果与XRD分析结果一致,表明当初始硅铝物质的量比为1.5,反应温度为100℃,反应时间为1.5 h时,所制备沸石主要由Na-A沸石组成。同时,从图8(b)可以看出,当初始硅铝物质的量比为1.5,反应温度为100℃,反应时间为1.5 h时,所制备Na-A沸石粒径在1 μm左右,分散性很好,无团聚发生。

图8 锰渣沸石材料扫描电镜照片Fig.8 SEM images of zeolite samples
3.2 FT-IR分析
在初始硅铝物质的量比为1.5,反应温度为100℃,反应时间为1.5 h的条件下制备锰渣沸石的红外光谱如图9所示。从图9可以看出,在3 420 cm-1处存在1个较强的吸收峰,该峰主要归属于沸石结构中O—H键伸缩振动,而1 640 cm-1处吸收峰是典型的由水分子中的O—H键弯曲振动引起[18]。在1 001 cm-1和664 cm-1处吸收峰分别归属于沸石骨架T—O—T(T为Si或Al)的不对称伸缩振动和对称伸缩振动,而1 001 cm-1处吸收峰强且窄,表明所制备沸石材料的结晶度相对较高[19]。在650~500 cm-1谱带区间内556 cm-1处吸收峰属于双四元环(D4R)的振动,为Na-A沸石的特征振动峰,由AlO4和SiO4四面体耦合振动引起[20];在462 cm-1处吸收峰归属于TO4四面体内Si—O—Si的弯曲振动。可见,本研究所制备锰渣沸石材料的FT-IR图谱与文献中纯Na-A沸石的基本相同,并与XRD分析结果吻合。

图9 锰渣沸石材料红外图谱Fig.9 FT-IR spectra of zeolite sample
4 结论
1)在以锰渣为原料制备沸石材料过程中,合成沸石的种类和CEC与反应体系初始硅铝物质的量比、反应温度和反应时间等因素直接相关。随着初始硅铝物质的量比的增加,合成沸石的纯度和CEC均降低,但随着反应温度和反应时间增加,合成沸石的纯度和CEC增加。
2)沸石合成的优化条件为:初始硅铝物质的量比1.5,反应温度100℃,反应时间1.5 h,在此条件下制备的沸石材料主要以A型沸石为主,CEC为3.45 mmol/g,产品主要由立方体状晶体组成,同时含有少量的球状体,结晶度较高,非常适合作为吸附材料使用。
