经昆虫摄食dsRNA的RNAi的现状、挑战和前景
2020-01-17韩云轩编译
韩云轩 编译
(上海市农药研究所,上海 200032)
昆虫每年危害作物会造成数十亿美元的损失,而使用化学杀虫剂会产生抗性和对非靶标的不利影响。寻找对靶标更高选择性的害物管理工具是农业生产者、政府机构和研究人员的重中之重的任务。RNA干扰(RNAi)是正在出现的很有希望替代化学杀虫剂的技术。RNAi能使昆虫体内重要基因沉默,选择性杀死靶标害虫。昆虫摄入双链RNAs (dsRNA)后RNAi效应启动。dsRNA被摄食后,必须从肠腔运输到肠上皮细胞的胞液中。上皮细胞的吸收是RNAi效应启动所必须的,RNAi沉默过程主要通过2步实现,第一步:Dicer酶(核酸酶的核糖核酸酶III家族的成员)把 dsRNA 加工为 20~25 bp的小干扰RNA (short interfering RNA,siRNA);之后,siRNA被纳入RNA诱导沉默复合体(RNA induced silencing complex,RISC)中,在此siRNA被解开为2条单链:“导向”链(guide strand)和“随从”链(passenger strand)。随从链被从复合体中除去,导向链指导RISC复合体与互补的 mRNA相互作用,抑制此靶标mRNA的翻译。Argonaute-2蛋白是RISC的一部分,在识别和降解mRNA中具有重要作用,其含有2个域:PAZ和PIWI。PAZ域具有捕获靶标mRNA模板的导向链。PIWI域将捕获的mRNA切割成2个片段,并被胞质核酸酶进一步降解。然而,RNAi途径也具有内源性调节基因表达以及针对病毒和转座子的免疫应答的功能。图1说明了不同siRNA途径之间的基本差异。
除了经口摄入外,dsRNA也能通过浸泽或微注射进入昆虫血淋巴中。微注射能绕开肠道,诱导系统反应。目前有数种微注射技术,但大部分费时,使用的设备有内部生产的到精密的微处理器控制的注射器。因此微注射法不是实际可用于害物防治的方法,但可用于研究优异的dsRNA候选物。局部处理(topical administration )被定义为通过外骨骼直接进行dsRNA给药。可对整个昆虫进行均匀的dsRNA喷雾或腹侧微量应用。相对于注射,这种方法节省劳力和能够高通量筛选基因。然而,只有一些发表的文章表明用此方法的前景。其中一个研究为用以柑橘木虱(Diaphorina citri)成虫的5个细胞色素P450基因为靶标的dsRNA溶液处理柑橘木虱的胸部。用dsRNA处理成虫的死亡率显著高于未处理。也介绍了用相似的方法以荧光 dsRNA局部处理玉米螟(Ostrinia nubilalis)幼虫,结果表明dsRNA能渗透昆虫体壁,在体腔中循环。
有人提出局部应用dsRNA后,dsRNA可能通过节间膜,特别是在腹侧(腹板),通过关节运动板之间的膜和附肢基部的腔(足和翅膀)和通过每侧(胸膜)外侧部,包括气门被昆虫吸收。虽然如此,但还需要进一步研究阐明局部应用后 dsRNA进入的确切机制。也探索了用dsRNA溶液浸泽昆虫的方法。对黑腹果蝇(Drosophila melanogaster)幼虫的处理表明在浸泽过程中果蝇摄入溶解于浸泽溶液中的dsRNA分子。在这个研究中,在含有以葡萄糖醛酸糖苷酶转录物为靶标的dsRNA混合物中加入食用色素。酶的活性降低50%,在肠中发现了食用色素。此方法好像在实验室应用比在田间更适合。
毫无疑问摄入 dsRNA是有最大潜力进行害物管理的 dsRNA给药途径,而且多年来一直这样认为。此方法具有防治害虫的潜力具有数种原因:⑴基因沉默发展抗性风险中等;⑵ dsRNA在不影响非靶标物种的情况下,以非常高的准确度作用于适宜的转录物;⑶ dsRNA可被制备为可喷雾使用的制剂,能够大面积使用,因此昆虫取食后选择性地作用于靶标昆虫;⑷ dsRNA对刺吸式和咀嚼式口器昆虫有效。然而,dsRNA过早降解(摄入前),在昆虫肠道内的降解,物种间 RNAi效应的变异性,肠道上皮细胞的吸收不良以及 dsRNA扩增的缺乏是目前限制该害物管理方法的一些障碍。本文介绍了已开发的用来克服这些问题的方法,包括使用纳米技术工具。纳米技术是涉及纳米级材料的有前途的跨学科领域。数种类型的纳米材料,特别是纳米粒子已用于提高dsRNA的经口传递能力。纳米粒子能与dsRNA相互作用,保护dsRNA免于被核酸酶和其他环境条件过早地降解。此外,纳米粒子能够在肠上皮细胞中进行细胞内传递dsRNA。这篇综述也介绍了昆虫肠道的特性对 dsRNA传递的总效率的影响。最后,讨论了dsRNA的特异性、所需剂量、目标选择和其他参数,这些参数可能在该技术在农业生态系统中的应用中起重要作用。
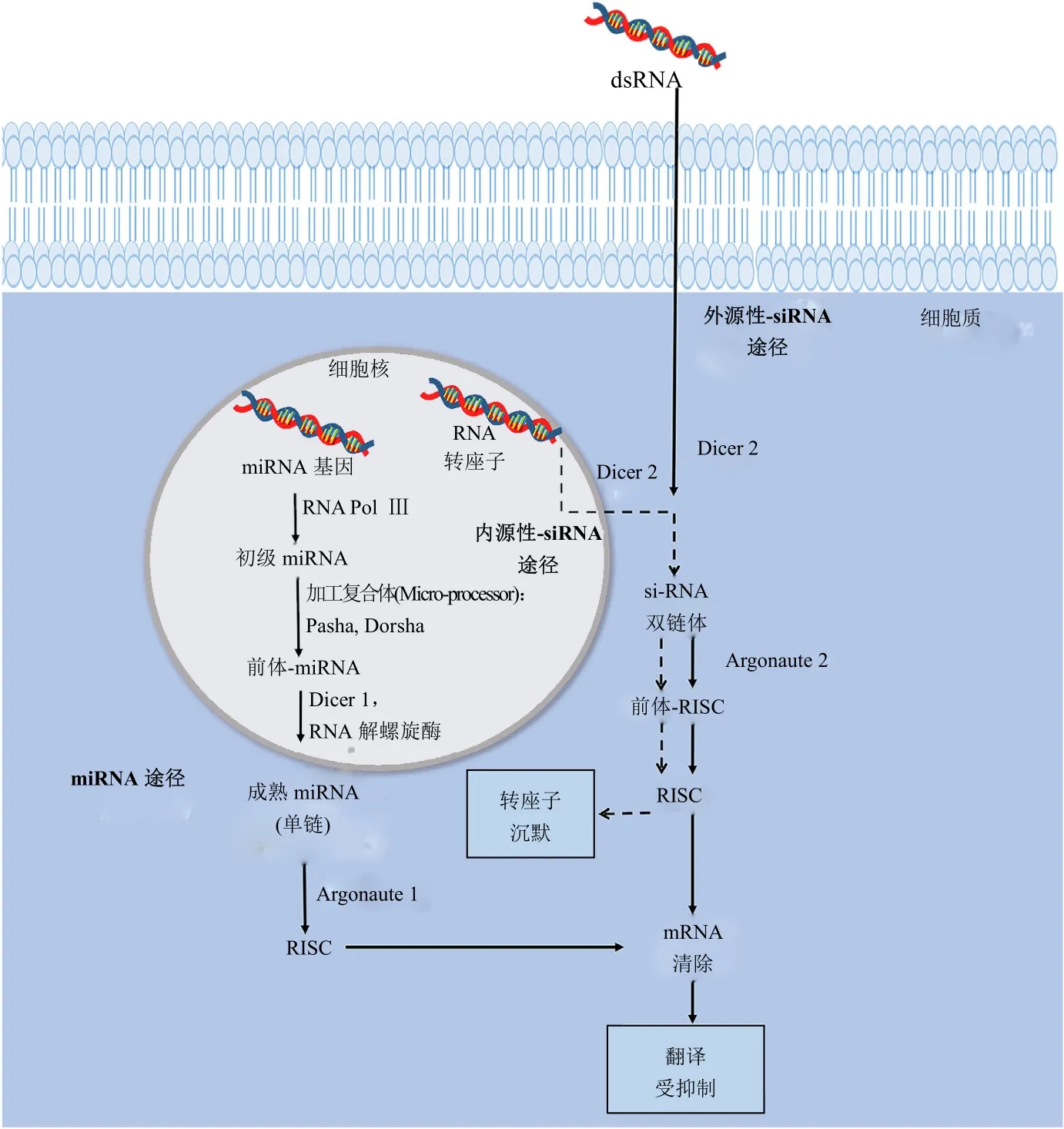
图1 昆虫中3个RNA干扰途径的示意图:外源性siRNA(exo-siRNA)、内源性siRNA (endo-siRNA)和microRNA(miRNA)途径
1 肠道内的dsRNA
dsRNA经口后直接进入昆虫肠道。昆虫肠道分为3个部分:前肠、中肠和后肠。在肠道的3个区域中,中肠具有大的表面积和结构,负责吸收营养。中肠由3种类型的上皮细胞组成:具有专门用于吸收营养的微绒毛的柱状细胞(肠上皮细胞)、内分泌细胞和干细胞。大概是在这些细胞中dsRNA被吸收和加工。肠上皮细胞通过 2种途径内化来自肠腔的dsRNA:⑴ 跨膜通道蛋白介导的吸收途径;⑵ 内吞途径。报道昆虫存在这2种系统,很可能二者也涉及从肠道吸收dsRNA,然后到达血淋巴。然而,仍然没有有关dsRNA在昆虫体内运输的信息,以及哪个系统涉入此过程(图2)。关于内吞途径,昆虫中最有据可查的为网格蛋白依赖型途径。数种离体和活体研究表明药物抑制肠上皮细胞中此途径会导致dsRNA吸收的降低,主要发生在马铃薯甲虫等鞘翅目昆虫中。另一常见的内吞途径——吞噬作用主要发现在特定血细胞,例如浆血细胞。模式识别受体(PRRs)和清道夫受体在吞噬作用吸收dsRNA中对识别dsRNA具有重要作用。抑制黑腹果蝇体内清道夫受体(SR-Cl)导致dsRNA内化下降90%以上。关于跨膜蛋白通道介导的吸收,在马铃薯甲虫(Leptinotarsa decemlineata)、玉米根叶甲(Diabrotica virgifera)、欧洲蜜蜂(Apis mellifera)和褐飞虱(Nilaparvata lugens)等一些昆虫中确定了sid-1-like(系统干扰缺陷)或Sil蛋白家族。这些受体好像涉入dsRNA的内化,因为基因敲除导致RNAi效应下降。这已在玉米根叶甲、褐飞虱和马铃薯甲虫中发现。研究表明在欧洲蜜蜂取食dsRNA后,其sid-1-like基因的表达水平增加。然而,这些跨膜蛋白在dsRNA吸收中确切作用仍在调查中。赤拟谷盗(Tribolium castaneum)、家蚕(Bombyx mori)、东亚飞蝗(Locusta migratoria)和沙漠蝗虫(Schistocerca gregaria)等品种具有sid-1-like基因,但在敲除基因后,RNAi效应仅仅部分受影响或根本不受影响。为了解释此种情况,提出内吞作用和sid-1-like蛋白可能同时起作用,虽然只在线虫中证实此种协同作用。另一方面需要调查的是是否dsRNA施用方法影响吸收途径。中肠的吸收途径可能与血腔周围组织中的不同。
1.1 围食膜基质
昆虫围食膜基质(PM)包裹摄入的食物,保护昆虫免受微生物侵染和机械化损伤。其也是灭活摄入毒素的生化障碍。主要由甲壳素和糖蛋白组成的围食膜能阻止dsRNA有效地传递到肠上皮细胞(图2)。围食膜内膜中的带负电荷的蛋白多糖和膜孔大小不利于dsRNA传递。出现在围食膜中的带负电荷的蛋白多糖阻碍dsRNA自由运输通过围食膜。这层蛋白多糖对dsRNA的带负电荷的磷酸骨架产生排斥力。用阳离子纳米粒子屏蔽带负电的 dsRNA可以增强dsRNA通过PM的转运。研究表明用含有dsRNA的核壳型荧光纳米颗粒(FNP-dsRNA)饲喂黑腹果蝇幼虫,FNP-dsRNA比单独的dsRNA(naked dsRNA)能更有效地穿过PM。关于PM孔的大小,因昆虫种类的不同而不同,PM中的孔或通道的大小为7~36 nm。这些孔可能是暂时的,并可能根据所摄入的食物而改变,潜在地影响dsRNA通过PM。蚊子在吸血后,PM的孔隙度增加,近而胞吐作用分泌的消化酶能从上皮细胞迁移。然而,文献表明没有试验证明 PM孔的大小是如何影响dsRNA的运输。总的来说,在dsRNA进入肠道后PM的确切作用仍知道的很少。需要进行更多研究来了解dsRNA和PM的相互作用特点。
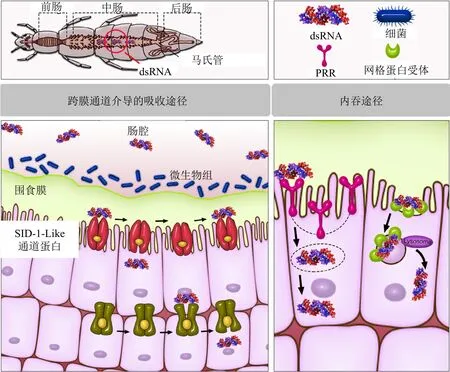
图2 提出的柱状细胞从肠腔吸收dsRNA的2种途径:跨膜通道介导的吸收途径(左)和内吞途径(右)
1.2 消化核酸酶
昆虫肠道含有参与消化摄入物质的不同类型的酶。核酸是数种昆虫品种的一部分天然食物,因此核酸酶(例如 DNases和 RNases)在消化中具有重要作用。不同昆虫品种的肠中核酸酶的浓度和家族不同,这可能取决于数个因素,其中包括取食习惯。因此,难以分类肠核酸酶和不同昆虫品种的核酸酶活性。对4种昆虫[斜纹夜蛾(Spodoptera litura)、亚洲飞蝗(L. migratoria)、美洲大蠊(Periplaneta americana)和Zophobas atratus]体内降解dsRNA核酸酶的比较研究表明这些品种的大部分dsRNA酶嗜碱性,最适宜的pH约9。此外,它们的活性很大程度上取决于最佳的镁离子浓度。最近报道亚洲玉米螟(Ostrinia furnacalis)(鳞翅目)中名为 up54基因好像响应于dsRNA而上调了。对此基因的测序分析表明其编码1个以前未被表征的核酸酶,在其他7种鳞翅目昆虫中发现了其同源序列。此核酸酶具有离体和活体消化单链RNA (ssRNA)、dsRNA和dsDNA的能力。此核酸酶被作者重新命名为蛋白RNAi效应相关核酸酶(REase)。只在马铃薯甲虫肠道中表达的2个核酸酶基因最近也被鉴定和表征:Ld_dsRNase1和Ld_dsRNase2。这些dsRNA酶的敲除增加了昆虫对经口 dsRNA的敏感性。也报道稻绿蝽(Nezara viridula)的转录物组含有肠道和唾液腺分泌的约134个核酸酶。这些研究表明昆虫体内含有丰富的核酸酶,它们具有广泛的底物特异性及其高度进化的生理学。
也有许多口外消化的昆虫。这些昆虫把唾液注射入食物或分泌到食物上使食物分解,然后取食。这在半翅目昆虫中常见,一些咀嚼式口器的昆虫在取食叶时会在叶上沉积大量唾液。用于口外消化的唾液核酸酶也能在dsRNA被取食前分解其。已从不同种类蝇的唾液中鉴定出品种特异性dsRNA酶:稻绿蝽中的类Rrp44蛋白、致倦库蚊(Culex quinquefasciatus)的CuquEndo和舌蝇的Tsal蛋白1和2。目前,大多数dsRNA酶的特性仍未知。弄明白这些酶的结构和作用是优化 RNAi技术在田间应用来防治害虫需解决的重要问题。这将能够开发有效避免dsRNA被核酸酶降解的dsRNA传递策略。
1.3 昆虫肠道pH
不同品种昆虫的血淋巴的 pH相对一致(pH 6.4~7.5),但不同品种昆虫肠道和肠道不同区域中pH变化大,双翅目、直翅目和鳞翅目昆虫肠道pH为碱性(9~10.5),而一些半翅目和鞘翅目昆虫肠道pH为中性到强酸性。RNA的化学结构决定了RNA在酸性条件下较稳定。在碱性条件下(pH 9~10.5),单链RNA(ssRNA)可经2步反应被水解,与2'-羟基发生酯交换反应,同时裂解 RNA链,然后生成的2,3-磷酸二酯发生水解(图3)。在DNA制备中通过碱水解去除RNA污染物。然而,与单链ssRNA相比,dsRNA的双螺旋把其碱水解限制在一定程度。目前的文献表明还没有对 dsRNA的碱水解进行详细的研究。对dsRNA的1或2条链进行化学修饰或应用纳米颗粒技术提高 dsRNA的稳定性和阻止dsRNA被碱水解。对dsRNA双链的化学修饰可能有助于提高稳定性。对核糖2'-羟基进行修饰会避免此降解过程。报道在哺乳动物细胞中 2'-羟基被 2'-甲氧基和2'-氟取代可极大地增加对核酸酶消化的抗性。数种核酸酶催化2'-羟基的亲核攻击和磷酸间键的水解。
1.4 影响肠道中dsRNA稳定性的其他因素
目前,经口摄入dsRNA的RNAi效应在不同昆虫目间差异很大。此外,对于一些品种,需要过量的dsRNA才能达到最小的效果。如前所述,dsRNA在碱性肠道中分解或被核酸酶过早降解可能是导致dsRNA低效的一个因素。发育阶段也可能影响沉默率。卵、幼虫和成虫阶段昆虫体内dsRNA酶水平和pH可能不同,摄入的dsRNA的消耗率也取决于发育阶段。饲喂斑翅实蝇(Drosophila suzukii)成虫和幼虫 dsRNA,此 dsRNA的作用靶标为液泡分拣蛋白SNF7、液泡H[+]ATP酶、核糖体蛋白S13和α-外被体蛋白转录物。成虫和幼虫的处理条件一样,试验结果为对成虫的沉默效应较低和死亡率低。研究了对蚜虫(Myzus persicae)基因表达水平的影响,得到了相似的结果。经口给予dsRNA(作用于电压门控钠通道)对第一和二龄幼虫比对其他龄幼虫有较高沉默效应。相似地,对赤拟谷盗幼虫和成虫的研究表明幼虫对经口传递的 dsRNA-BiP和 dsRNA-Armet更敏感。食草性昆虫的取食可能对dsRNA传递产生生态性而不是生理屏障。例如,前几龄幼虫要比后几龄幼虫消费较少的食物。如果外用或以植物嵌入式杀虫剂应用,低龄虫由于取食率低可能不会接受到致死剂量的dsRNA,就会取食更长时间。此外,成虫和同品种幼虫可能具有不同的营养需求和取食率。另一知之甚少的因素是昆虫微生物群在dsRNA吸收中的潜在作用。肠道细菌影响肠道pH,也分泌降解dsRNA或干扰肠道细胞吸收dsRNA的核酸酶。因此,肠道环境是增加经口摄入dsRNA的RNAi的转录物敲除率的重要因素。
2 经口给予昆虫dsRNA的策略和限制
2.1 通过食物给予合成的dsRNA
摄入dsRNA的RNAi可通过不同方法完成。最简单的方法给昆虫饲喂含有合成dsRNA的食物。用滴管把 dsRNA溶液滴在或喷雾于叶和人工食物表面制取含有dsRNA的固体食物;把dsRNA以需要的浓度溶解于液体食物中。dsRNA可通过酶促逆转录或化学合成而离体合成。通过此方法已成功对数个品种进行了基因沉默,其中一些昆虫和靶标基因列于表1。显然,许多靶标基因,如甲壳素合成酶、α-微管蛋白和液泡型H+-ATP酶等对昆虫重要,压制它们的翻译可能导致昆虫死亡。人们对此类靶标有很大的兴趣可能是由于此技术可被开发替代农药。RNAi策略也已被用于防治蜜蜂和蚕等的经济重要性病害。这些昆虫通过产丝和蜂蜜以及给果树授粉每年产生数亿美元的产值。这类昆虫被病毒和寄生虫侵染会产生巨大的经济损失。例如多种因素可引发蜂群崩溃综合症(CCD),如以色列急性麻痹病毒(IAPV)的侵染、农药和生物多样性的减少。把作用于IPAV基因的dsRNA喷雾施于蜂巢,被IPAV侵染的蜂群可65%恢复。相似地,一研究小组研究了商业化 dsRNA产品(RemebeeTM)防治越冬蜜蜂的IAPV的防效。Remebee™是2个480 bp dsRNA分子的混合物,专门针对 IAPV设计,然而,还没有弄清楚其确切的序列。用 Remebee™处理后,蜜蜂种群的产蜜量是未处理的3倍。用合成的dsRNA防治在植物内部取食的昆虫(吸食和内食性)时在叶表面喷雾dsRNA溶液无效,需要其他施用策略。最近研究了通过土壤灌溉或枝干注射,维管系统传递dsRNA溶液来防治吸汁棕纹蝽(brown marmorated stink bug)。灌溉和枝干注射卵黄蛋白原-A1和保幼激素酸O-甲基转移酶 dsRNA,棕纹蝽的死亡率为35%~40%。相似地,把番茄根浸泽在鱼尼汀受体(RyRs)、乙酰胆碱酯酶(AChE)和烟碱乙酰胆碱α6(nAChRs)dsRNA溶液中,番茄斑潜蝇在植物叶片上取食后,其死亡率达到80%。从这些研究推断出植物韧皮部系统能够将dsRNA传递到植物所有组织,这对于控制以植物组织以及液汁为食的昆虫有益。
一般,可接受的沉默效应可以通过在昆虫食物中掺入合成的dsRNA来实现。这些效应在RNAi易感物种(例如鞘翅目)中更为明显,其中沉默率约为100%。相比,耐RNAi品种,其基因被敲除率约为0-50%。出现这种情况最可能的原因为肠道环境和结构的不同。经口摄入 dsRNA后,对敏感鞘翅目(赤拟谷盗)和耐性半翅目[豌豆蚜(Acyrthosiphon pisum)]中 RNAi效应的系统比较证实这些结论。在此研究中,对2种昆虫饲喂dsRNA,2种dsRNA长度相同,分别影响V-型ATP酶亚单元E(VTE)和抑制细胞凋亡(IAP)基因,试验结果为赤拟谷盗摄入 VTE和IAP-dsRNA后,其死亡率为 100%。豌豆蚜摄入IAP-dsRNA死亡率达到65%。对于蚜虫,尽管中肠pH为中性,但是较差的RNAi效应可能是由于分泌的唾液导致dsRNA降解所致。蚜虫和大多数吸汁式昆虫与取食固体食物的昆虫具有不同的肠道结构。它们具有缺少围食膜的滤室。其滤室旨在移动大量液体,而不是像咀嚼昆虫那样减慢固体的处理速度。可以说,咀嚼式口器昆虫与刺吸式昆虫相比,其中肠吸收dsRNA的时间更长。另一研究比较了siRNA片段和其前体全长 dsRNA的敲除效应。给棉铃虫(Helicoverpa zea)和烟蚜夜蛾(Heliothis virescens)饲喂全长激素生物合成激活神经肽(PBAN)dsRNA,幼虫生长延迟,二者的死亡率为75%以上,而siRNA处理死亡率约为55%。因此,全长dsRNA分子好像比siRNA片段能启动更强的RNAi效应。许多研究发现相似的现象,这可能是由于:⑴ 肠道细胞对长dsRNA的吸收比小的siRNA分子更有效;⑵ 有21 bp与mRNA互补的长dsRNA分子比具有相同序列的21 bp的siRNA的RNAi效应更高。
图3 蛋白质金属核酸酶中一般金属离子驱动机制的例子

表1 摄入合成的dsRNA可以启动RNAi并靶向各种节肢动物中的各种基因
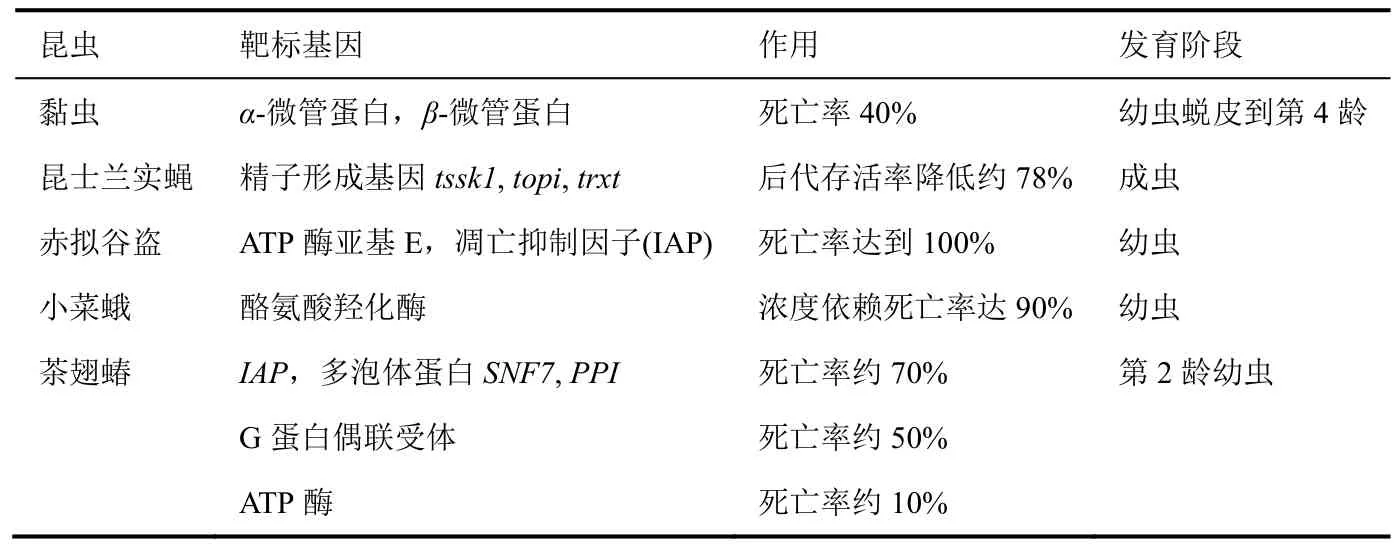
续表
这些研究表明饲喂昆虫含有合成 dsRNA的食物产生的 RNAi效应可能受许多因素的影响:肠道核酸酶、肠道pH和dsRNA分子的长度。此外,饲喂食物一般需要大量的dsRNA来激发RNAi效应。有时,这些效应变化大,即使是同一品种昆虫。此外,在摄入前也会发生一定水平的降解,因为dsRNA酶也可能存在于食物中。肠上皮细胞的吸收不足也可能弱化 RNAi效应。大规模生产用于害物管理的dsRNA可能仍然不具有成本效益。此外,通过重组微生物或病毒传递 dsRNA对非靶标生物有潜在的侵染风险,但此方法对大规模生产和提取dsRNA有用。总之,简单地通过饲喂含有合成dsRNA的食物的基因沉默在目前好像是更适合实验室研究,而不是大田应用。
2.2 合成dsRNA与纳米粒子联合应用
纳米粒子被定义为大小为1~100 nm的粒子,在科学文献中此范围比较大,一些文献中纳米粒子是指大小为1~500 nm的材料。纳米粒子可能包含阳离子聚合物、肽、糖、脂质和金属等不同分子,它们的应用差异也很大。在经口摄入dsRNA的RNAi过程中,纳米粒子可作为分子载体,促进dsRNA跨肠上皮细胞膜的转运。纳米粒子还可以保护核酸免受肠道内部核酸酶的降解。脂质体、鸟苷酸聚合物、量子点、壳聚糖和支链两亲性多肽胶囊(BAPC)和核-壳纳米粒子是已用于增加昆虫取食dsRNA的RNAi效应的纳米粒子系统,表2列出了更多如此系统的例子。
纳米粒子用于对经口摄入dsRNA的RNAi有耐性的昆虫后有明显积极的作用。此情况为肠道环境碱性强的甜菜夜蛾(Spodoptera exigua)等许多鳞翅目昆虫。以几丁质合成酶B的基因为靶标的dsRNA和聚鸟苷酸纳米粒子的联合物可使害虫死亡率增加53%,而单独的dsRNA所致的死亡率只有16%。此外,用甜菜夜蛾肠液处理这些dsRNA-聚合物复合体,dsRNA能耐肠液的降解时间长达30 h。饲喂豌豆蚜dsRNA和BAPC纳米粒子联合物,BAPC是2个支链两亲性肽以等摩尔浓度混合自组装而成的肽纳米胶囊。摄入BAPC与BiP-dsRNA联合物(t1/2=4~5 d),与摄入相同量的 BiP-dsRNA(t1/2=11~12 d)相比蚜虫死亡时间早。试验的BiP基因转录物是未折叠蛋白反应(UPR)的一部分,抑制其翻译可导致昆虫死亡。
值得一提的是,BAPC和含胍的聚合物纳米粒子含有氨基,pKa为9~13。具有这些功能团的纳米粒子在中性和碱性肠道环境中更稳定。对于 BAPC来说,其赖氨酸的氨基会质子化,使pH约10.5。去质子化会改变氨基酸的净电,使dsRNA-纳米粒子复合物的稳定性降低。一般,如果这些纳米粒子的氨基周围溶液的pH高于pKa,这些氨基就会去质子化。
2.2.1 纳米粒子和dsRNA缔结过程
在大多数情况下,纳米粒子和dsRNA通过静电作用进行缔结。纳米粒子中的阳离子基团(例如氨基)与dsRNA的磷酸基结合[图4(A)和(G)]。其结果是形成不同拓扑结构的纳米粒子-dsRNA复合体:球形、小泡状、棒状和多层。高分辨率扫描探针显微镜[例如原子力显微镜(AFM)]可以提供有关 dsRNA-纳米颗粒复合物的形状、大小和高度的精确信息。图4(B)和(E)是壳聚糖和BAPC纳米粒子与dsRNA相互作用的AFM图像,而图4(C)和(D)是游离纳米粒子的。一般,尽管与dsRNA带负电的磷酸基团相互作用,但dsRNA复合物仍保留净正电荷,这有助于与也带负电荷的细胞膜表面相互作用[图4(A)和(G)]。
肝磷脂、皮肤素和软骨素的硫酸化形式等天然黏多糖链是真核细胞膜具有负电位的原因。需要进行进一步的研究,来说明 dsRNA复合物的几何形状、大小和电荷如何影响昆虫中RNAi活性和生物分布。
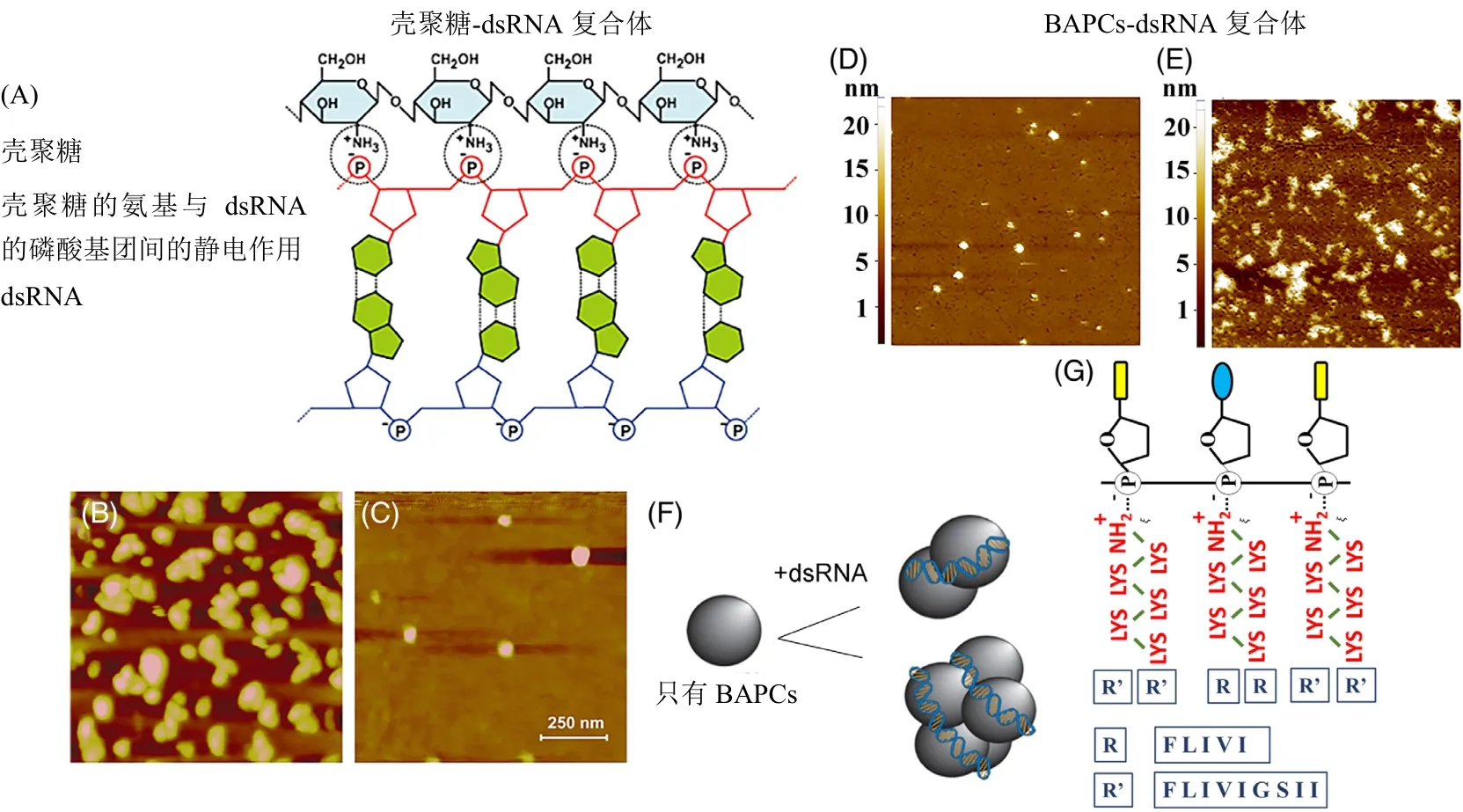
图4 用于诱导昆虫体内RNAi效应的不同dsRNA-纳米粒子复合体
2.3 细胞对 dsRNA-纳米粒子复合物的吸收和其在胞内的消失
一旦dsRNA-纳米粒子复合体结合于细胞膜上,它们最有可能通过内吞作用在细胞内内化。笔者认为 dsRNA-纳米粒子复合体在昆虫细胞内的吸收过程仍不明了。只研究了裸露的dsRNA(没有和纳米粒子缔结)的细胞内化过程。从对哺乳动物细胞内的研究,笔者推断这些复合物最可能通过内吞作用被细胞吸收,也有一些聚合物通过细胞膜的直接迁移的非内吞途径内化,随后扩散到细胞中(图5)。
在细胞吸收dsRNA后,一般认为中等程度的基因沉默效应可能是由于内吞小泡(初级内体、次级内体和溶酶体)的捕获和随后的降解所致。dsRNA与纳米粒子的复合体有助于避免 dsRNA在这些囊泡中的降解。聚合物和肽纳米粒子能够通过称为“海绵效应”的过程逃脱初级和次级内体的捕获。由于细胞器的正常酸化作用,这些纳米颗粒中存在的叔胺基团在内体内被质子化。此过程导致Cl-反离子流入以恢复中性。随后,通过渗透,过量的水进入内体,导致膜破裂。然而,确切的机制将取决于纳米粒子的类型,总的来说,此过程仍有争议。
2.3.1 RNAi技术中纳米粒子的潜力和不足
dsRNA与纳米粒子缔合有助于克服昆虫摄入dsRNA产生 RNAi效应所遭遇的细胞外和细胞障碍。如前所述,dsRNA从昆虫食物到肠道的上皮细胞这个过程中,dsRNA经常暴露于降解源(例如核酸酶,碱性pH)和物理屏障(营养膜)。纳米粒子可保护dsRNA免受核酸酶和碱的水解。纳米粒子也能使其穿过细胞膜转移,有助于逃脱内体的捕获。然而,需要更多的研究来了解纳米粒子在整个经口传递中的确切作用。只有1个试验研究了dsRNA缔结和没有缔结纳米粒子的情况下经口使用后在赤拟谷盗内脏器官中的分布。饲喂赤拟谷盗幼虫荧光标记的缔结BAPC的dsRNA,结果在中肠上皮细胞、脂肪体和马氏管中发现荧光,但只是在dsRNA缔结BAPC的情况下。饲喂幼虫dsRNA,在这些区域发现非常弱的荧光,或没有荧光。值得一提的是,在脂肪体中也发现了dsRNA。此器官参与多个代谢途径,虽然以前没有报道经取食后在此器官中的RNAi。另一受争议的为在细胞中dsRNA与纳米粒子的解离。为了能够被Dicer加工,dsRNA需要不受纳米粒子的束缚。对哺乳动物细胞的研究表明此解离过程发生于内体释放后。纳米粒子不能够与dsRNA解离会限制Dicer加工dsRNA的能力。因此,必须谨慎选择dsRNA与纳米粒子的比例。需要相似的优化过程来发现适用于昆虫的适宜比例。纳米粒子另一潜在的缺点是大规模生产成本高。制备纳米粒子所需的原材料价很高。最后,由于与核酸、蛋白质和细胞膜的不良相互作用,具有阳离子性质的纳米粒子可触发细胞毒性。在植物中,纳米粒子的毒性与质外生生物质流中的孔和障碍物的堵塞有关,从而减少了养分的吸收,干扰了光合作用,并破坏了DNA。在哺乳动物细胞中,脂质体可启动免疫反应,也抑制重要酶的活性,例如蛋白激酶。一些阳离子聚合物可引起细胞膜不稳定,引发质外体途径。总之,纳米粒子在环境中的影响需要在安全用于作物前进行仔细评估。

表2 用于防治害虫的dsRNA/纳米粒子的例子
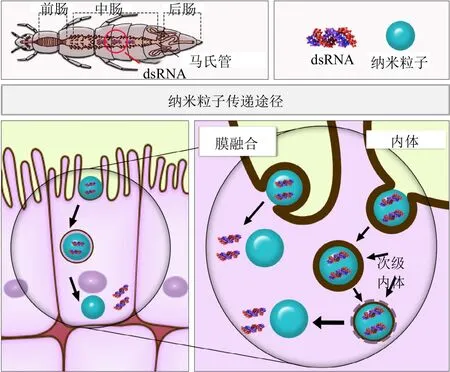
图5 肠上皮细胞可能通过2种途径吸收dsRNA-纳米粒子
2.4 转基因植物
获得RNAi效应的另一常见方法是昆虫取食转基因植物。植物介导RNAi包括开发产生品种特异性的dsRNA转基因植物。开发转基因植物的最常见策略之一为根癌农杆菌转化(Agrobacterium tumefaciens)。对于表达dsRNA的转基因植物,首先将反向重复序列克隆到质粒载体上,然后将其引入细菌根癌农杆菌中。然后用根癌农杆菌侵染靶标植物,并将一部分质粒载体整合到植物基因组中。许多研究用此方法开发了防治半翅目、鞘翅目和鳞翅目的dsRNA转基因植物,已获得成功的 RNAi效应。然而,植物自己 RNAi机器(Dicers)把长的 dsRNA加工为siRNA为开发dsRNA转基因植物的主要障碍。在昆虫吞噬前,长dsRNA被加工为20~25 bp siRNA可显著地降低 RNAi效应。然而,此问题已通过在缺乏此机器的细胞器中表达 dsRNA(例如叶绿体)而加以克服。例如饲喂马铃薯甲虫以表达定殖于叶绿体、以肌动蛋白为靶标的 dsRNA,其死亡率 100%;而饲喂定殖于植物的原子核dsRNA,昆虫没有死亡。相似地,在烟草(Nicotiana benthamiana)的叶绿体中表达乙酰胆碱酯酶dsRNA,棉铃虫(Helicoverpa armigera)幼虫取食此烟草后死亡率达70%。然而,缺乏有效的再生方案和单子叶植物的耐受性特性限制了许多植物中叶绿体转化的成功应用。因此,核转化仍是开发表达dsRNA的转基因植物的常用策略。与对照相比,表达抗18S核糖体RNA的dsRNA的核转化大豆植物可致大豆食心虫(Leguminivora glycinivorella)35%死亡,且对植物的伤害降低了。相似地,最近研究筛选了玉米根叶甲和油菜花露尾甲(Meligethes aeneus)的50个基因,选择了4个非常重要的靶标基因。此外,开发了作用于选择的 4个基因:Ras opposite (Rop),DNA-directed RNA聚合酶II亚基(DNA-directed RNA polymerase II subunit,RpII140)、染色质调节剂(Dre4)和mRNA前体剪接因子(ncm)。饲喂试验中玉米根叶甲和油菜花露尾甲的死亡率为60%~80%。植物的韧皮部汁液富含氨基酸、糖和其他营养成分,此类植物是取食韧皮部昆虫喜欢危害的对象。表达抗羧肽酶(Nlcar)、类胰蛋白酶的丝氨酸蛋白酶(Nltry)和己糖转运蛋白(NIHT) 3个重要基因的dsRNA的转基因水稻已被开发。饲喂褐飞虱这些植物,使基因转录水平降低40%~70%。该技术的潜在局限性是dsRNA在植物中的积累减少,这可以显着降低剂量和沉默效应的功效。
2.5 转化的微生物和病毒
使用表达 dsRNA的工程化微生物也是一个常见的经口施用dsRNA的方法。可以将dsRNA构建体克隆到细菌/酵母质粒中来大量生产。通常,转化的微生物缺乏RNAaseIII编码基因来避免dsRNA降解。dsRNA通过转化的微生物传递具有成本效益,而且相对容易进行。通过将dsRNA编码质粒克隆到细菌中可以大量生产dsRNA。用于转化的质粒和细菌菌株必须缺少 RNase III编码基因,以防止早期dsRNA降解。此外,转化的细菌与食物混合后经口传递给昆虫。摄入的细菌与其他肠道微生物竞争定殖。此技术首先应用于鳞翅目,饲喂表达几丁质合酶-A dsRNA的大肠杆菌(Escherichia coli )细胞于甜菜夜蛾幼虫、蛹和成虫。此研究也表明定殖的转化细菌能在肠道中释放 dsRNA,然后通过Sil-蛋白介导的途径被肠上皮细胞吸收。已提出2个方法来从表达dsRNA细菌传递dsRNA到昆虫:热灭活细菌(heat-killed bacteria )和活体细菌。用表达几丁质酶的热灭活转基因大肠杆菌处理黏虫(Mythimna separata)幼虫,在取食5 d后死亡率约16%。然而,取食含有表达作用于2个微管蛋白基因的dsRNA的活大肠杆菌细胞的人工饲料,处理后5 d,40%幼虫死亡,蜕皮受到抑制。这些结果表明活体细菌可能比热灭活细菌更有能力保护dsRNA不被肠道核酸酶和pH降解,传递dsRNA于柱状细胞。此外,另一研究发现,饲喂小菜蛾和棉铃虫幼虫和成虫表达dsRNA的活体细菌会严重影响幼虫的蜕皮,死亡率高达50%。处理成虫,对产卵和孵化的抑制率达到68%,但存活的卵孵化后没有发现其基因转录受抑制,表明使用活细菌可能会影响昆虫变态过程。另一方面,用表达β1整合蛋白dsRNA的活体和热灭活转基因大肠杆菌细胞处理甜菜夜蛾,甜菜夜蛾的死亡率30%~35%,二者没有差异。因此,用活体或灭活细菌所致的 RNAi的敏感性可能与品种有关,要考虑的1个因素是使用活体细菌进行喷雾处理植物可能会引起一些安全隐患,而且监管机构很可能不会批准这种方法。文献报道的一些有关转化微生物的研究已应用转基因大肠杆菌细胞进行了验证,这些转基因大肠杆菌细胞不是昆虫微生物菌群的一部分,可以通过抗菌免疫反应轻松消除。因此,有必要鉴定和分离合适的共生细菌以降低处理排斥反应。最近,椿象红球菌LMG5362和BF02 2个共生微生物分别从其寄主长红列纯(Rhodnius prolixus)和西花蓟马(Frankliniella occidentalis)分离得到。通过破坏RNaseIII基因,修饰2种细菌菌株,并用卵黄蛋白原和靶向α-微管蛋白的dsRNA构建体转化。通过人工饲料把这些细菌分别传递给昆虫,这些细菌成功定殖于后肠,导致昆虫60%~70%死亡。这项研究还表明,活细菌可以在同一代昆虫之间传播(水平传播),但不能传递给下一代。此外,摄入细菌定殖于后肠区域可能有利于产生RNAi,因为此区域存在较低量dsRNA酶。总的来说,该方法的主要挑战是分离适当的共生细菌、转化及其定殖。另一个限制因素是难以将细菌传递给刺吸式昆虫。到目前为止,尚未研究过根灌或树干注射法传递表达 dsRNA的细菌。另外,为了用该方法替代农药,有必要考虑微生物感染其他动物的可能性。RNAi的选择性基因沉默还可以通过表达 dsRNA的工程病毒的胞质传递来实现,这可以导致更稳定的基因下调。然而,相关研究只有一个,在此研究中,开发了针对3个黑腹果蝇基因(V型质子ATP合成酶亚基E、40S核糖体蛋白S13和Coatomer α-亚基)的dsRNA的重组鸡群病毒载体。然后通过微注射技术将这些载体施用于黑腹果蝇成年蝇中,结果表明,与未处理的对照组相比,所有靶向基因的表达水平降低了70%以上。尽管病毒载体以后可能替代经口传递dsRNA的方法,但在某些情况下,使用病毒进行dsRNA传递可能不是一种合适的策略,因为病毒可以编码RNAi抑制子,并且病毒诱导的沉默效应可以通过编码的RNAi 抑制子的特性来确定。最后,病毒的使用可能会存在安全问题,而这需要在田间应用前就解决。
2.6 组合和堆叠处理
RNAi技术也可以与标准的作物保护策略互为补充,例如化学农药与靶向农药抗性基因的dsRNA一同应用。此策略已成功用于柑橘重要害虫柑橘木虱和柑橘绿化病的介质。与仅用dsRNA处理的柑橘木虱相比,饲喂靶向谷胱甘肽S-转移酶的dsRNA以及2种杀虫剂噻虫嗪和苯丙酸菊酯后柑橘木虱的死亡率分别增加了23%和15%。这些研究也表明对此组合处理的反应可能不同,即使是同一品种。因此,研究它们的作用方式和抗性途径来确定更有潜力的RNAi靶标很重要。白蚁是一种经济重要的害虫,已用含有dsRNA的堆叠处理进行防治。当把作用于纤维素降解酶——内切葡聚糖酶的 dsRNA和杀虫剂氟虫脲组合处理白蚁时,白蚁的死亡率与单独氟虫脲处理相比增加12%。
另一重组策略为在转基因植物中堆叠 Bt-毒素和dsRNA性状。苏云金芽孢杆菌产生Bt,一些菌株的Bt-毒素对昆虫高毒,例如Cry1、Cry2、Cry3和Cry4。在30多年前就报道使用表达Bt-毒素的转基因植物,实践证明它们对一些危害一年生田间作物的害物非常有效。然而,一些品种对此毒素发展了抗性。能同时表达Bt-毒素和作用于抗性发展基因的dsRNA的转基因植物可能缓解在不知道是否存在抗性昆虫种群的情况下部署Bt形状的担忧。由此开发了玉米根虫的抗性管理(IRM)工具。名为 SmartStax的转基因植物最近被EPA管理委员会批准,其表达2个 Bt-毒素亚基(Cry3Bb1和Cry34Ab1/Cry35Ab1)和液泡分选蛋白。此植物预期能降低80%~95%玉米根虫的出现,其持效性增加。最后,另一组合策略为饲喂昆虫作用于不同基因的dsRNA的混合物。摄入 dsRNA后沉默效应一般取决于靶标基因的活力和组织表达水平。饲喂白蜡窄几丁幼虫和成虫高浓度(10 µg/µL)的作用于热应激蛋白-70或shibire(2个重要基因)的dsRNA,昆虫90%死亡。然而,一起低浓度施用(1 μg/μL) 2个dsRNA,二者具有增效作用,死亡率与上相似(约 90%)。饲喂赤拟谷盗 Bip和Armet dsRNA和BAPC纳米粒子的复合物,也发现相似的作用。而2个dsRNA单独与纳米粒子的复合物进行处理昆虫的死亡率为25%,而组合处理的死亡率为 60%。有趣的是,作用于生命转录物的 11个 dsRNA的组合,通过注射方法处理赤拟谷盗没有增效作用。11个 dsRNA单独处理昆虫死亡率80%~100%。因此,需要对此方法进行进一步的评估来测定dsRNA靶标的最佳数量和浓度范围。
3 总结和未来
目前,至少2个管理机构,加拿大食品检验局和美国环保局已批准RNAi害物管理方法。2个机构批准使用作用于玉米根虫的转基因作物。因此,刚开始认识到 RNAi作为新的、创新害物管理方法的潜力。然而,有数个因素应该考虑来确保经口摄入dsRNA进行害物管理的持续性,具体如下。
选择靶标基因:经口dsRNA传递的效率取决于基因选择、昆虫品种和生命阶段。靶基因的选择至关重要,因为诸如肠道 pH和核酸酶等生理障碍会阻碍dsRNA的吸收和在组织中的分布,从而影响传递到靶器官。对防治害虫的 RNAi的主要研究集中在中肠的酶和蛋白质。总体而言,针对与消化机制(例如-葡聚糖酶、丝氨酸蛋白酶)、防御机制(例如过氧化氢酶)和代谢(例如糖原合酶、几丁质酶)相关的基因的产品,已致昆虫一定比率死亡。也已成功获得其他针对运动、取食方法、温度控制、生长和发育的其他转录物。
dsRNA的特异性:设计或选择 dsRNA序列是重要过程。例如液泡型APT合成酶和几丁质合酶基因常见于大多数昆虫和其他生物。为了选择高特异性dsRNA序列,应该考虑以下2条:⑴ 与代理种(避免由于多态性而致的抗性)相比,选择保守的序列,与各自靶标基因有85%~100%的同源性;⑵ 排除与其他基因或昆虫具有 19-mer(19-21核苷酸连续序列)同源性的 dsRNA序列,以避免非特异性或靶标毒性。第 2个标准(排除与其他昆虫或基因具有 19-21 mer同源性的序列)更为关键,因为它排除了与其他生物中同一基因的任何siRNA互补片段。各种生物信息学工具(例如 E-RNAi,OfftargetFinder和MUSCLE)可用于设计dsRNA,可通过基因组数据库进行筛选以确定理想序列。在最近的一项研究中,将dsRNA注射入亚洲玉米螟,之后从昆虫体内提取到消化后的19~25 bp小siRNA片段。这些siRNA片段的序列在5'和3'末端具有保守的GGU点,这表明Dicer/RNase酶在剪接dsRNA时具有位点偏爱性。该知识可能有助于预测由特定 dsRNA序列产生的功能性siRNA片段。因此,将这些位点整合到dsRNA中,可以获得更高的RNAi效应。
dsRNA的长度:dsRNA的自然吸收取决于长度,研究人员测试了50~2 000 bp的dsRNA分子,它们经Dicer加工后可产生约10~25的siRNA片段。然而,200~550 bp能更有效地启动RNAi效应。一项最新研究通过饲喂2种鳞翅目幼虫,将具有短串联序列的 dsRNA(重复核苷酸序列的多个拷贝)与传统的长非串联的dsRNA进行了比较。要获得相等的效应,所需的串联dsRNA(0.5 μg)的剂量要低于非串联(2 μg)的。
RNAi机器的剂量和饱和度:dsRNA浓度和处理次数是昆虫经口传递 dsRNA有效性的主要决定因素。一些研究提出,需要持续较高浓度(>1 μg)的dsRNA才能在昆虫中诱导RNAi效应,以防止有害生物反复感染。然而,对橘小实蝇(Bactrocera dorsalis)的研究表明重复使用 dsRNA会影响 RNAi的作用,使此害虫难治。有趣的是低浓度的第2次使用缩短了难防治期,而较高浓度延长了。从这项研究可以推断出,多次小剂量比一次大剂量对复发性有害生物侵染更有效。经口传递方式对昆虫吸收dsRNA和dsRNA在昆虫体内的累积具有重要作用。太多的经口传递的dsRNA分子可能引起dsRNA加工酶的饱和,也能影响整体基因表达方式。这可能对暴露于dsRNA处理的非靶标品种更重要。对蜜蜂的研究检查了dsRNA-GFP处理(饲喂)对工蜂的整体基因表达方式的影响。报道,由于dsRNA-GFP的影响约1 400个基因的表达发生了改变,而这约为蜜蜂基因组的 10%。这些基因参与与 RNA加工和运输、激素代谢、免疫以及对外部刺激和压力的反应相关的重要发育和代谢过程。
抗性:昆虫可能通过2种机制对dsRNA发展抗性:⑴ 下调dsRNA加工机器或其突变;⑵ 降低昆虫肠道对dsRNA的吸收。在田间和实验室中,给玉米根虫饲喂表达DvSnf7 dsRNA的转基因植物,玉米根虫对dsRNA发展抗性。进一步的分析表明,抗性基因存在于常染色体的单个位点上,并且是隐性遗传。此外,靶基因的突变和多态性可导致dsRNA与mRNA序列不匹配,从而导致抗性的发展。多态性在自然界中很常见,并且与生物多样性和进化有关。通过使用生物信息学工具筛选更多潜在的靶标及其多态性频率,从而跨物种识别保守域,可以最大程度地减少由于多态性引起的错配。通过饲喂的RNAi具有巨大的潜力作为害虫管理技术。但是,在将其用于害虫防治之前,需要弥补一些知识空白。根据应用dsRNA的农业系统,可能需要考虑与对非靶标生物的潜在影响、dsRNA在环境中的命运、足够的剂量以及合适的给药方法相关的担忧。然而,基于RNAi的昆虫防治新时代为有效地、对靶标选择性更高的害物管理提供了新机遇。
