C1GALT1在恶性肿瘤中的相关研究进展*
2020-01-17王明珠综述陈勇审校
王明珠 综述 陈勇 审校
糖基化是蛋白质翻译后修饰的一种重要方式,异常的糖基化在肿瘤发生发展的过程中起重要作用[1],直接影响肿瘤细胞的黏附、迁移、识别、免疫逃避和血管生成等恶性行为[2-4]。核心1β1 3-半乳糖基转移酶1(core 1 β1-3 galactosyltransferase 1,C1GALT1)又称为T-合酶(T-synthase),是O-聚糖修饰过程中核心1(core1)结构合成的必需酶[5]。C1GALT1的异常表达与肿瘤的发生发展密切相关,针对C1GALT1 的研究将为寻找肿瘤治疗的新靶点提供新的思路。本文就C1GALT1在恶性肿瘤中的研究进展及其作用机制进行综述。
1 C1GALT1在蛋白质糖基化修饰中的作用
蛋白糖基化主要包括O-糖基化和N-糖基化,两者的改变与癌症的发生发展有关[6-8]。由于黏蛋白中>80%成分由O-聚糖组成[9],因此O-糖基化也称黏蛋白型O-糖基化。O-糖基化始于N-乙酰氨基半乳糖与丝氨酸或苏氨酸之间以α 连接形成GalNAcαSer/Thr 基本结构(Tn 抗原)。与N-糖基化相比,O-糖基化能催化生成更多的糖链,因而在结构和功能上更加复杂。参与黏蛋白型O-聚糖的起始合成和延伸的糖基转移酶包括:多肽-GalNAc-转移酶(GALNT)、C1GALT1、核心2β1,6-N-乙酰葡糖胺基转移酶(C2GnT-M)和β1,4-半乳糖基转移酶(β4Gal-TIV)。同时还有α2-6唾液酸转移酶(ST6GalNAc)和α2-3 唾液酸转移酶(ST3Gal)参与唾液酸末端与O-聚糖链的连接。O-糖基化修饰主要有两种核心亚型,即以core1为基础的core 1、2亚型和以core 3为基础的core3、4 亚型[5]。其中,O-糖基化修饰主要以core1型O-聚糖为基础,其合成主要受C1GALT1的调控。C1GALT1基因定位于染色体7p22.1-p21.3,是定位于高尔基体中的关键黏蛋白型O-糖基转移酶。C1GALT1 的作用是将半乳糖(Gal)转移至Tn 抗原上形成Galβ1-3GalNAcαSer/Thr 结构(T 抗原,core1 结构)[1,10-12],以作为进一步复杂的O-聚糖形成的基础,如core2结构、唾液酸T抗原等(图1)[13]。
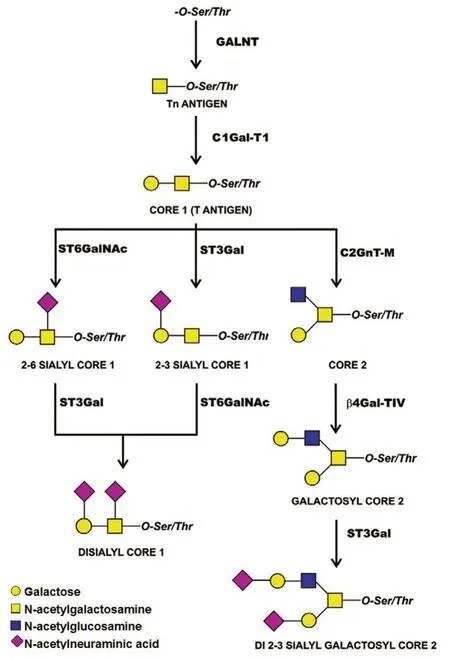
图1 黏蛋白型O-聚糖生物合成途径[13]
2 C1GALT1参与肿瘤的发生
蛋白质异常的O-糖基化被认为是疾病的潜在标志物,C1GALT1在呼吸系统、胃肠系统和泌尿生殖系统等多种实体瘤的发生发展中发挥重要作用,调控着多种肿瘤相关蛋白的O-糖基化修饰,进而影响肿瘤的恶性表型及预后。
在消化系统肿瘤的研究中,发现C1GALT1 在食管癌组织中的表达显著高于正常食管组织,同时肿瘤组织中MUC1蛋白O-糖基化水平也显著高于癌旁组织。C1GALT1的表达水平不仅与MUC1蛋白的O-糖基化之间呈显著正相关,还与食管鳞癌的淋巴结转移、分期及预后显著相关[14]。在结直肠癌中,有研究发现C1GALT1在癌组织中的表达显著高于癌旁正常组织,同时C1GALT1 高表达的患者预后显著差于C1GALT1低表达患者[15]。在肝细胞癌中,Wu等[16]研究发现C1GALT1 在肝癌组织中高表达,C1GALT1 高表达与肿瘤T分期晚、肿瘤发生转移以及预后不佳密切相关。然而,C1GALT1 在胰腺癌中的表达可能与其他消化系统肿瘤不同。Chugh 等[17]研究发现,C1GALT1在分化较差的癌组织中的表达显著低于分化较好的癌组织,并且癌组织中T抗原的表达显著低于Tn抗原的表达,提示C1GALT1可能在胰腺癌中发挥不同的生物学作用。同样在胃癌中,Liu 等[18]研究发现特异性敲除胃黏膜上皮细胞C1GALT1的小鼠可出现自发性胃窦炎,进而发展成为胃窦腺癌,表明C1GALT1 介导的O-糖基化在胃稳态及胃黏膜保护方面发挥关键作用。
在生殖、内分泌系统肿瘤的研究中,Chou等[19]报道了C1GALT1在乳腺癌组织中表达显著高于正常乳腺组织,C1GALT1表达越高,肿瘤组织学分级越高,分期越晚。此外,研究还发现C1GALT1是乳腺癌预后不良的独立影响因素[20]。在前列腺癌的研究中,Tzeng等[21]研究发现在前列腺癌转移病灶或去势抵抗型前列腺癌转移病灶中,黏蛋白型O-聚糖生物合成活性显著高于原发肿瘤,C1GALT1在去势抵抗型前列腺癌转移病灶中的表达显著高于原发灶中的表达。70%前列腺癌组织高表达C1GALT1,其与肿瘤的分期呈正相关,提示C1GALT1可能不仅参与前列腺癌的发生发展,还可能影响前列腺癌内分泌治疗的疗效。
在头颈部肿瘤的研究中,Lin等[22]研究发现C1GALT1在头颈部鳞癌组织中的表达显著高于正常口腔黏膜的表达,C1GALT1表达与淋巴结转移、远处转移、肿瘤高分级及淋巴血管侵犯密切相关。此外,高表达C1GALT1的患者预后显著劣于低表达的患者。
3 C1GALT1在实体肿瘤中的作用及其分子调控机制
C1GALT1 在多种肿瘤中出现异常的表达,参与肿瘤的演进过程,涉及肿瘤侵袭转移、放疗抵抗、耐药等生物学行为。然而,C1GALT1 在胰腺癌中的功能与其他实体瘤完全不同。因此,研究C1GALT1 在实体瘤中生物学效应及其机制将有利于进一步探索针对C1GALT1的肿瘤治疗策略。
3.1 C1GALT1调控肿瘤的增殖与侵袭转移
在消化系统肿瘤的研究中,研究发现C1GALT1的表达与大肠癌细胞的恶性表型呈显著正相关,过表达C1GALT1促进了大肠癌HCT116和SW480细胞侵袭转移、干细胞球形成及干细胞标志物(NANOG和OCT4)的表达,C1GALT1能够提高FGFR2的O-糖基化水平以及bFGF介导的FGFR2和ERK1/2的磷酸化水平,进而促进大肠癌细胞的恶性行为[15]。C1GALT1可以增加肝癌细胞的黏蛋白型O-聚糖表达并选择性激活HGF/MET信号通路来促进细胞的增殖,C1GALT1通过提高肝癌细胞中MET蛋白的O-糖基化水平和促进HGF介导的MET蛋白的二聚体化来激活MET信号通路而发挥作用[16]。同时,C1GALT1还可促进肝癌细胞与细胞外基质蛋白的黏附以及癌细胞的侵袭转移,C1GALT1通过改变β1-整合素(β1-integrin)蛋白的O-糖基化水平来调控肝癌细胞膜上β1-integrin蛋白的激活,而β1-integrin蛋白水平并未改变[23]。与之相反,在胰腺癌中敲除胰腺癌T3M4细胞C1GALT1基因后肿瘤的增殖、侵袭及成瘤能力明显增加。在动物实验中,特异性敲除胰腺组织C1GALT1的KPCC小鼠胰腺组织发生癌变及肿瘤进展速度显著加快,C1GALT1表达缺失的KPCC小鼠,胰腺肿瘤组织分化更差,细胞增殖加快,有丝分裂增加,肿瘤基质成分减少,肿瘤早期转移发生率高,肿瘤细胞的间质标志物(Snail1、Slug、Vimentin)表达增加,而上皮性标志物(E-cadherin和Claudin-1)表达下降[17]。上述研究结果提示,C1GALT1在胰腺癌中可能呈现抑癌基因作用,缺失C1GALT1的表达可促进胰腺癌的发展与转移。
在生殖、内分泌系统肿瘤中,Chou 等[19]报道了C1GALT1能够促进乳腺癌MCF-7细胞的增殖和侵袭转移。C1GALT1不仅能够促进乳腺癌细胞膜上MUC1蛋白O-糖基化修饰,同时还可促进细胞膜上MUC1-N亚基的释放和跨膜蛋白MUC1-C亚基与β-连环蛋白同时发生核转位,激活ERK信号通路,进而促进肿瘤的恶性表型。此外,研究发现C1GALT1能够改变卵巢癌细胞(ES-2、OVTW59-p4及SKOV3)糖蛋白的O-糖基化水平,并且C1GALT1能够促进肿瘤细胞的侵袭和增殖,甚至还能提高肿瘤细胞的干细胞潜能[24]。
在头颈部肿瘤中,抑制HNSCC细胞(OEC-M1和FaDu)C1GALT1的表达后,细胞的增殖、侵袭及转移能力明显降低,进一步的机制研究显示C1GALT1能够调控细胞EGFR蛋白的O-糖基化修饰,抑制C1GALT1的表达阻断了EGFR上的O-聚糖延伸继而抑制EGFR信号转导发挥抑制肿瘤恶性表型的作用[22]。
3.2 C1GALT1促进肿瘤的放疗抵抗
放疗为实体瘤治疗的重要手段之一。研究发现,C1GALT1可以增加食管癌和头颈部肿瘤细胞对放疗的抵抗性。放疗能诱导食管癌ECa109、KYSE150及TE-1细胞C1GALT1的表达并且增加细胞O-糖基化水平。采用siRNA抑制食管癌ECa109细胞C1GALT1的表达后,细胞对放疗的敏感度显著增加,同时细胞的侵袭迁移能力明显受到抑制[25]。在头颈部肿瘤的研究中,Dong等[26]研究发现在喉癌细胞系中O-糖基化修饰参与肿瘤细胞对放疗敏感度,放疗抵抗的喉癌Hep-2max细胞较放疗敏感度的喉癌Hep-2min细胞表达更高的core1型O-聚糖,抑制细胞的O-糖基化修饰,细胞的放疗敏感度显著增加。C1GALT1的表达与肿瘤细胞的放疗敏感度呈显著负相关。在机制研究方面发现,C1GALT1通过调控细胞β1-integrin蛋白的O-糖基化水平来参与食管癌、喉癌细胞的放疗抵抗[25-26]。
3.3 C1GALT1促进肿瘤内分泌治疗抵抗
内分泌治疗是前列腺癌的一种重要治疗方法,有研究发现[21]前列腺癌细胞LNCaP在发生激素抵抗的过程中,C1GALT1和T抗原的表达显著增加,O-糖基化信号通路的激活能够促进前列腺癌细胞的去势抵抗和转移,而抑制C1GALT1的表达可提高去势抵抗型LNCaP细胞对恩杂鲁胺的敏感度。该研究还发现,原癌基因MYC通过结合到C1GALT1的启动子区促进C1GALT1的表达并提高细胞表面的O-糖基化修饰水平,进而引发细胞与半乳糖凝集素-4结合和下游信号通路的激活。上述研究结果提示,C1GALT1介导的O-糖基化修饰在前列腺癌的去势抵抗中发挥重要作用,改变细胞的O-糖基化可能是改变肿瘤内分泌治疗敏感度的一个治疗策略。
4 结语
综上所述,肿瘤细胞中存在O-聚糖结构和数目的改变,异常糖基化在癌症进展的过程中发挥重要作用。C1GALT1异常表达不仅改变了肿瘤细胞中O-聚糖修饰水平,还促进了多种实体瘤的增殖、侵袭转移和放疗抵抗等恶性行为,最终导致患者预后不良。但在胰腺癌中C1GALT1 可能发挥完全相反的作用。随着对C1GALT1及其调控的O-糖基化修饰研究的不断深入,明确C1GALT1及其相关分子在肿瘤进展中的作用,将为治疗恶性肿瘤提供新的思路。
