重症急性胰腺炎患者中心静脉置管相关感染的危险因素及预防
2020-01-17罗和生
吴 群, 罗和生
武汉大学人民医院消化内科,湖北 武汉 430060
急性胰腺炎是消化系统疾病中常见疾病之一,发病率为30.0/10万[1],其中15%~20%患者可发展为器官衰竭、危及生命的重症急性胰腺炎,死亡率高达25%[2-3]。中心静脉置管(central venous catheterization,CVC)以操作简便、安全、使用周期长、创伤小等优点,成为现代医疗实践必不可少的辅助措施。它主要用于静脉输液、肠外营养、血液动力学监测、抢救危重患者等临床工作中。CVC为重症急性胰腺炎患者提供稳定和安全的血管通路,是重症急性胰腺炎患者救治过程中重要的操作措施。中心静脉穿刺通常被认为是一个相对安全的程序,然而仍有并发出血、血栓、感染、气胸等风险。血流感染作为一种严重的感染,也是中心静脉通路中最常见的危及生命的并发症,据报道,导管相关血流感染发生率为3%~8%[4]。目前已有许多学者研究了有关重症监护患者、血液透析患者、严重烧伤患者的CVC相关感染状况,然而,重症急性胰腺炎患者的CVC感染相关研究较少。本研究旨在根据导管插入部位评估感染率,并分析重症急性胰腺炎患者中CVC相关感染的危险因素。
1 资料与方法
1.1 一般资料收集我院2017年1月至2018年12月已行CVC操作的重症急性胰腺炎患者130例,排除资料不全、住院天数过短(<14 d)患者后,共纳入研究患者126例,男75例,女51例;年龄(49.88±15.25)岁(19~84岁)。其中,胆源性患者58例,高血脂性患者43例,酒精性患者3例,暴饮暴食引起者2例,术后所致2例,自身免疫相关性胰腺炎患者1例,特发性胰腺炎患者17例。住院期间重症急性胰腺炎的发病率和死亡率分别为11.95%(126/1054)和9.52%(12/126),本试验研究期间,我院收住急性胰腺炎患者的总例数为1 054。
1.2 方法选定中心静脉穿刺位置(锁骨下静脉或颈静脉),行消毒,局麻,进行穿刺操作,置入中心静脉导管(CV-17702-E-CVC双腔,美国ARROW),定期观察穿刺部位,当出现置管位置化脓或怀疑患者感染症状与导管相关时拔除中心静脉导管,并且定时送入实验室进行病原菌培养检查,及时观察并报告结果。记录置管方式、导管插入部位、留置导管时间。回顾性分析上述126例重症急性胰腺炎患者的临床资料,包括性别、年龄、合并基础疾病、是否并发腹腔感染、胰腺坏死面积(入院72 h内CT影像)、总胆固醇值(TC)、三酰甘油(TG)、入院时血糖、血清白蛋白(ALB)、持续静脉营养日及病原菌培养结果,评估这些因素是否为静脉导管并发感染的危险因素。
1.3 诊断标准
1.3.1 导管相关性感染(CVC related infection,CVC-RI):定义为符合以下任意一项标准[5]:(1)置管位置化脓和外周血培养生长相同的生物体;(2)至少有以下一种症状出现:发热(T>38.0 ℃)、寒颤、低血压,在导管拔除后8~12 h逐渐消失;(3)导管的阳性定量培养加上生长相同生物体的外周血培养物,且中心静脉导管血培养阳性比外周血早2 h;(4)配对定量血培养通过导管吸取的培养物中每毫升含有的菌落形成单位(catheter colony-forming units,CFU)的数量至少是外周血培养的CFU数量的5倍。
1.3.2 重症急性胰腺炎:根据中国急性胰腺炎诊治指南(2013年,上海)[6],一般应具备下列3条中任意2条,即可诊断为急性胰腺炎:(1)急性、持续中上腹痛;(2)血淀粉酶和(或)脂肪酶指标大于正常上限值3倍;(3)典型的急性胰腺炎影像学改变。当符合急性胰腺炎的患者伴有持续的器官功能衰竭(>48 h)时,称为重症急性胰腺炎。器官功能衰竭的诊断标准依据改良Marshall评分系统(见表1)[7],任何器官评分≥2分可定义存在器官功能衰竭。

表1 判断重症急性胰腺炎伴有器官功能衰竭改良Marshall评分系统(≥2分重症急性胰腺炎)
注:FiO2为吸入氧浓度,按照空气(21%)及纯氧2 L/min(25%)、4 L/min(30%)、6~8 L/min(40%)、9~10 L/min(50%)换算;1 mmHg=0.133 kPa。

2 结果
2.1 总体感染发生率及病原菌分布本研究对126例重症急性胰腺炎已行CVC患者进行临床资料分析,发生相关性导管感染23例,CVC感染的发生率18.25%,千日感染率为7.57‰,细菌检出15株,其中革兰阴性菌6株,革兰阳性菌9株,真菌检出11株(见表2)。
2.2 重症急性胰腺炎并发CVC-RI单因素分析合并基础疾病者69例,包括高血压、高血脂、冠心病、糖尿病、自身免疫疾病等,占总患者数的54.76%,其中高血压和糖尿病的患病率分别为23.02%、15.87%。各指标分析结果显示,患者不同性别、年龄、胰腺坏死面积(入院1周时CT检查)、APECHEⅡ评分、置管方式、TC、TG、ALB各例次置管后CVC-RI发生情况,差异均无统计学意义(P均>0.05)。而患者合并有基础疾病、并发腹腔感染、持续静脉营养日(≥18 d)、置管部位及导管留置时间(>2周)均会显著增加留置导管感染发生率,差异有统计学意义(P<0.05,见表3)。
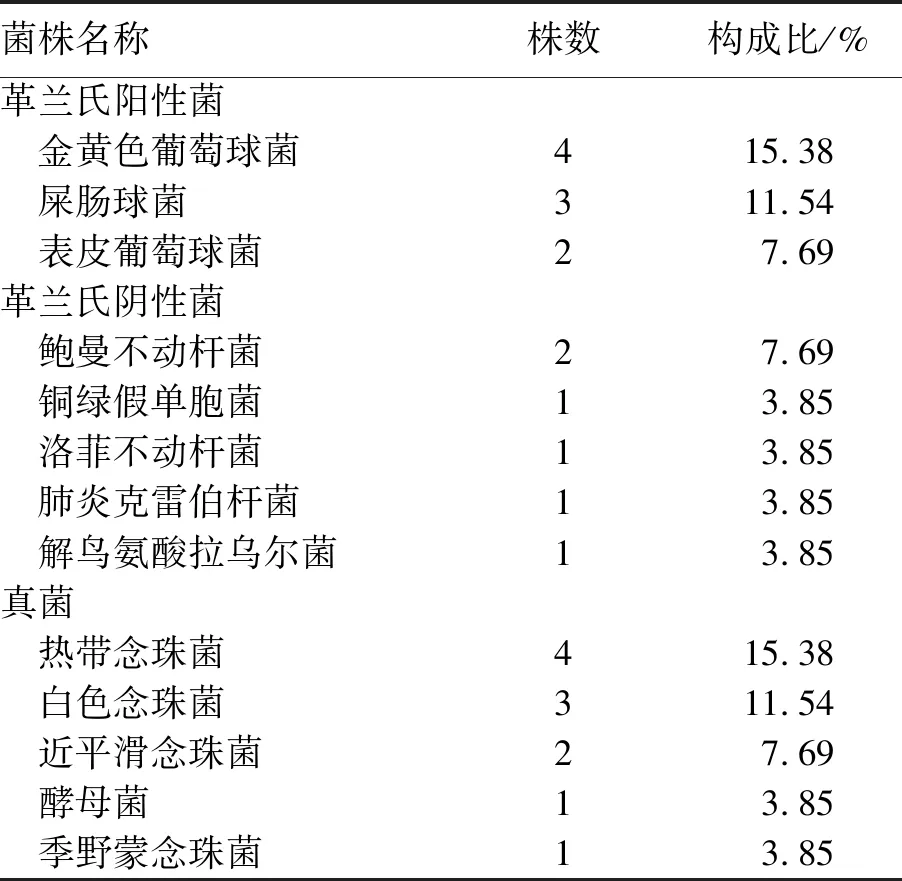
表2 CVC感染病原菌分布构成比
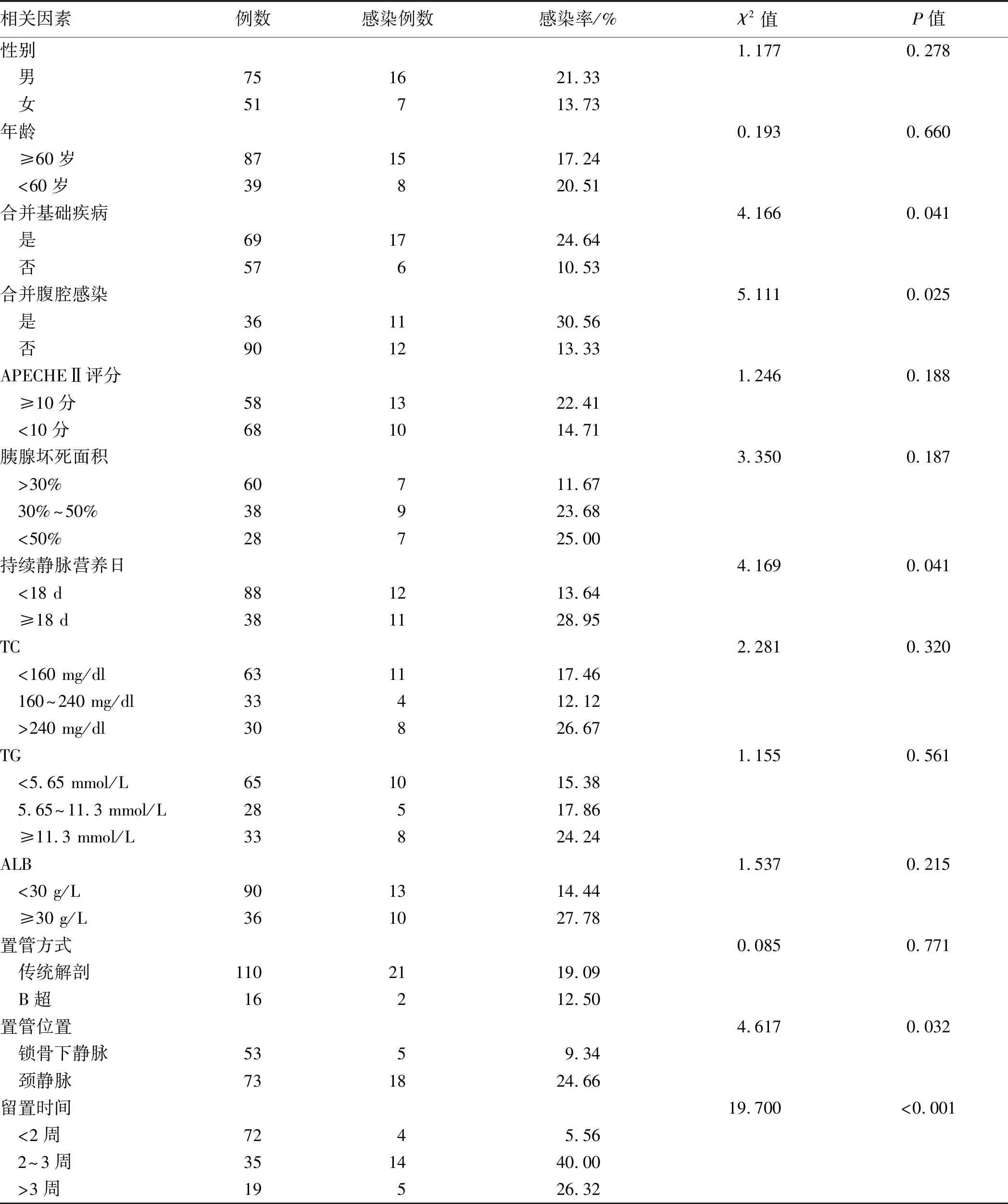
表3 单因素分析CVC感染相关因素
2.3 重症急性胰腺炎并发CVC-RI的多因素Logistic逐步回归分析合并有基础疾病、腹腔感染、持续静脉营养日、置管部位及导管留置时间这5项为患者发生CVC-RI的独立危险因素(P<0.05或P<0.01,见表4)。
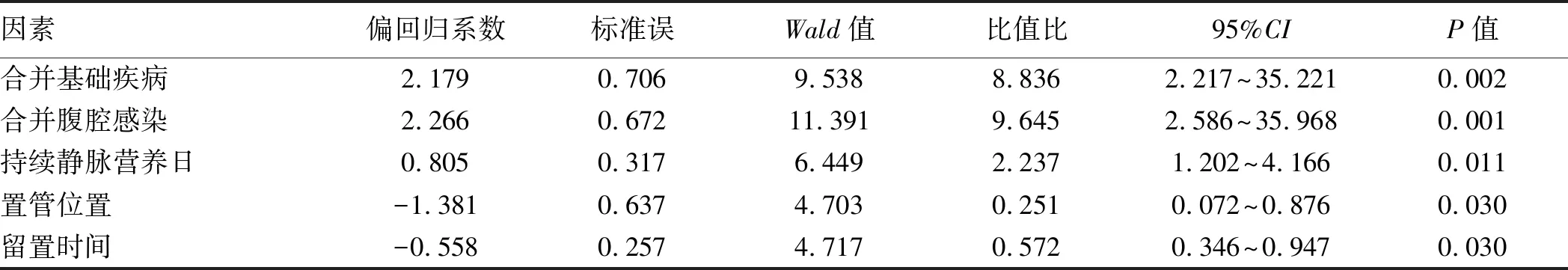
表4 重症急性胰腺炎患者发生导管相关性感染的多因素Logistic逐步回归分析
3 讨论
CVC技术具有多种不同的功能,临床上使用日益广泛,在重症急性胰腺炎患者治疗中发挥重要作用。然而CVC-RI会使患者平均住院时间明显延长,增加患者住院费用,甚至造成死亡[8]。许多研究报道指出凝固酶阴性葡萄球菌是最常见的生物体[9-10]。早期我国段秀庆等[11]在对127例重症急性胰腺炎CVC感染的研究中,有51次导管尖端培养阳性,其中细菌检测63株,占91%,革兰阴性菌占51%,革兰阳性菌占40%,真菌检出6株,占9%。与其研究报道有所不同,本研究中以真菌感染率较高为42.31%,而革兰氏阳性菌、阴性菌相对较低,分别为34.62%、23.08%。其原因可能与我院相关科室在急性胰腺炎患者初始的治疗阶段,第三代头孢菌素常规用于该类患者的早期预防治疗有关。随着病情加重、感染未控制或病原菌不明时,多种抗生素联合使用或升级为非常广谱抗生素日益频繁。而广谱抗生素的广泛、长时间使用,二重感染增加,使真菌病的发生率明显升高。此外,有关研究[12]指出一旦病原菌出现在血液中,它可以附着在纤维蛋白膜下的导管尖端,从而逃避机体的免疫系统及抗菌药物的攻击,从而导致CVC-RI的发生。
重症急性胰腺炎患者大多合并基础病变,并发有微血管病变,微血管舒缩反应减弱、屏障功能破坏、通透性增加以及血液流变学的改变,易造成组织的血液灌流减少,影响机体正常代谢机制及修复功能。患者在发病过程中伴随单个或多个器官衰竭、代谢功能紊乱、营养消耗、蛋白分解增加,导致机体内环境紊乱、免疫功能失调、抵抗力下降,病原菌感染机会增加。本研究中,36例患者(28.57%)证实有腹腔感染,经Logistic多因素逐步回归分析显示:合并腹腔感染患者相对于无腹腔感染者,发生导管感染的风险增加(OR=9.645,95%CI:2.586~35.968)。可能与肠道菌群易位和坏死组织继发感染致病原菌入血有关[13]。另外,在感染性坏死性胰腺炎治疗中,预防性广谱抗生素(如头孢哌酮、亚胺培南、莫西沙星)的使用十分普遍,因为广谱抗生素能很好地穿透胰腺,并能覆盖通常在感染的胰腺坏死中发现的生物体。然而,抗生素的广泛使用可能导致真菌感染和多重耐药细菌的增加。因此,在预防性使用广谱抗生素前,仔细确定抗生素制剂的最佳选择和使用时间,以避免多重耐药的发生,加重疾病的恶化。
本研究中行短期(<18 d)肠外营养治疗(parenteral nutrition,PN)的CVC相关性感染发生12例(13.64%),而行长期(≥18 d)PN治疗的CVC相关性感染发生11例(28.95%),其发生率明显高于短期(<18 d)行PN治疗的患者(OR=2.237,95%CI:1.202~4.166)。重症急性胰腺炎患者处于长期禁食、禁水状态,胃肠外营养时间长,易造成营养不良,加重了感染和免疫抑制。YAMADA等[14]在有关PN研究中提到,患者的肠黏膜组织因长期缺乏能源物质的供给与刺激而发生萎缩凋亡,导致肠道屏障功能变弱,肠道细菌更容易移位入血,导致感染并发症风险增加,包括导管相关血流感染。另外,静脉中高营养性物质如葡萄糖、氨基酸、脂肪乳、白蛋白、血浆等是病原菌良好的培养基,且PN输注时间一般较长,通常实行数小时连续滴注,大量营养物质残留在导管壁上,为细菌繁殖创造了理想的条件。另外输注PN者导管内溶质含量高,易引起血栓性静脉炎,溶质黏附于导管壁上容易堵塞管腔,从而使病原菌感染更易发生[15]。此外,血液中的真菌在含糖的液体中会产生一种“黏物质”,对导管产生很强的黏附力,影响机体的防御力,所以长期接受PN的患者易引起真菌感染[16]。
CVC的常见置管部位,成人有颈内静脉、锁骨下静脉和股静脉。已有报道[17-18]显示,CVC-RI发生率最高发生在股静脉,而最低发生在锁骨下静脉。因股静脉临近会阴部,周围皮肤寄生菌较多,易受到排泄物污染,且活动频繁、幅度大,更易引发感染。本研究中主要选取锁骨下及颈内静脉为穿刺部位,并进一步证实,在重症急性胰腺炎静脉置管患者中,行锁骨下入路感染率明显低于颈内静脉(P<0.05)。颈内静脉入路(相对于锁骨下入路)有较高感染率可能与口腔和气管造口部位污染的可能性增加(由于接近)有关。另外颈静脉周围存在皮肤皱褶,难以保持纱布敷料的适当位置。因此尽可能选取锁骨下静脉为首选穿刺部位,当由于皮肤烧伤、胸腹外伤、畸形等因素,选取股静脉为穿刺点时,必须保持穿刺点周边皮肤干燥、清洁,定期更换纱块,观察其渗透情况。相关研究显示[19],留置导管日≤1周感染率为6.9%,置管日1~2周感染率为7.5%,置管日> 3周感染率为38.9%,随着导管留置时间的延长,CVC-RI的发生率也随之升高,且以3周为临界点。本研究中,导管留置时间大多为3周内,置管日>3周者例数较少,其中以2~3周置管日感染率最高,且与<2周置管日相比差异有统计学意义。其机制可能与导管置入24 h后即会被纤维蛋白鞘包绕,纤维蛋白可以成为微生物进行繁殖的场所,随着留置时间延长,增加了病原菌等进入机体的机会。因此,原则上应缩短导管留置时间,当病情需要时,可通过更换导管的方式来降低CVC-RI的发生率。
综上所述,本研究结果表明,随着合并基础疾病、并发腹腔感染、置管时间的延长、导管部位选择等危险因素累积,CVC-RI的危险因素增加。通过规范性的操作步骤、优选锁骨下或颈内静脉为穿刺点、保持导管插入部位清洁、缩短置管天数等措施可预防导管感染。另外,对于行长期PN治疗患者,需计算每日营养入量、控制输液时间,输液完成后及时用生理盐水冲管,避免病原菌滋生。
