不同脂肪源对卵形鲳鲹肠道微生物菌群的影响
2020-01-17李秀玲刘宝锁朱克诚郭华阳江世贵张殿昌
李秀玲,刘宝锁,刘 波,张 楠,朱克诚,郭 梁,郭华阳,江世贵,张殿昌
( 1.中国水产科学研究院 南海水产研究所,农业农村部南海渔业资源开发利用重点实验室, 广东 广州 510300; 2.上海海洋大学 水产与生命学院,上海 201306; 3.广东省海洋生物种业工程技术研究中心,广东 广州 510300 )
卵形鲳鲹(Trachinotusovatus)是一种肉食性鱼类,主要捕食浮游动物、小型甲壳类、贝壳类和鱼类等[1]。鱼肉质鲜美,生长速度快,营养价值高,为优质的海水食用鱼类[2]。近年来,在中国和东南亚的一些国家,例如新加坡和马来西亚等国家对卵形鲳鲹的商业化养殖不断增加[3-4]。
肠道内栖息着数以万计的微生物,这些微生物有助于宿主的生长、消化、营养吸收、抵抗疾病和免疫调节等[5-6]。脂肪是三大营养素之一,在提供能量、必需脂肪酸和磷脂等方面发挥着重要作用[7]。许多研究表明,脂肪源可以影响肠道微生物的组成和多样性,而微生物也会参与脂质代谢。在哺乳动物中,肠道微生物参与脂质代谢,包括胆汁酸合成[8]、能量动态平衡[9]和脂质存储等。在凡纳滨对虾(Litopenaeusvannamei)中,饲料中的脂肪酸主要通过改变肠道微生物的分布影响其生长和免疫[10]。在斑马鱼(Daniorerio)中,肠道微生物调节肠道吸收和脂肪酸的代谢[11]。目前关于不同脂肪源对肠道微生物影响的研究还比较少,考虑到脂肪源和肠道微生物的关系及对宿主的影响,因此探究不同脂肪源对卵形鲳鲹肠道菌群的影响是非常有必要的。
肠道微生物的研究大体经历了3个阶段,培养依赖的方法阶段,非培养依赖的传统分子生物学方法阶段和基于测序的高通量组学方法阶段[12]。传统培养的方式只能检测到约1%~10%的微生物群落,这种方法虽然能够快速有效地自环境样品中提取大部分脂肪酸,但受人为因素干扰强烈[13],费时费力。高通量测序技术能够为快速准确的基因组测序提供平台,大大降低了成本、时间[14],已经成为微生物多样性研究的主要方法[15-16]。本研究基于16S rDNA高通量测序技术,旨在探讨不同脂肪源对卵形鲳鲹肠道微生物菌群的影响,以期能够为卵形鲳鲹确定合适的脂肪源和健康养殖提供理论基础。
1 材料与方法
1.1 试验饲料
共配制8种等氮等能的饲料,除脂肪源不同其他饲料原料和用量都相同,8种脂肪源分别为鱼油、磷虾油、豆油、玉米油、1∶1鱼油—豆油、1∶1鱼油—玉米油、1∶1磷虾油—豆油和1∶1磷虾油—玉米油。饲料配方见表1,试验饲料脂肪酸组成见表2。所有饲料原料过40目筛,原料混匀后依次加入脂肪源和水,经过制粒机(华南理工大学)制成2.5 mm的沉性饲料颗粒,密封于4 ℃备用。
1.2 试验材料和试验设计
640尾规格均一、体质健康的卵形鲳鲹[体质量(82.85±2.36) g]采自中国南海水产研究所海南热带水产研究开发中心,随机放入32个1.0 m×1.0 m×1.5 m网箱中,每个网箱20尾鱼,随机分成8组,每组4个平行,分别投喂8组试验饲料。饲养8周,日饱食投喂2次(7:00,16:00)。试验期间,盐度约35,海水温度27~31 ℃,pH 7.5~8.2,溶解氧>5 mg/L。
1.3 样品采集和DNA提取
试验结束后,将鱼饥饿24 h,每个网箱随机挑选3尾卵形鲳鲹,在低温下解剖取出肠道样品,剔除脂肪组织,放入液氮后于-80 ℃保存。
按照天根DNA试剂盒[天根(北京)生化科技有限公司]说明书提取卵形鲳鲹肠道细菌总DNA,用1.5%琼脂糖凝胶电泳检测DNA的质量,利用Nanodrop2000检测DNA的含量。
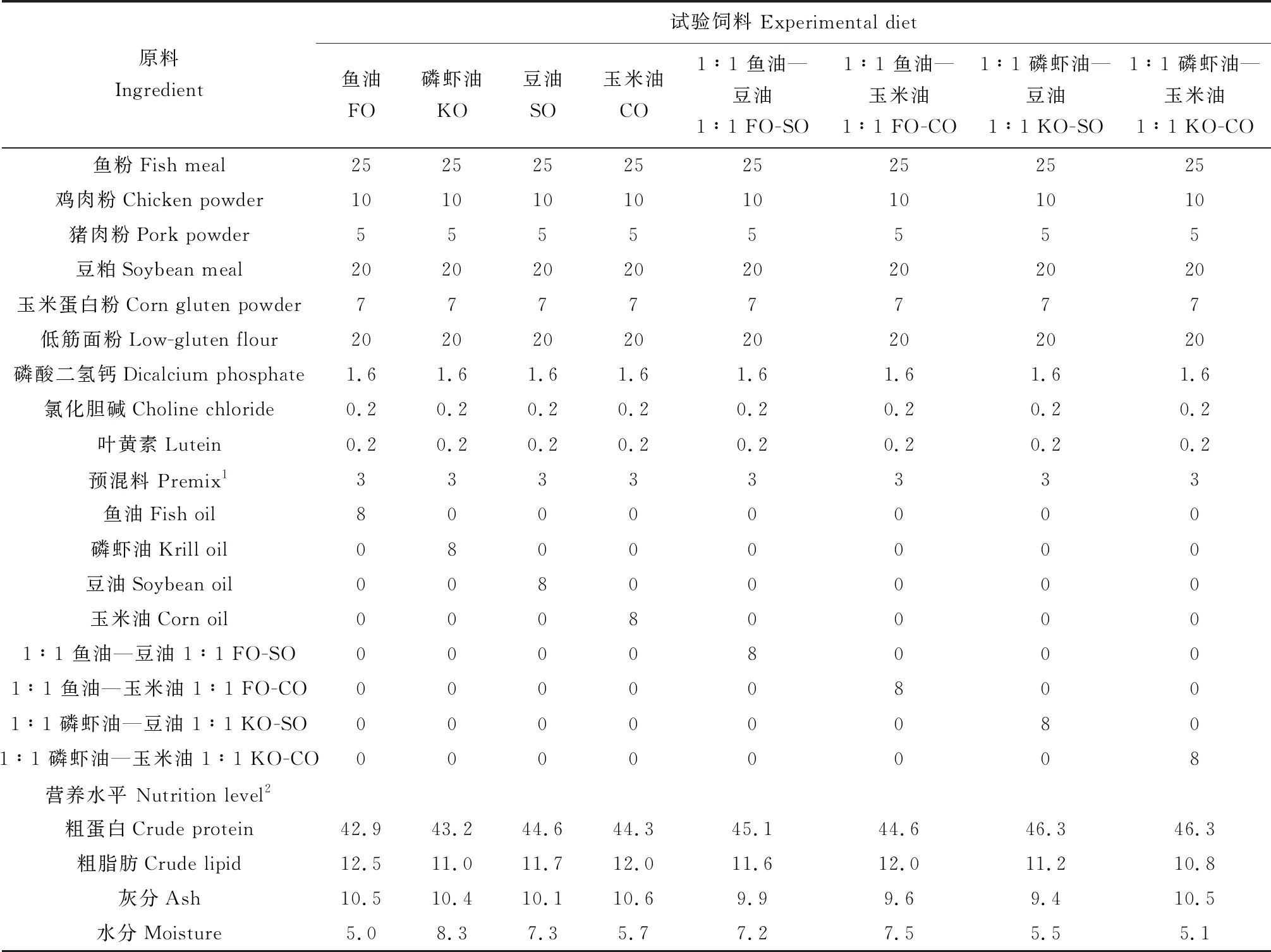
表1 试验饲料原料及营养组成(干质量) %Tab.1 Ingredients and proximate composition of the experimental diets (dry weight)
注:1.预混料(联鲲生物科技有限公司)为每千克日粮提供维生素、微量元素和抗氧化剂: 维生素A(375 000 IU) 119.81 mg,维生素D3(77 000 IU) 1.925 mg,维生素E 3000 mg,维生素K3930 mg,维生素B1600 mg,维生素B2600 mg,叶酸 185 mg, 维生素D 7.5 mg, 肌醇 4500 mg, 锌 1750 mg, 锰 1100 mg, 铜 410 mg, 铁 1300 mg, 钴 60 mg, 碘 50 mg, 硒 15 mg. Premix (Guangzhou Nutriera Biotechnology Co, Ltd) provides vitamins, trace elements and antioxidants per kg diet: vitamin A (375 000 IU) 119.81 mg, vitamin D3(77 000 IU) 1.925 mg, vitamin E 3000 mg, vitamin K3930 mg, vitamin B1600 mg, vitamin B2600 mg, folic acid 185 mg, vitamin D 7.5 mg, inositol 4500 mg, zinc 1750 mg, manganese 1100 mg, copper 410 mg, Fe 1300 mg,Co 60 mg, I 500 mg, and Se 15 mg.
2.营养水平为实测值. Nutritional level is measured.
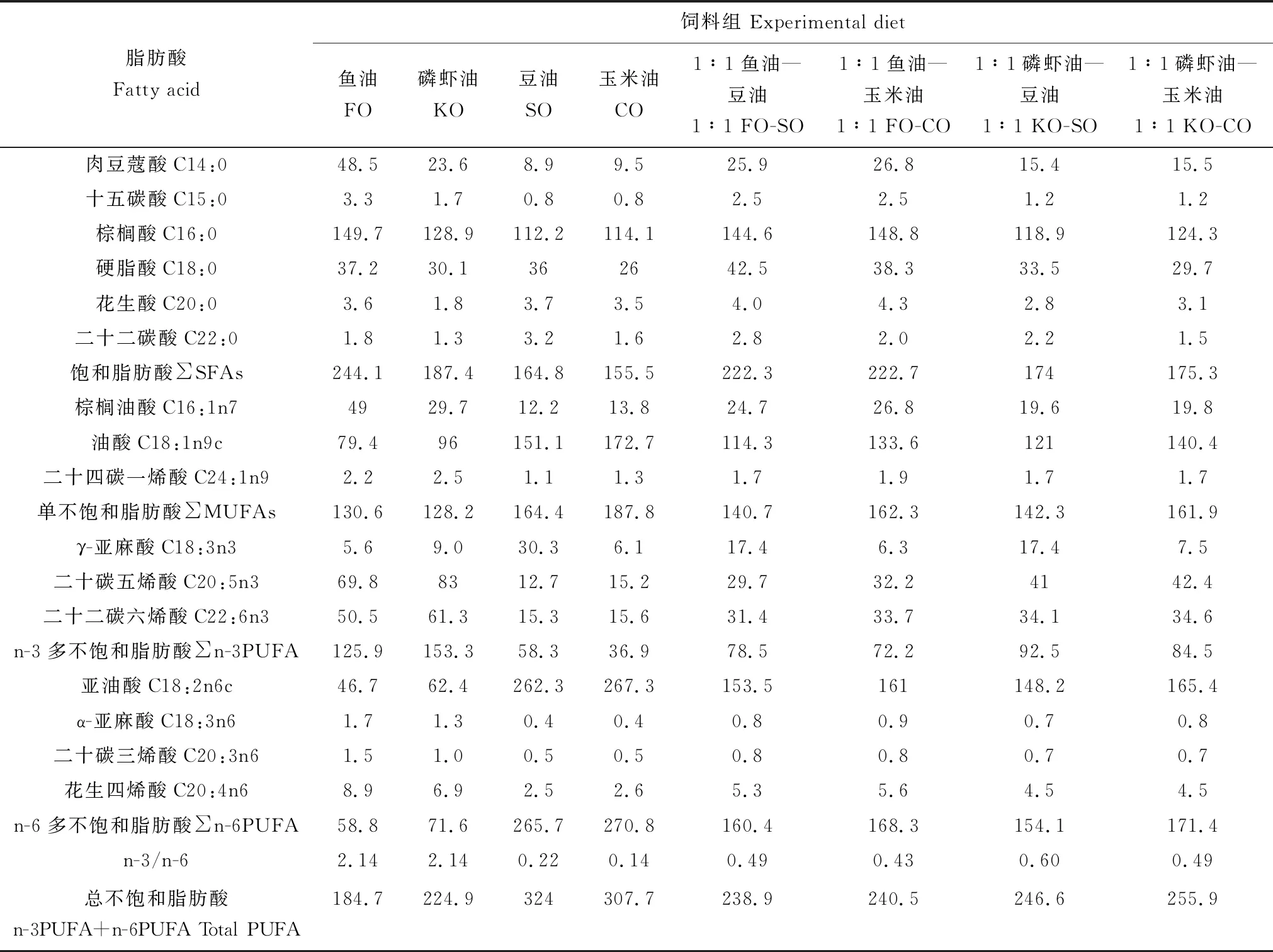
表2 试验饲料脂肪酸组成 g/kgTab.2 Fatty acid composition of the experimental diets
1.4 PCR扩增
用515F:5′-GTGCCAGCMGCCGCGG-3′和907R:5′-CCGTCAATTCMTTTRAGTTT-3′引物对细菌16S rDNA V4~V5可变区进行PCR扩增[17]。PCR采用PrimeSTAR HS DNA Polymerase,20 μL反应体系:10 μL的5×PrimeSTAR Buffer (Mg2+Plus)、4 μL的dNTP Mixture (2.5 mmol/L)、0.5 μL的PrimeSTAR HS DNA Polymerase、1 μL的正向引物(5 μmol/L),1 μL的反向引物(5 μmol/L) 和10 ng 的DNA模板、ddH2O补足20 μL。PCR反应条件为:98 ℃预变性1 min;98 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环27次;72 ℃延伸5 min。使用AxyPrepTMDNA 凝胶回收试剂盒纯化PCR产物,在本试验中30 ng的PCR纯化产物用来进行基于illumina平台的高通量测序。
1.5 序列分析
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,截去Barcode序列和引物序列,对样品的reads进行拼接,得到的拼接序列为原始Tags数据。Raw Tags经过滤操作,去掉低质量、不符合长度的Tag以及嵌合体,得到高质量的Tags数据。
得到Tags数据后,一方面对每个运算分类单元的代表序列做物种注释,得到对应的物种注释信息和基于物种的丰度分布情况。另一方面,对运算分类单元进行丰度、Alpha多样性分析和Beta多样性分析,得到样品内物种丰富度和均匀度信息,获得不同样品和分组的群落结构差异信息。
利用QIIME (v1.7.0)计算Alpha多样性(ACE指数、chao1指数、香农—威纳指数、辛普森指数)指数和Beta多样性(主坐标分析和主成分分析),利用R软件(v2.15.3)绘制稀释曲线。试验数据采用平均值±标准误表示,采用SPSS 22.0对数据进行单因素方差分析,若差异达到显著水平,则采用Tukey′s进行多重比较,显著水平为0.05。
2 结 果
2.1 序列分析
经过组装、质量筛选和修饰后,在卵形鲳鲹肠道中共获得1 087 662个序列,每个样品平均获得45 319个序列(2 998~58 918)。在所有试验组中,运算分类单元稀释曲线趋于平缓,表明测序深度已基本覆盖到样品中所有的物种(图1)。
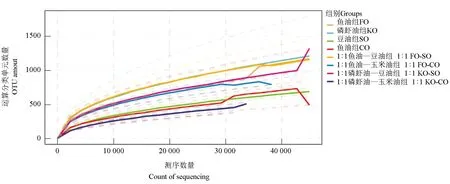
图1 卵形鲳鲹肠道微生物稀释曲线Fig.1 Rarefaction curve of intestinal microbiota in golden pompano T. ovatus
2.2 Alpha多样性分析
卵形鲳鲹肠道菌群Alpha多样性指数见表3。Chao1和ACE指数反映群落丰富度,数值越大,表明群落的丰富度越高。香农—威纳指数和辛普森多样性指数反映群落的多样性,数值越大,表明群落的多样性越高。Alpha多样性结果显示,磷虾油组的ACE和Chao1指数显著高于1∶1磷虾油—玉米油组(P<0.05),其他组之间没有显著性差异(P>0.05)。香农—威纳指数在1∶1鱼油—豆油组中显著高于豆油和1∶1磷虾油—玉米油组(P<0.05)。辛普森多样性指数在磷虾油、1∶1鱼油—豆油和1∶1磷虾油—豆油组中显著高于豆油和1∶1磷虾油—玉米油组 (P<0.05),其他组之间没有显著差异(P>0.05)。
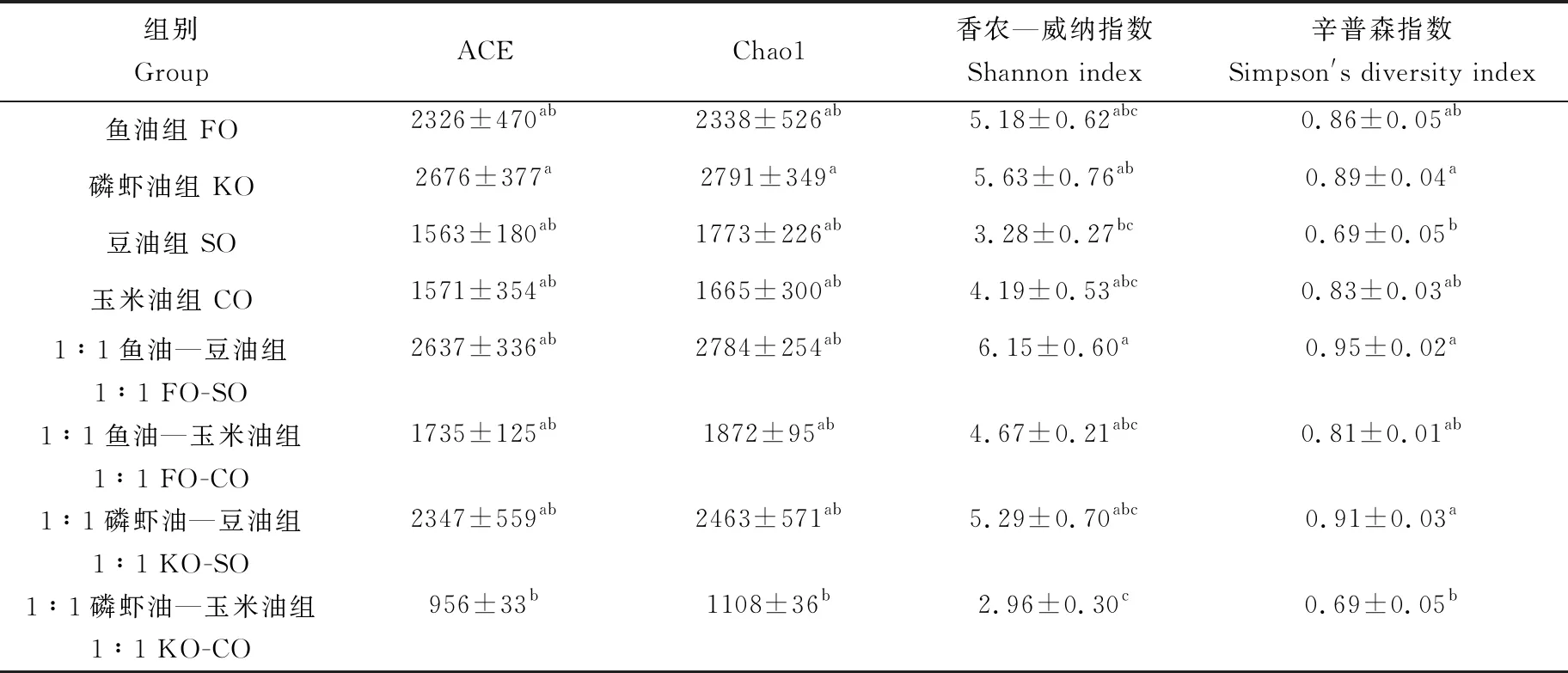
表3 卵形鲳鲹肠道微生物Alpha多样性指数Tab.3 Intestinal microbial Alpha diversity index in golden pompano T. ovatus
注:同行数据不同小写字母表示差异显著(P<0.05).
Note: means with different letters in the same line are significant difference (P<0.05).
2.3 肠道菌群组成及其相对丰度分析
肠道菌群在卵形鲳鲹中的组成见图2。在所有组中的肠道菌群中注释到4个门水平上的菌群,包括拟杆菌门、厚壁菌门、变形菌门和软壁菌门,变形菌门丰度最高。在鱼油组、磷虾油组、玉米油组、1∶1鱼油—豆油组、1∶1磷虾油—豆油组和1∶1磷虾油—玉米油组组中变形菌门为优势菌群,在豆油组和1∶1鱼油—玉米油组中软壁菌门为优势菌群。
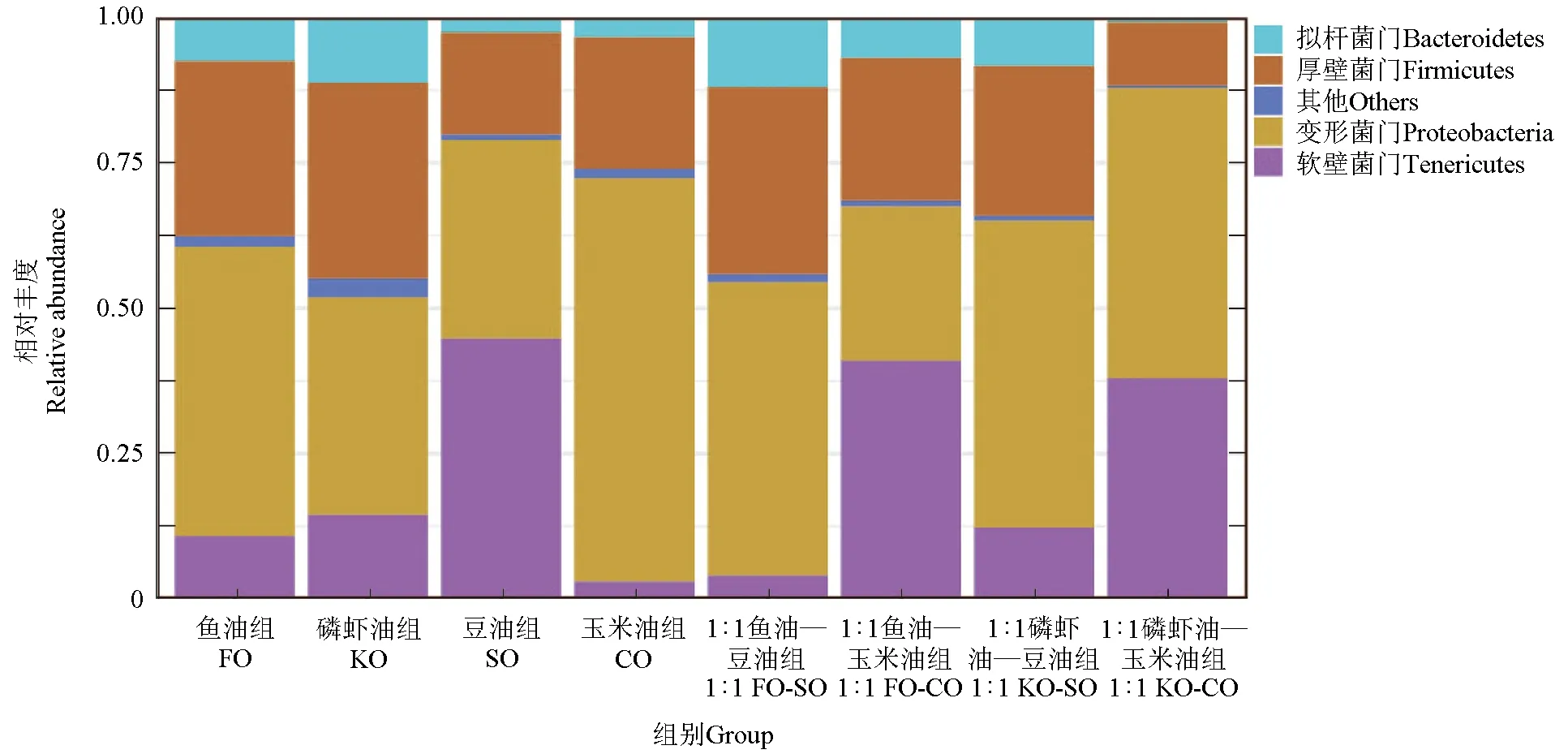
图2 卵形鲳鲹肠道微生物在门水平上的相对丰度聚类堆叠图Fig.2 Bacterial relative abundance in intestine of gdden powpano T. ovatus at the Phylum level
2.4 Beta多样性分析
主坐标分析是将进化结构中聚类相近的物种组合在一起,聚在一起的样品是物种进化程度方面较为类似的样品。主成分分析是将分布较为类似的物种组合在一起,聚在一起的样品是在物种组成方面较为类似的样品。卵形鲳鲹肠道微生物主坐标分析结果(图3)表明,在卵形鲳鲹肠道中微生物没有聚集,亲缘关系较远,且受脂肪源影响较大。卵形鲳鲹肠道微生物主成分分析结果(图4)表明,不同组间距离较远脂肪源对卵形鲳鲹肠道微生物菌群结构具有显著影响,组间物种组成方面差异较大。
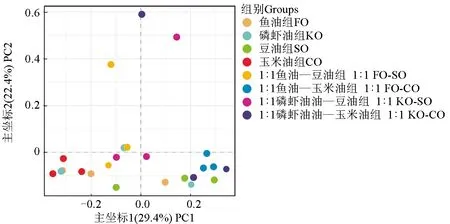
图3 卵形鲳鲹肠道微生物主坐标分析Fig.3 Principal co-ordinates analysis of intestinal microbiota in golden pompano T. ovatus
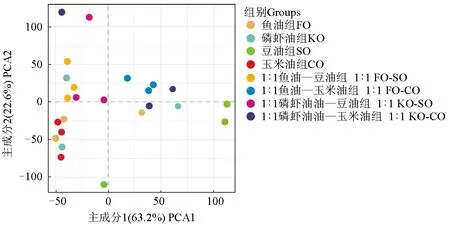
图4 卵形鲳鲹肠道微生物主成分分析Fig.4 Principal component analysis of intestinal microbiota in golden pompano T. ovatus
3 讨 论
由于肠道微生物在宿主营养吸收和分解中起着重要的作用[18-19],因此肠道微生物和宿主的关系越来越受到关注。Han等[20]发现,肠道微生物来源于环境,且受遗传背景和食物等因素的影响。基于肠道微生物在脂肪的吸收和分解方面发挥的重要作用,本研究利用Illuniana 16S rDNA高通量测序分析不同脂肪源对卵形鲳鲹肠道菌群的影响。
3.1 Alpha多样性和Beta多样性分析
本研究主要采用Alpha多样性分析和Beta多样性分析对卵形鲳鲹肠道微生物群落进行分析。Alpha多样性反映丰富度和均匀度的综合指标,Alpha多样性指数包括菌群丰度(Chao1、ACE指数和运算分类单元)和菌群多样性(香农—威纳指数和辛普森多样性指数)。试验结果表明,饲料中脂肪源类型能够调节肠道微生物的多样性和丰富度。磷虾油含有丰富的n-3多不饱和脂肪酸,包括二十碳五烯酸和二十二碳六烯酸[21-22],并且在抗氧化、抗高血脂等方面起着关键作用。得益于磷虾油产生的有益影响,磷虾油组肠道中更有利于微生物的聚集;同时,由于磷虾油组中的丰富n-3多不饱和脂肪酸,肠道微生物尤其是变形菌可能更有助于对其分解利用。1∶1磷虾油—玉米油是磷虾油和玉米油的混合物,玉米油富含丰富的n-6和n-9多不饱和脂肪酸,磷虾油和玉米油的混合物使得肠道内微生物的丰富度和多样性显著下降,这可能说明两者的混合物不利于肠道微生物的生存。
3.2 肠道菌群组成及其相对丰度分析
测序结果表明,在卵形鲳鲹肠道中主要有拟杆菌门、厚壁菌门、变形菌门和软壁菌门4种菌群,且变形菌是优势菌群,这与许多研究结果是一致的[23-24]。研究发现,变形菌在斑马鱼[25]、草鱼(Ctenopharyngodonidellus)[26]和大黄鱼(Pseudosciaenacrocea)[21]等鱼类中是优势菌群,而拟杆菌门、厚壁菌门在人和小鼠肠道中是优势菌群。在不同研究中,不同物种的肠道微生物的组成和丰度确实存在很大差异,这可能与物种种类和环境有关。在本试验中,8组饲料除脂肪源种类不同外其他原料组成都是相同的,因此脂肪源种类是决定优势菌群的主要因素。拟杆菌的主要功能是帮助宿主降解碳水化合物(尤其是多糖)、蛋白质和其他物质,以提高宿主的营养利用率,厚壁菌有助于膳食纤维的降解,并将纤维降解为挥发性脂肪酸以供宿主利用[27]。本研究结果表明,豆油和1∶1鱼油—玉米油有益于软壁菌的生长,而其他脂肪源有益于变形菌的生长。据报道,中国沿海地区水产养殖区水域中变形菌门为主要优势菌[28],这表明,卵形鲳鲹肠道微生物组成与水体微生物组成有很大的相似性。在本研究中,变形菌和软壁菌可能与脂肪酸代谢有关。从脂肪酸组成来看,豆油和1∶1鱼油—玉米油组含有中等水平的单不饱和脂肪酸,推测可能中等水平的单不饱和脂肪酸有利于软壁菌的生长,而软壁菌可能有利于其代谢。关于微生物与脂肪源种类之间的关系还需要进一步探讨。
3.3 主坐标分析和主成分分析
主坐标分析和主成分分析表明,脂肪源显著影响肠道菌群,且不同脂肪源之间肠道菌落构成差异显著,表明脂肪源在调节肠道菌群中发挥着重要的作用。有研究显示,食物来源和宿主的发育系统是导致肠道微生物菌群差异的两个重要因素[29-30],在本试验中饲料成分可能是导致肠道菌群差异的最重要因素。由主坐标分析和主成分分析图可见,1∶1鱼油—玉米油组和1∶1磷虾油—玉米油组聚在一起,这表明两组在物种进化方面和物种组成方面较为类似,这可能与饲料中的多不饱和脂肪酸含量和种类有关。
利用16S rDNA测序技术对卵形鲳鲹肠道微生物多样性进行分析,结果表明,饲喂磷虾油和1∶1磷虾油—豆油的鱼具有较高的肠道微生物多样性,且不同脂肪源对肠道微生物多样性影响显著,这些结果对促进卵形鲳鲹生长和确定合适脂肪源具有重要的指导意义。
