仿刺参MyD88依赖途径基因的序列比较和表达分析
2020-01-17孙红娟郑智亮王际辉周遵春
孙红娟,郑智亮,王际辉,周遵春
( 1.辽宁省海洋水产科学研究院,辽宁省海洋水产分子生物学重点试验室,辽宁 大连 116023; 2.大连工业大学 生物工程学院,辽宁 大连 116034 )
Toll样受体(Toll-like receptor, TLR)作为先天性免疫系统中最古老的模式识别受体(pattern recognition receptors,PRR),由胞外区(ectodomain, ECD)、跨膜区(transmembrane, TM)和胞内区(Toll/interleukin-1 receptor, TIR)3部分组成[1]。在Toll样受体信号通路中,接头蛋白发挥着开启并调控信号传导的重要作用。髓样分化因子(myeloid differentiation factor 88, MyD88)作为Toll样受体信号通路中一个关键的接头分子,通过死亡结构域(death domain, DD)募集白细胞介素受体相关激酶(interleukin-1 receptor-associated kinases, IRAKs)。肿瘤坏死因子受体相关因子6 (tumor necrosis factor receptor-associated factor 6, TRAF6)通过穿膜肽酶和肿瘤坏死因子受体相关因子同源区(meprin and TRAF homology, MATH)与上游白细胞介素受体相关激酶结合后被激活,随后激活细胞核因子κB(nuclear factor κB, NFκB)抑制蛋白激酶(IκB kinase, IKK)复合物导致IκB的磷酸化和降解,最终诱导NFκB的转位和炎症因子的表达[2]。
仿刺参(Apostichopusjaponicus)作为世界上重要的水产养殖经济物种,主要分布在中国、俄罗斯、日本以及朝鲜[3]。腐皮综合征是仿刺参养殖过程中最为严重的流行性疾病,目前已经鉴定到的致病原包括细菌、寄生虫和病毒等,灿烂弧菌(Vibriosplendidus)为仿刺参腐皮综合征的细菌性致病原,针对它刺激后仿刺参体内免疫应答机制的研究成为当前的热点[4-8]。仿刺参作为无脊椎动物,主要依赖先天性免疫系统来应对病原菌的入侵。通过MyD88介导的Toll样受体信号通路(MyD88依赖途径)所识别配体主要是细菌的细胞膜成分。因此,笔者选择灿烂弧菌进行免疫刺激试验。目前已经报道的仿刺参Toll样受体信号通路相关基因有Toll、TLR3、MyD88、TRAF6、TRAF3、IRAK4、P105和Rel[9-14]。除了TLR3和TRAF3之外,其他6个基因均参与MyD88依赖途径。
笔者通过生物信息学的方法探索TLR信号通路上6个基因的氨基酸序列保守结构域,找到其互作位点。采用实时荧光定量PCR(qRT-PCR)方法检测体腔细胞中这6个基因在受到灿烂弧菌刺激后的表达调控模式,探索仿刺参TLR信号通路分子如何参与信号传导,为阐释仿刺参的免疫调控机制以及病害防治奠定理论基础。
1 材料与方法
1.1 基因结构分析
仿刺参MyD88依赖途径上6个基因的信息见表1。提取这6个基因的开放阅读框,翻译成氨基酸序列,找到保守结构域,对基因间的互作位点进行分析[9-14]。
1.2 免疫刺激试验
1.2.1 材料
试验采用的体质量(12.0±1.5) g健康仿刺参取自辽宁省海洋水产科学研究院引育种中心。在实验室暂养7 d,控制水温(16±1) ℃,pH 8.6±0.1,盐度31。免疫刺激试验使用的灿烂弧菌为在2216E培养基中,于温度28 ℃、150 r/min的条件下培养的。当灿烂弧菌密度达到108cfu/mL时,进行免疫刺激试验。
1.2.2 方法
将120头健康的仿刺参平均分为对照组与菌刺激组。采用灭菌注射器对仿刺参进行体腔注射,对照组注射灭菌海水100 μL/头,试验组注射菌液100 μL/头。注射4、12、24 h和48 h后分别用灭菌注射器取体腔液5 mL/头,每组每个时间点随机选取15个,并随机分成3份,样品混合后在4 ℃、3000 r/min的条件下离心10 min,收集沉淀的体腔细胞。
使用RNAprep pure Tissue (TIANGEN BIOTECH)试剂盒提取体腔细胞的总RNA,采用NanoPhotometer (Implen GmbH)测量其含量,随后采用琼脂糖凝胶电泳检测完整性。样品合格后,使用PrimeScriptTMRT Master Mix (Perfect Real Time)试剂盒进行反转录,加入5×PrimeScript RT Master Mix 4 μL,反转录RNA的总量不超过900 ng,添加RNase Free dH2O至20 μL。反应条件为:37 ℃ 5 min,85 ℃ 5 s。经过反转录后获得的cDNA样品保存在-20 ℃,用于qRT-PCR试验。
使用TB GreenTMPremix Ex TaqTM(TliRNaseH Plus)试剂盒对TLR信号通路的6个基因进行qRT-PCR,以Cytb作为内参基因[15],具体信息见表2。反应体系:ROX Reference Dye Ⅱ (50×) 0.4 μL,cDNA 模板1 μL,TB Green Premix Ex Taq (TliRNaseH Plus) (2×Conc.)10 μL,正反引物各0.8 μL,dH2O 7 μL。qRT-PCR反应程序:95 ℃ 30 s;40个循环:95 ℃ 10 s,55 ℃ 40 s,72 ℃ 25 s。每个反应重复3次。
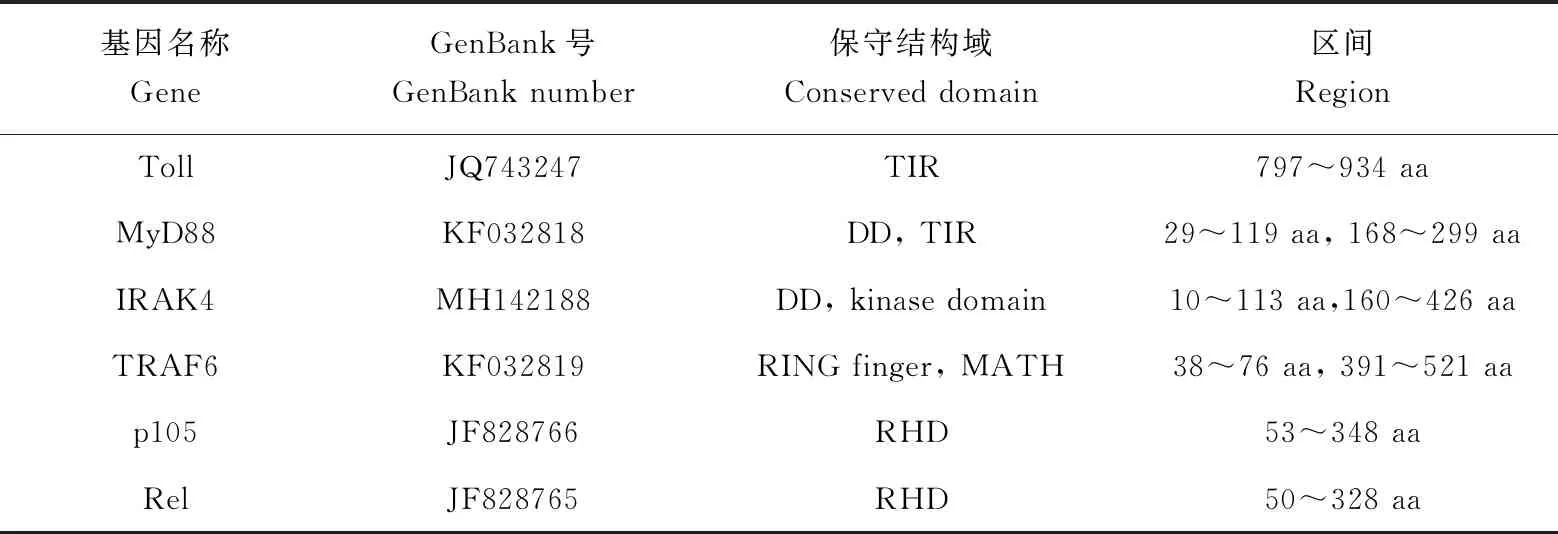
表1 仿刺参TLR信号通路基因信息Tab.1 Information on TLR signaling pathway genes in sea cucumber A. japonicus
注:aa代表氨基酸. Notes:aa stands for amino acids.

表2 仿刺参TLR信号通路基因引物信息Tab.2 Primer information on TLR signaling pathway genes in sea cucumber A. japonicus
1.2.3 数据统计与分析
根据qRT-PCR所获取的Ct值,使用软件REST 384 v.2 (Relative Expression Software Tool,REST)进行分析,试验组与对照组间发生的表达变化采用随机配对检验分析法计算得到[16]。相对表达量选取平均值±标准误的方式表示。当P<0.05时,表明具有显著差异。采用Pearson相关系数R对不同基因间表达水平的相关性进行分析。
2 结果与分析
2.1 Toll样受体信号通路基因序列比对
Toll样受体通过胞内区与接头分子MyD88连接,MyD88通过死亡结构域募集IRAK4[12],IRAK4的激酶区和TRAF6的穿膜肽酶和肿瘤坏死因子受体相关因子同源区相互作用来激活TRAF6,TRAF6序列中的指环区能使NFκB活化,Rel和P105之间的互作发生在Rel同源区。因此将Toll样受体和MyD88的胞内区,MyD88和IRAK4的死亡结构域,IRAK4的激酶区和TRAF6的穿膜肽酶及肿瘤坏死因子受体相关因子同源区,TRAF6的指环区,P105和Rel的Rel同源区的氨基酸序列进行比对分析,结果见图1。
Toll和MyD88的胞内区序列比对结果发现了白介素受体家族中3个高度保守的区域:box 1,F/YDA;box 2,RDXXPG;box 3,FW[17]。预测到MyD88死亡结构域中和IRAK4结合位点是R49、L51、A54、D56、E62、T68、I71、Q72、E107、E109、D110、E113和D114。在IRAK4的激酶区同样也存在1个保守结构域RVSIATAAAKGINFLHEMK,预测到的ATP结合位点为I167、G170、G173、V175、A187、K189、I222、L236、I239、K285、I289、L290、D292、F302和G303。在TRAF6的穿膜肽酶和肿瘤坏死因子受体相关因子同源区发现了1个高度保守的区域RVNINATDSIRGAYISLFVHFMK,预测到3个亚基结合位点F448、G509和G511。在TRAF6的指环结合区存在1个保守结构域CX2C-X(9-39)-C-X(1-3)-H-X(2-3)-(N/C/H)-X2-C-X(4-48)C-X2-C。在P105和Rel的Rel同源区均存在保守的DNA结合位点,分别为R67、R69、Y70、C72、E73、P75、G78、H154、T156、R157、K239,R64、R66、Y67、C69、E70、R72、G75、C151、K153、K154、K223。
2.2 灿烂弧菌刺激后基因的表达变化
对照组经过灭菌海水刺激后,Toll样受体信号途径基因在不同时间点表达差异不显著。在灿烂弧菌刺激组,Toll基因除了在12 h表达小幅上调外,其他时间点表达都是显著下调(图2a)。MyD88在4 h和12 h时表达显著上调,并在12 h达到最高点,在24 h表达下调,48 h又恢复表达上调状态(图2b)。IRAK4在4 h时表达显著下调,12 h时表达均上调达到最高点,随后表达逐渐恢复至初始状态(图2c)。TRAF6在4 h表达上调,12 h表达显著上调并达到最高点,在24 h表达基本恢复至初始状态(图2d)。P105在12 h和48 h表达显著上调,在其他时间点表达下调(图2e)。Rel在4 h表达显著下调,12 h表达上调但是不显著,在48 h后表达趋于稳定恢复到初始水平(图2f)。
根据免疫刺激后基因的表达水平对发生互作基因之间的相关性进行分析,Toll和MyD88,MyD88和IRAK4,IRAK4和TRAF6,Rel和P105之间呈显著正相关,相关系数R均大于95%(表3)。
3 讨 论
第一个Toll样受体是在果蝇(Drosophilamelanogaster)中被发现的,随后在脊椎动物和无脊椎动物体内也发现了大量Toll样受体[18-19]。越来越多的证据表明,从果蝇到人类存在着一条典型的Toll样受体信号通路并且信号通路中的分子均高度保守[20]。随着基因组层面分子技术的不断发展,在海洋无脊椎动物紫海胆(Strongylocentrotuspurpuratus)[21]、凡纳滨对虾(Litopenaeusvannamei)[22]、中国明对虾(Fenneropenaeuschinensis)[23]、日本囊对虾(Marsupenaeusjaponicas)[24],长牡蛎(Crassostreagigas)[25],栉孔扇贝(Chlamysfarreri)[26-27],夏威夷短尾乌贼(Euprymnascolopes)[28]体内均发现了Toll样受体信号通路相关基因,并且被证实参与了免疫应答过程。笔者筛选了仿刺参Toll样受体信号通路中MyD88依赖途径上的6个基因,探索该通路上下游分子间如何进行信号传递和免疫应答。
3.1 MyD88依赖途径基因的保守结构域
通过对Toll样受体信号通路基因保守结构域的比对分析,找到了基因间以及和其他分子间的互作位点。Toll样受体通过胞内区的保守结构域与接头分子互作来进行信号传递。MyD88作为Toll样受体信号通路的关键接头分子,可以介导凋亡反应和转录因子的激活。对Toll和MyD88的胞内区进行比对,找到了3个高度保守的结构域:box 1,F/YDA;box 2,RDXXPG;box 3,FW。MyD88通过死亡结构域来募集IRAK4[29],经过比对找到了13个MyD88和IRAK4的结合位点。IRAK4是通过激酶区来激活TRAF6,在激酶区共预测到15个ATP结合位点,和其他物种激酶区的比对分析找到了ATP结合的保守区域(IGEGGFGTVFLGYFRDGTKCAVK)以及丝氨酸/苏氨酸蛋白激酶活化区(YVHRDIKSANILL)[11]。其中ATP结合位点K189和丝氨酸/苏氨酸蛋白激酶活化位点D285是高度保守存在,表明仿刺参IRAK4是一个活性激酶[30]。通过Rel和P105的Rel同源区的氨基酸序列进行比对分析,均找到了11个保守的DNA结合位点。免疫共沉淀试验证明,在Rel和P105之间确实存在着相互作用,并且作用区域位于Rel同源区内[12]。

图1 Toll样受体信号通路基因序列比较Fig.1 Sequences comparison of genes in TLR signaling pathway

图2 灿烂弧菌刺激后仿刺参体腔细胞中Toll样受体信号通路基因的表达变化Fig.2 Changes in expression of TLR signaling pathway genes in sea cucumber A. japonicus of subjected to V. splendidus infection *.差异显著(P<0.05). *.significant difference (P<0.05).
表3仿刺参Toll样受体信号通路基因表达相关性分析

Tab.3 Correlation analysis of TLR signaling pathway genes in sea cucumber A. japonicus
3.2 MyD88依赖途径基因的免疫应答
为了进一步探索仿刺参Toll样受体信号通路基因如何进行信号传导,笔者对免疫刺激后基因的表达水平进行了分析。Toll样受体在受到灿烂弧菌刺激后表达变化水平要低于信号通路中其他5个基因。在栉孔扇贝Toll样受体信号通路5个基因受到脂多糖刺激后,TLR的表达变化水平也显著低于信号通路另外4个基因[27]。前期的研究证实,仿刺参和玉足海参(Holothurialeucospilota)中的MyD88都可以介导Toll样受体信号通路并且激活转录因子NFκB[11,31]。仿刺参体腔细胞MyD88受到灿烂弧菌刺激后,在6 h表达上调了约2倍,在48 h开始就恢复到了初始状态[10]。本研究中,仿刺参受到灿烂弧菌刺激4 h,MyD88表达上调了2倍,在12 h达到最高点,在48 h表达水平仍处于上调状态。这可能与灿烂弧菌刺激方式有关,Lu等[10]将灿烂弧菌注入养殖水体中对仿刺参进行免疫刺激,而本研究采用体腔注射方式对仿刺参进行免疫刺激,免疫应答持续时间相对较长。
IRAKs在MyD88和TRAF6分子之间起连接作用,操控Toll样受体信号通路下游信号的传递。IRAK4不同于IRAK家族中其他成员,它具有激酶活性可以使下游的分子发生磷酸化促进信号的传递,最终激活转录因子NFκB[32]。Cui等[11]研究发现,仿刺参体腔细胞IRAK4受到灿烂弧菌和脂多糖刺激后,表达发生了显著上调。本研究IRAK4在灿烂弧菌刺激12 h表达上调,在48 h恢复到初始状态。这两个研究均表明,IRAK4参与了体腔细胞Toll样受体信号通路的免疫应答。TRAF6可以作为桥梁来连接上游的TLRs、MyD88、IRAK4和下游的NFκB信号途径。在前期的研究中发现仿刺参受到灿烂弧菌刺激后,体腔细胞TRAF6的表达上调幅度要比MyD88大,并且持续时间长[10]。在本研究中,TRAF6和MyD88表达模式基本一致,在12 h表达达到最高点,随后表达水平降低。NFκB是先天性免疫系统中高度保守的分子,在生长发育、凋亡、炎症反应、免疫应答过程中发挥着重要作用。NFκB家族是由多个亚基组成,不同亚基之间可以形成二聚体,促进DNA的结合[33]。仿刺参体内鉴定到的P105和Rel是NFκB的两个同源物,具有相似的Rel同源结构域。系统进化发现这两个基因也是聚类在同一个分支中[12]。在本研究结果中发现,这两个基因在免疫刺激后,表达模式相似,共同参与了转录因子的免疫应答。
通过对Toll样受体信号通路Toll、MyD88、IRAK4、TRAF6、P105和Rel互作位点和保守结构域的比对分析,证明在仿刺参体内存在一条保守的Toll样受体信号通路。进行免疫刺激后,该通路的基因之间协同合作参与机体免疫应答。研究结果为揭示仿刺参体腔细胞的免疫应答机制提供参考,同时为病害的防治提供了理论依据。
