R2O-CaO-Al2O3-B2O3-SiO2-P2O5玻璃的制备及性能
2020-01-17赵凯,王元泽,张学正,张晶晶,王志强
赵 凯, 王 元 泽, 张 学 正, 张 晶 晶, 王 志 强
( 大连工业大学 纺织与材料工程学院, 辽宁 大连 116034 )
0 引 言
乳浊玻璃广泛应用于装饰、器皿、建筑、电子元器件、玻璃仪器、照明器材、电光源等领域[1-2]。传统的乳浊玻璃生产方式是加入氧化物或者氟化物作为乳浊剂,氟化物不仅严重侵蚀窑炉耐火材料缩短窑炉寿命,造成的氟挥发还会严重污染环境,所以解决这一问题的关键是对无氟乳浊玻璃进行研究[3]。对无氟乳浊玻璃的研究,其中主要包括温度制度[4],组分对玻璃性能的改变,比如乳浊度、白度、透过率、抗折强度、密度、热膨胀系数,以及玻璃相等性能的变化[5]。关于硼硅酸盐的相分离机理[6]、显微结构[7]和性能的组成[8]和热处理条件[9]的研究已有很多报道,但由于乳浊玻璃熔炼温度过高,达1 600 ℃,无论是能耗还是耐火材料的侵蚀都直接制约了这一系列玻璃的商业应用[10]。
磷酸盐乳浊玻璃是具有潜在应用前景的研究方向之一。Ku等[11]研究了温度制度对用于LED灯的半乳浊玻璃的影响,为低膨胀乳浊玻璃做出巨大贡献。Vogel[12]对磷酸盐乳浊进行了一系列的研究,发现在基础玻璃中引入P2O5后,在玻璃液的冷却过程中会出现液滴相。汪庆卫等[13]通过改变钠镁硅系列乳浊玻璃中P2O5/CaO质量比,分析玻璃的析晶情况以及微观结构和物化性能的变化。但是目前市场对于乳浊玻璃的热膨胀系数、显微硬度和化学稳定性等性能有较高的要求[13]。
为了研究磷酸盐作为乳浊剂的乳浊玻璃及其热膨胀系数、显微硬度、化学稳定性和特征温度随组成的变化规律,确定乳浊程度随组成的变化规律,本研究制备了低膨胀系数、高硬度、化学稳定性优良、可以用作陶瓷釉料的乳浊玻璃。
1 实 验
1.1 样品的制备
采用传统的熔融冷却法制备R2O-CaO-Al2O3-B2O3-SiO2-P2O5多元系统乳浊玻璃,研究Na2O与MgO-CaO的相对含量对乳浊程度的影响。玻璃组成如表1所示。

表1 实验方案配方
配合料的制备:所使用原料为SiO2、H3BO3、Al2O3、CaCO3、MgCO3、ZnO、Na2CO3、Li2CO3、BaCO3、CaHPO4等,均为分析纯。按照设计组成计算各种原料用量,称取各种原料然后研磨混合均匀。
玻璃熔制:将混合均匀的配合料放入刚玉坩埚中,在升降式硅钼棒高温电炉中熔制。玻璃的熔制温度为1 450 ℃,保温2 h。熔制好的玻璃倒入预热好的石墨模具中成型,然后置于马弗炉中退火,依据组成不同退火温度为580~630 ℃,保温30 min后随炉冷却。
1.2 样品的测试
采用傅里叶变化红外光谱仪(PE,model spectrum One-B)测定样品的红外透射光谱,将待测的试样磨成粉末,经过压片后制成试样,然后放在红外光谱仪上测试分析。
选取表面平整、长宽3~5 mm、厚度2~3 mm 的小块玻璃在含量为4%的氢氟酸中放置30 s,用酒精进行清洗,干燥后喷金,利用JSM-6460LV型扫描电镜观察玻璃表面的形貌。
将熔制好的样品磨细成粉末,过200目筛后进行测试。实验所采用的设备是日本岛津XRD-7000S/L型X射线衍射分析仪进行物相分析和结构分析。测试条件为铜靶工作电压40 kV,工作电流30 mA,扫描速度5°/min,扫描范围2θ为10°~70°,测试温度为室温。
将玻璃冷加工处理成直径5 mm、长度45~50 mm的玻璃棒,利用PCY型高温卧式膨胀仪以6 ℃/min升温速率进行测试,确定玻璃的热膨胀系数、转变温度(tg)及软化温度(tf)。
化学稳定性分析采用滴定法,将玻璃研磨成粉末,取30目与50目筛之间的粉末2 g放入100 mL 容量瓶中;用滴定管吸取去离子水,多次冲洗容量瓶壁保证颗粒完全浸入水中直至到达刻度线;将容量瓶密闭,放在水浴锅中,将温度设定为98 ℃,水浴加热保温1 h之后从水浴锅中取出容量瓶,打开塞子,静置让颗粒沉落;取25 mL清液与两滴甲基红指示剂放入锥形瓶中,用标准稀盐酸滴定至轻微红色;进行3次重复试验,根据每克玻璃颗粒耗用0.01 mol/L的盐酸1 mL,相当于每克玻璃颗粒析出310 g氧化钠计算,选取平均值。
将玻璃处理成块状并抛光,选取3个不同的点,用数字显微硬度计HXD-1000(HV)进行硬度测试,取平均值。
釉烧实验分析是将退火后的玻璃再次研磨,将过200目筛的粉末覆盖于瓷砖上,放入硅碳棒电阻炉中,在1 200 ℃下保温30 min。
2 结果与讨论
2.1 红外光谱结构分析
由玻璃样品的FT-IR光谱(图1)可见,乳浊玻璃的红外光谱中有9个明显的吸收峰,分别位于475、570、690、785、1 050、1 384、1 630、2 925、3 442 cm-1处附近。
波数475 cm-1处附近的吸收峰是Si—O—Si弯曲振动峰;570 cm-1附近的吸收峰对应于Si—O—Al 的弯曲振动,其中涉及[SiO4]以及[AlO4];690 cm-1处附近为P—O—B键弯曲振动的吸收峰;785 cm-1处附近的吸收峰与O—Si—O 伸缩振动有关;1 050 cm-1附近的吸收峰是Si—O—Si反对称伸缩振动峰;1 384 cm-1附近的吸收峰是[BO3]反对称伸缩振动峰;1 630 cm-1附近的吸收峰是与羟基有关的基团振动;2 925 cm-1附近的吸收峰是Si—OH振动引起的;3 442 cm-1处附近的吸收峰是水分子引起的。
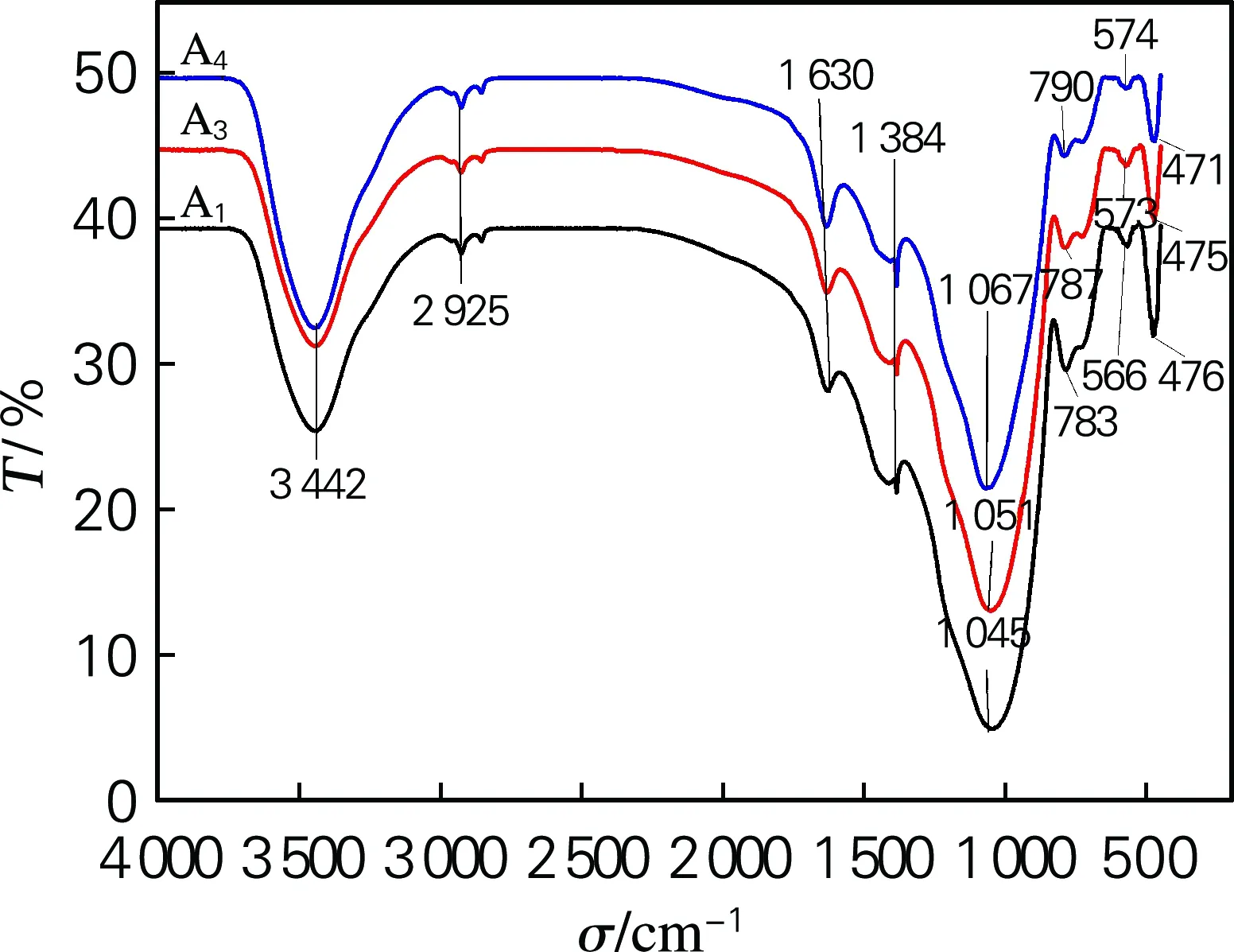
图1 红外光谱分析图
分析结果表明,Al2O3主要以[AlO4]形式进入了玻璃网络,与[SiO4]联结起到加强网络作用。而P2O5与B2O3结合形成了P—O—B键,部分B2O3由于玻璃种游离氧不足而以[BO3]存在;随着Na2O含量的减少,CaO-MgO含量的增加,在475 cm-1处附近的Si—O—Si弯曲振动峰逐渐减弱,在570 cm-1处附近的Si—O—Al弯曲振动峰逐渐减弱,在785 cm-1处附近的O—Si—O伸缩振动峰逐渐减弱,在1 050 cm-1处附近的Si—O—Si 反对称伸缩振动峰逐渐减弱,而在1 384 cm-1处附近的[BO3]反对称伸缩振动峰变化不明显。这些结果表明,随着CaO-MgO增加Si—O—Si和Si—O—Al削弱或减少,这是由于Na2O相对分子质量大于CaO和MgO的相对分子质量,等质量取代时CaO-MgO摩尔分数增加幅度比Na2O摩尔分数减少幅度大,使Ca2+和Mg2+具有极化桥氧和减弱硅氧键的作用,因此导致了Si—O—Si减弱。另外,Na2O的减少使Al2O3不能获得足够游离氧而使[AlO4]减少,导致了Si—O—Al减少。由于玻璃中Na2O含量较低,Al2O3含量高,Na2O提供的游离氧优先被Al2O3夺取,所以除了部分B2O3与P2O5结合形成[PBO4]外,主要以[BO3]存在于玻璃中,因此1 384 cm-1附近的[BO3]反对称伸缩振动随Na2O含量变化不明显。
2.2 玻璃乳浊度及显微结构随组分变化
玻璃试样A1~A5的乳浊程度逐渐降低最后趋于透明,图2为降低Na2O提高CaO-MgO含量乳浊玻璃的SEM图片,明显看出富磷相尺寸随组成不同有很大变化。

(a) A1
随着Na2O减少玻璃内部富磷相由A1中圆滴状分相密集到A3圆滴状分相分散再到A5分相变为均匀长条状。A3试样Na2O为5.5%时,分散相为明显圆滴状,尺寸为150 nm左右。CaO和MgO在所制备玻璃中以网络外体形式存在,Ca2+和Mg2+不参加玻璃架构,以离子的形式存在于网络的空隙中,而且Ca2+和Mg2+的场强大于Na+的场强,起积聚作用,使玻璃黏度提高[14]。所以Ca2+和Mg2+在玻璃网络中阻碍了分相的富集,从而使玻璃分相程度降低,导致富磷相边缘分散变成连通状且尺寸减小,进而使乳浊程度降低。
2.3 XRD物相分析
图3为样品的XRD图谱,根据XRD分析测试理论,晶体衍射图谱的强度主要与晶体种类、结构以及参与衍射的晶体的完整性有关[15]。根据图3可以看出XRD图谱不存在明显的衍射峰,呈现出弥散的散射峰,表明玻璃试样中绝大多数为典型的玻璃态,即试样中并不存在晶相或晶相含量极少。这是因为玻璃分相是冷却过程中发生相分离,形成折射率不同的两相,入射光在相界面发生散射导致乳浊。根据图2,试样在扫描电子显微镜下呈现出液滴状的富磷相,进一步证实了乳浊玻璃是典型的分相乳浊。
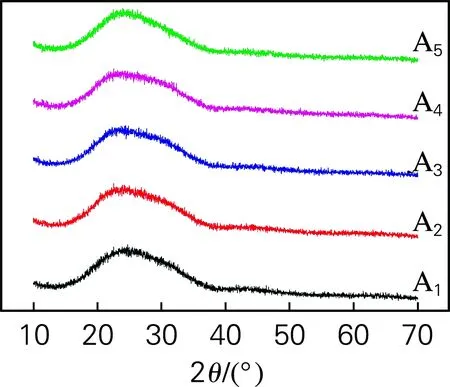
图3 乳浊玻璃试样的XRD图谱
2.4 热膨胀系数与tg、tf
乳浊玻璃的热膨胀系数与tg、tf如表2所示。
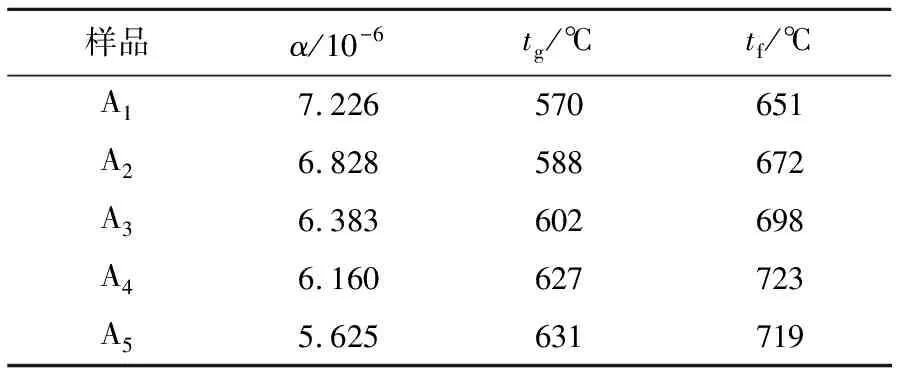
表2 样品的热膨胀系数及特征温度
依据表2可以看出,随着Na2O含量的减少,CaO-MgO含量的增大,热膨胀系数表现出递减、tg和tf呈现出增大的趋势。Ca2+和Mg2+的场强大于Na+的场强,起积聚作用,故CaO-MgO含量的增大使网络致密,导致黏度上升,膨胀系数下降和tg、tf上升。
2.5 化学稳定性分析
从图4可知,随着CaO与MgO引入量的增大,耐水性呈现逐渐增强的趋势。引入Na2O的逐步减少,即所供给网络系统的游离氧的总量逐步降低,其对网络所起到的断网作用越来越小,这是因为可迁移的Na+减少,阻碍Na+迁移,Ca2+和Mg2+增多,网络得到加强。玻璃网络的松散和结构的不稳定性会直接影响到玻璃的耐水性能,碱金属离子由于容易通过扩散机理而迁移到玻璃表面,从而造成对玻璃样品网络结构的侵蚀。本实验证明随着CaO与MgO引入含量的增大,Na2O含量逐渐减少,试样化学稳定性优异且逐渐增强,玻璃水解等级均为一级。
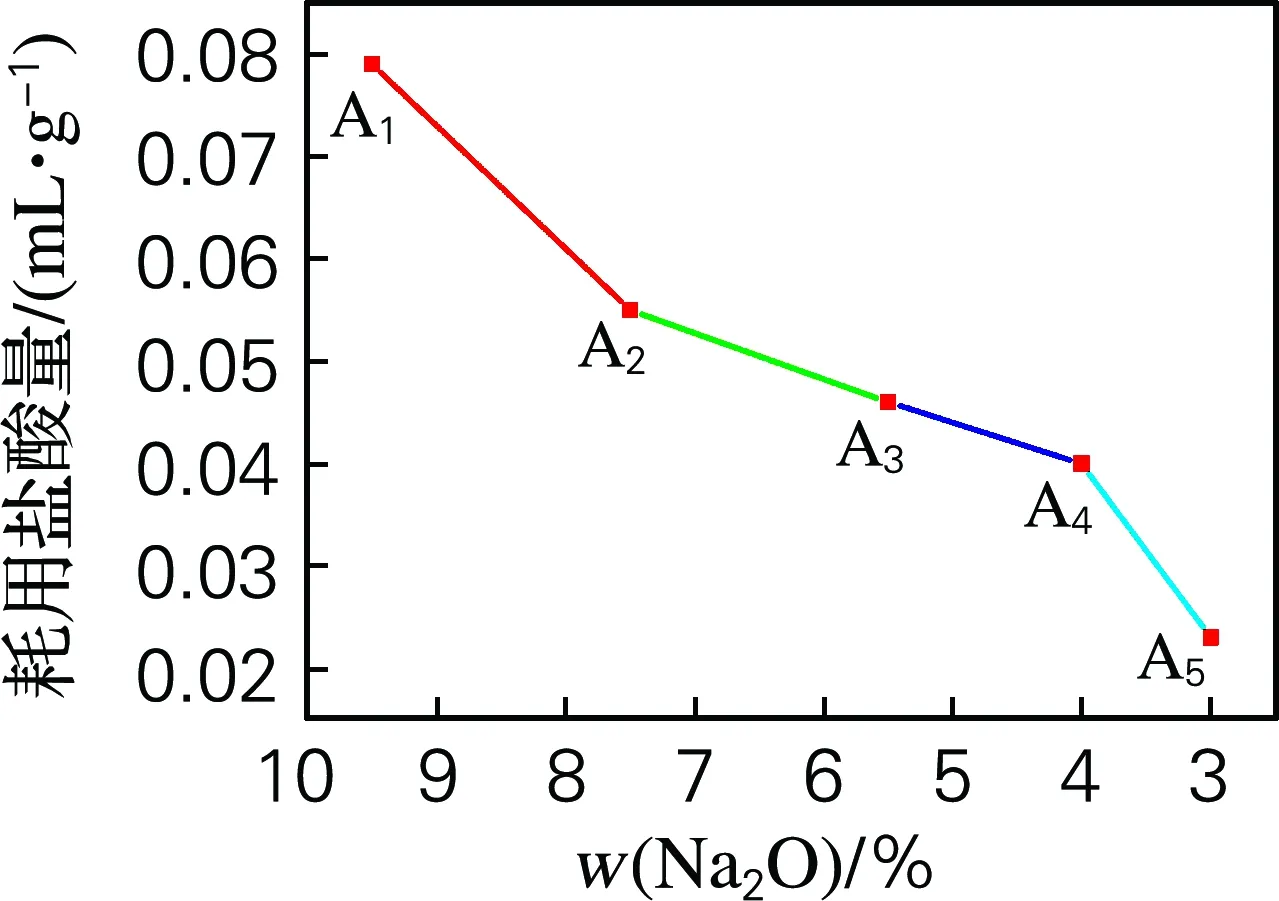
图4 化学稳定性变化曲线
2.6 显微硬度分析
由显微硬度线性图(图5)可知,随着Na2O含量的增加,CaO-MgO的含量减小,乳浊玻璃的显微硬度表现为减小的趋势,Na2O添加量为7.5%~3%,玻璃的硬度为554.1~591.5 HV。因为配位体的键强决定显微硬度的大小,Na+场强小,半径大,与氧的键强弱,Ca2+与Mg2+场强大,起集聚作用,而且增加Ca2+与Mg2+使玻璃网络结构变得更加致密。Ca2+半径较小,电场强度较小,可以填充到玻璃内骨架结构之间,使骨架结构之间的空隙变小,玻璃内部的致密度增加,从而使玻璃显微硬度变大[16]。因此在玻璃网络中Na+多、Ca2+与Mg2+少导致玻璃硬度下降。
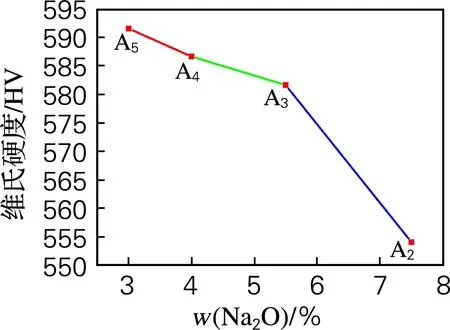
图5 显微硬度线性图
2.7 釉烧实验分析
将玻璃磨成能过200目筛的粉末,放在瓷砖上,烧结成直径约为7 mm的圆形[17],如图6所示,玻璃与瓷砖黏结的效果都很好,表面光滑,无裂纹。效果明显,玻璃跟陶瓷黏结适应性良好,有力地论证了玻璃跟陶瓷封接的可能性,并且取得预期封接效果。

图6 玻璃黏结效果图
由分析可知,在A1~A5组中,A1膨胀系数高,A4在瓷砖上有紧缩的现象,A5玻璃接近透明,因此A2和A3试样更适合作墙地砖乳浊釉、卫生瓷乳浊釉以及陶瓷乳浊釉等[18]。
3 结 论
研究结果表明,调整Na2O与MgO-CaO的相对含量可以改变玻璃结构、乳浊程度与性能。
随着Na2O含量的减少,CaO-MgO含量的增大,玻璃的乳浊程度降低,最后趋于透明;随着CaO-MgO含量的增大,热膨胀系数表现出递减的趋势;转变温度和软化温度呈现出增大的趋势;显微硬度呈现增大的趋势;所制备乳浊玻璃化学稳定性较好,玻璃水解等级均为一级。所制备的乳浊玻璃与瓷砖黏结的效果良好,表面光滑,无裂纹,可用作陶瓷乳浊釉。
