丁香酚在斜带髭鲷体内蓄积与消除规律及休药期
2020-01-16刘海新罗方方汤水粉马文学郑一玲
刘海新,余 颖,罗方方,汤水粉,马文学,陈 思,郑一玲
(1.福建省水产研究所,福建 厦门 361013;2.福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013;3.福建省海洋生物资源开发利用协同创新中心,福建 厦门 361013)
丁香酚(eugenol)为苯丙素类化合物,可从丁香树、柴桂等多种植物中提取[1],有麻醉水生动物的生理作用[2]。丁香酚可有效降低鱼的应激效应,提高运输密度和存活率,因此在活鱼运输环节中使用率高。当前我国对麻醉剂用于食用水产品尚未开放,因此采用丁香酚麻醉食用活鱼并不合法。目前丁香酚残留可能导致食用安全风险已引起行业主管部门关注。近年来研究表明,长期食用高浓度丁香酚残留食品会影响人体健康。美国国家毒理学规划处研究认为丁香酚具可疑致癌性[4];欧洲食品安全委员会进一步研究表明丁香酚对兔子有生长发育毒性,并制定每kg 人体每日允许摄入量为1.0 mg[5]。因此,研究水产品中丁香酚残留与消除有重要意义。
丁香酚于在水产方面应用研究重点在其对水生动物的麻醉效果[6-16],而对丁香酚在水生动物体内蓄积消除规律研究较少,仅见对虹鳟(Oncorhychus myskiss)[17]、罗非鱼(Oreochromis niloticus)[18]、银鲈(Bidyanus bidyanus)[19]、凡纳滨对虾(Litopenaeus vannamei)[20]的研究。笔者以斜带髭鲷(Hapalogenys nitens)为实验动物,模拟长途运输麻醉过程,研究丁香酚在其血浆、肌肉、肝脏中蓄积和消除规律,并采用线性回归统计分析估算休药期,为丁香酚应用于水产动物运输的食用安全评估提供基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 斜带髭鲷体质量为(450±50)g,泉州市泉港肖厝养殖户提供。实验前在室内循环水族箱内暂养1 周。养殖用水为沙滤海水,曝气48 h后使用,盐度26,养殖过程不断充氧,保持水中溶解氧大于6.0 mg/L,每天换水1 次,投喂不含药物的冻干磷虾。挑选体表完整、活力强、无病无伤个体进行实验。
1.1.2 试剂及主要仪器 丁香酚标准品,Sigma 公司,纯度≥99%;乙酸丁香酚酯标准品,德国Dr.Ehrenstorfer 公司,纯度≥97%;分析纯丁香酚,上海麦克林生化科技有限公司,纯度≥99 %;正己烷,美国TEDIA 试剂公司,色谱纯;无水硫酸钠,国药集团化学试剂有限公司,经650 ℃灼烧4 h 于干燥器中冷却备用;C18 和PSA 吸附剂,德国CNW 科技公司。
主要仪器有Agilent 7010 型三重四极杆气质联用仪(美国安捷伦科技有限公司)、色谱柱Thermo TG-17MS 石英毛细管柱(30 mm × 0.25 mm × 0.25µm)、TGL-16G 离心机(上海安亭)、TDL-40B 离心机(上海安亭)、AB204-E 电子分析天平(瑞士梅特勒托利多)、IKA MS3 旋涡混合器(德国IKA)、均质器Retsch GM200(德国Restch)。
1.2 方法
1.2.1 不同质量浓度丁香酚麻醉效果 设置丁香酚质量浓度梯度为2.5、5.0、7.5、10、20、40 mg/L,每个梯度实验鱼10 尾,放入麻醉液中麻醉1 h 后转入海水中复苏,观察鱼体进入不同麻醉及复苏分期的行为特征并计时。用同样质量浓度梯度的丁香酚溶液,每个梯度实验鱼10 尾,分别麻醉鱼6 h 和12 h 后转入海水中复苏1 h,记录鱼复苏率。
1.2.2 药浴麻醉和海水复苏 用海水根据1.2.1 结果配制丁香酚溶液。取斜带髭鲷70 尾,分别放入7个150 L 水族箱,每箱10 尾。水族箱中预先注入配制的丁香酚溶液。另取10 尾作为空白对照组不给药。麻醉过程不断充氧,于给药后0.16、0.33、0.66、1.0、1.5、2.0、3.0、4.0、5.0、6.0、8.0 h,随机从水族箱中取6 尾,自尾静脉采血,加入10 g/L 抗肝素钠0.3 mL(抗凝),混匀后离心,取上清血浆;剖取肝脏,用研钵磨碎均质后装入离心管中;剖取肌肉,用均质器均质后装入广口玻璃瓶。血浆及组织样品于-18 ℃保存,待测。另取130 尾斜带髭鲷按上述方法麻醉8 h 的鱼,分别放入9 个装有300 L海水的水族箱中,每箱≤15 尾,每日换水1 次。养殖用水为沙滤海水,曝气48 h 后使用,盐度26,养殖过程不断充氧,保持水中溶解氧大于6.0 mg/L。于0.16、0.5、1.0、2.0、5.0、7.0、8.0、10、15、24、48、72、96、144、216、264、312、360、408、456 h 随机从水族箱中分别取鱼6 尾,同法采集血及肌肉与肝脏。为研究不同季节活鱼麻醉运输和海水复苏过程中丁香酚在鱼体内变化规律,分别于水温15 ℃和25 ℃条件下进行上述实验。
1.2.3 样品前处理 采用QuCHERS 法进行。以正己烷提取鱼体组织中丁香酚,无水硫酸钠吸取多余水分,PSA 和C18 去除干扰物。方法如下:
血浆:将冷冻保存的血浆于室温下自然解冻,混匀,吸取0.5 mL 加入200 ng/mL 内标(乙酸丁香酚酯)溶液500 μL、正己烷2.5 mL 和无水硫酸钠2 g,旋涡震荡2 min,以4 000 r/min 离心10 min,吸取上清液,用2.5 mL 正己烷重复提取1 次,合并上清液。取2.0 mL 提取液加入吸附剂PSA、C18 各100 mg 和无水硫酸钠200 mg,涡旋混合2 min,静置5 min,以12 000 r/min 离心10 min,取上清液,过孔径0.22 μm 滤膜后待测。
肌肉和肝脏:将冷冻保存样品于室温下自然解冻,称取(2.0±0.1)g,加入200 ng/mL 内标(乙酸丁香酚酯)溶液1.00 mL、正己烷5 mL 和无水硫酸钠2 g,旋涡震荡2 min,以4 000 r/min 离心10 min,吸取上清液,再用5 mL 正己烷重复提取1 次,合并上清液。取提取液2.0 mL,加入吸附剂PSA、C18各100 mg 和200 mg 无水硫酸钠,涡旋混合2 min,静置5 min,以12 000 r/min 离心10 min,取上清液,过孔径0.22 μm 滤膜后待测。根据预实验情况,对浓度较高的血浆和组织样品稀释到线性范围内检测。
1.2.4 仪器检测 色谱条件:进样口温度250 ℃;不分流进样;进样量1 μL;初始温度为80 ℃,保持2 min,以10 ℃/min 升温至190 ℃,再以20 ℃/min升温至250 ℃保持5 min;氦气为载气(纯度 >99.999%),流量为1.2 mL/min。
质谱参数:电子轰击能量为70 eV;离子源和四级杆温度分别为250、150 ℃;传输线温度250 ℃;氮气为碰撞气,流量1.5 mL/min;氦气为淬灭气,流量为2.25 mL/min;溶剂延迟8 min。
采用多重反应监测(Multiple reaction monitoring,MRM)模式进行,丁香酚以核质比m/z149 作为定量离子、m/z104 作为辅助定性离子;对内标乙酸丁香酚酯以m/z149 作为定量离子、以m/z131 作为辅助定性离子。离子监测参数见表1。
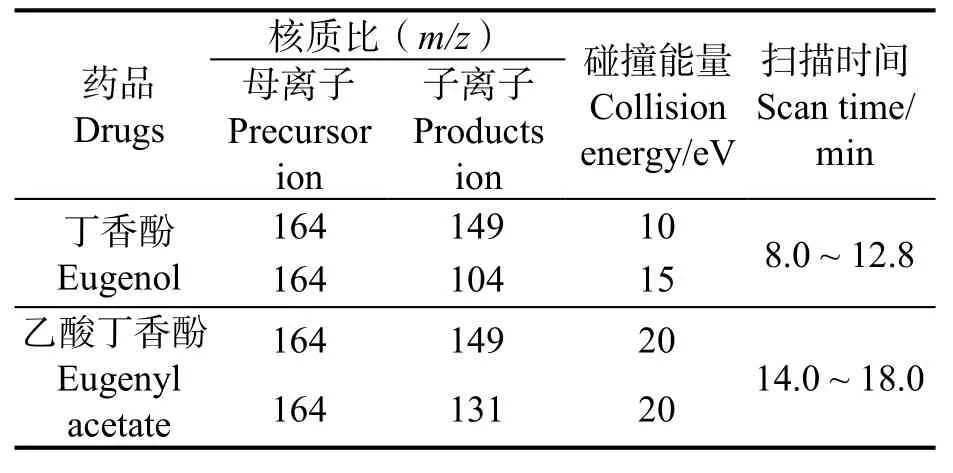
表1 丁香酚和丁香酚乙酸脂离子监测参数Table 1 Monitoring parameters for eugenol and eugenyl acetate detection in mass spectrometry
1.2.5 标准曲线绘制 取空白对照组斜带髭鲷的血浆和肌肉、肝脏组织,分别添加不同量的丁香酚标准工作液,使提取液质量浓度分别为0.1、0.4、2.0、10、20、50、100、500 ng/mL。按上述样品前处理方法处理后进行GC-MS/MS 分析,用内标法对丁香酚含量进行定量。
1.2.6 检测结果的可靠性和定量限 取空白血浆,加入不同浓度的丁香酚,使血浆中丁香酚质量浓度分别为1.0、5.0、50、500 μg/L,每个浓度取6 个平行样品,检测回收率为78.4%~ 96.5%,相对标准偏差为6.59%~ 9.12%。取空白肌肉,加入不同浓度的丁香酚,使肌肉中丁香酚质量浓度分别为1.0、5.0、50、500 μg/kg,每个浓度取6 个平行样品,检测回收率为79.1%~ 88.8%,相对标准偏差为5.12%~ 11.2%。取空白肝脏,加入不同浓度丁香酚,使肝脏中丁香酚质量浓度分别为2.0、5.0、50、500 μg/kg,每个浓度取6 个平行样品,检测回收率为77.2%~88.3%,相对标准偏差为4.11~ 12.8 %。因此,所用检测方法符合药物分析要求。根据信噪比大于10及回收率70%~ 120%的要求,确定肌肉和血浆定量限为1 μg/kg,肝脏定量限为2 μg/kg。
1.2.7 休药期估算 日本对丁香酚在鱼类中最高残留限量(MRL)为50 μg/kg[22],依据该限量水平参照欧洲药品管理局(European Medicines Agency,EMA)方法[21]估算休药期。即lnCt=-kt+lnC0,Ct为不同时间点组织中药物浓度,C0指数前因子(时间t=0 时,组织中药物浓度)。EMA 推荐,以动物组织中药残浓度(正态分布单侧95%置信限95%容许上限)低于最高残留限量(MRL)时间为休药期(d)。如算得结果不是整数,应以“d”为单位向上取整。
1.3 数据处理
采用DAS2.0 药代动力学软件对药-时数据进行模型拟合并计算主要代谢动力学参数,用SPSS22.0 统计软件分析数据的相关性、显著性以及方差。
2 结果与分析
2.1 丁香酚麻醉斜带髭鲷浓度确定
丁香酚对不同鱼类的麻醉表现各有差异,参考文献 [11-13],将麻醉和复苏分别分为A1 -A4、R1-R4 各4 个阶段,各阶段行为特征见表2。

表2 斜带髭鲷麻醉与复苏分期及行为特征Table 2 Behavior of Hapalogenys nitens in different anaesthetic and recovery stages
由表3 和表4 可知,在2.5 mg/L 的丁香酚中,斜带髭鲷即有麻醉反应;5.0~ 7.5 mg/L 的丁香酚就能使斜带髭鲷产生鱼体失去平衡、平躺到容器底部的麻醉效果;质量浓度为10 mg/L 丁香酚溶液可使斜带髭鲷进入深度麻醉状态,麻醉12 h 后,复苏率为90%。斜带髭鲷经20 mg/L 丁香酚溶液麻醉6 h,复苏率90%,麻醉12 h 复苏率70%。经40 mg/L 丁香酚溶液麻醉6 h,斜带髭鲷全部死亡。说明超过20 mg/L 丁香酚溶液对斜带髭鲷有一定毒性作用。
据了解,长途运输过程中用丁香酚麻醉鱼时,丁香酚用量难以准确控制,主要通过观察药物对鱼的麻醉效果而定。只要鱼活动能力明显降低、沉到水箱底部,即可达到长途运输降低死亡率的目的,并不将鱼麻醉到完全失去活动能力状态,即鱼被麻醉程度相当于“反应迟钝,鳃盖张合频率缓慢,鱼体失去平衡”的A2 麻醉阶段;部分长途运输中的鱼也会进入“失去反应能力,鳃盖张合没规律,平躺于容器底部”的A3 麻醉阶段。表2~ 4 可见,丁香酚质量浓度定为7.5 mg/L 时,斜带髭鲷进入A3麻醉阶段,但不进入深度麻醉的A4 阶段,可确保经长时间麻醉后的复苏率仍较高。因此,确定麻醉斜带髭鲷的丁香酚质量浓度为7.5 mg/L。
2.2 丁香酚在鱼体内浓度变化和代谢动力学参数
2.2.1 药浴麻醉 在水温(15±2)℃条件下,7.5 mg/L 丁香酚溶液药浴麻醉的药物在血浆、肌肉、肝脏中药-时曲线见图1。图1 可见,药浴过程中,丁香酚在不同组织中蓄积趋势一致。各组织药物浓度组药浴2 h 后达到峰值,在药浴8 h 内基本保持稳定。(15±2)℃和(25±2)℃水温环境条件下,麻醉过程丁香酚在鱼体内蓄积变化见图2~ 4。结果表明,温度会显著提高丁香酚在鱼体内蓄积浓度,高温条件下绝大部分时间点血浆和组织中丁香酚浓度值均高于低温条件下对应时间点。

表3 不同质量浓度丁香酚对斜带髭鲷麻醉效果Table 3 Anaesthetic effect of eugenol at different concentration on Hapalogenys nitens

表4 不同质量浓度丁香酚长时间麻醉对斜带髭鲷的影响Table 4 Effect of eugenol concentration on recovery of Hapalogenys nitens

图1 15 ℃药浴麻醉中血浆、肌肉、肝脏丁香酚药-时曲线Fig.1 Eugenol concentration in tissue during the period of anaesthetization at 15 ℃
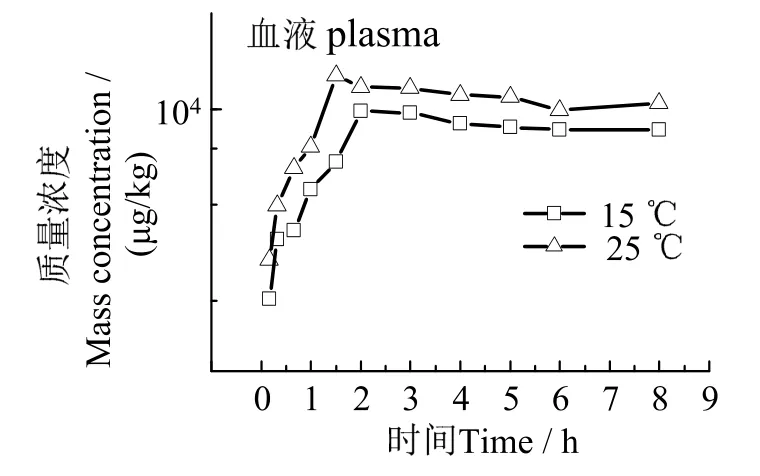
图2 不同温度下麻醉过程血浆中丁香酚药-时曲线Fig.2 Eugenol concentration in plasma at different temperature during the period of anaesthetization
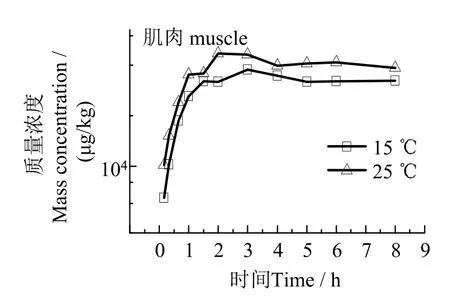
图3 不同温度下麻醉过程肌肉中丁香酚药-时曲线Fig.3 Eugenol concentration in muscle at different temperature during the period of anaesthetization

图4 不同温度下麻醉过程肝脏中丁香酚药-时曲线Fig.4 Eugenol concentration in liver at different temperature during the period of anaesthetization
在丁香酚药浴麻醉过程中,斜带髭鲷各组织中丁香酚达到最高浓度时间和浓度值见表5。
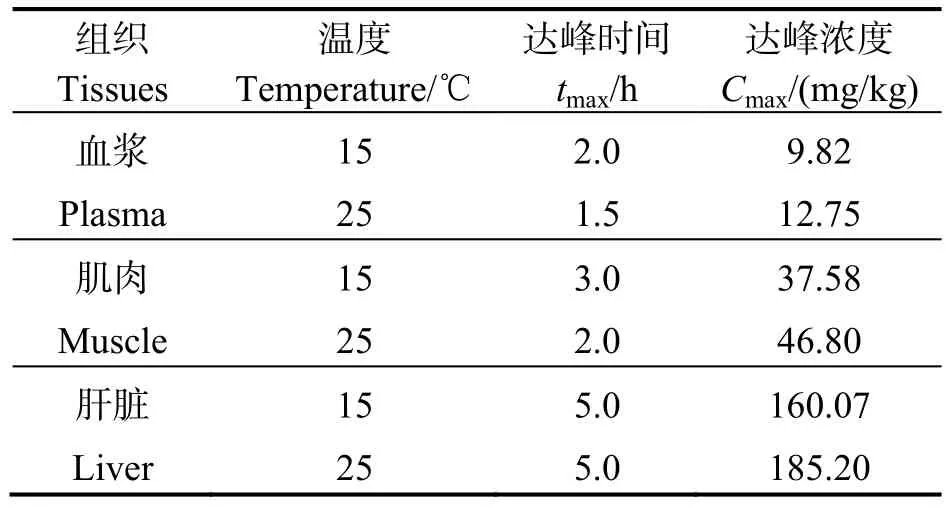
表5 斜带髭鲷药浴麻醉时丁香酚的达峰时间和达峰浓度Table 5 Eugenol peak time and peak concentration of Hapalogenys nitens during the period of anaesthetization
表5 表明,采用7.5 mg/L 丁香酚麻醉斜带髭鲷,药物达峰时间tmax由小到大依次为血浆、肌肉、肝脏。15 ℃和25 ℃水温条件下,肝脏达峰浓度Cmax分别为160.07 mg/kg 和185.20 mg/kg,显著高于肌肉和血浆。水温从15 ℃升到25 ℃,斜带髭鲷血浆丁香酚达峰时间tmax从2.00 h 降至1.50 h,肌肉中tmax从3.00 h 降至2.00 h,蓄积速度有所加快,而肝脏中tmax无明显影响。温度对鱼体中丁香酚蓄积影响还表现在各组织达峰浓度上,血浆、肌肉和肝脏的Cmax增加幅度分别为29.8%、24.5%和15.7%。因此,升温可提高丁香酚在鱼体内蓄积速度及浓度水平。
2.2.2 复苏 图5 可见,斜带髭鲷经丁香酚溶液麻醉8 h 后在海水中复苏时,丁香酚在鱼体内快速降解,48 h 时血浆和肌肉中丁香酚浓度低于50 μg/kg,48~ 456 h(19 d)丁香酚在4~30 μg/kg 范围无规律变化。肝脏中丁香酚48 h 后在80~ 400 μg/kg 范围无规律变化。
根据赤池信息量准则(Akaike information criterion,AIC)最小原则判断(权重系数取1/c2),斜带髭鲷复苏时丁香酚在鱼体内代谢过程符合二室模型,主要药物代谢动力学参数见表6。水温从15 ℃升高到25 ℃,丁香酚在斜带髭鲷血浆中平均驻留时间MRT(0-t)从6.464 h 降至6.076 h,在肌肉中从4.001 h 降至3.756 h,在肝脏中从6.670 h 降至5.791 h,降幅分别为6.00%、6.12%、13.17%,代谢速度随温度升高有所加快。
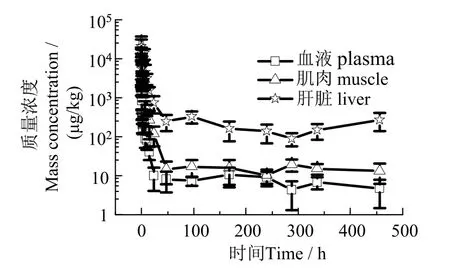
图5 斜带髭鲷鱼体复苏丁香酚药-时曲线Fig.5 Eugenol concentration in tissue during the period of recovery

表6 不同温度下斜带髭鲷体内丁香酚降解过程药物代谢动力学参数Table 6 Pharmacokinetic parameters of Hapalogenys nitens during the period of recovery at different temperature
斜带髭鲷血浆、肌肉和肝脏丁香酚在降解过程中的浓度均出现反复现象(图6~ 8)。血浆和肝脏丁香酚浓度均在复苏5 h 时升高,肌肉丁香酚浓度在3 h 时升高。各组织丁香酚浓度升幅差异大。肝脏从3.02×103μg/kg 回升到1.37×104μg/kg,升幅为353%;血浆从167 μg/kg 回升到257 μg/kg,升幅为 53.9%;肌肉从 1.77×103μg/kg 回升到2.78×103μg/kg,升幅为57.1%。肝脏丁香酚升幅远大于肌肉和血浆。
温度升高对鱼体血浆、肌肉、肝脏中丁香酚含量影响见图9~ 11。由图9~ 11 可见,不同温度下复苏48 h 后斜带髭鲷血浆、肌肉和肝脏中丁香酚残留浓度差异无统计学意义(P> 0.05),说明温度变化对各组织中丁香酚长时间残留浓度影响不大。

图6 复苏20 h 血浆中丁香酚药-时曲线Fig.6 Eugenol concentration in plasma during the period of recovery in 20 hours

图7 复苏20 h 肌肉中丁香酚药-时曲线Fig.7 Eugenol concentration in muscle during the period of recovery in 20 hours

图8 复苏20 h 肝脏中丁香酚药-时曲线Fig.8 Eugenol concentration in liver during the period of recovery in 20 hours

图9 不同温度下复苏过程血浆中丁香酚药-时曲线Fig.9 Eugenol concentration in plasma during the period of recovery at different temperature
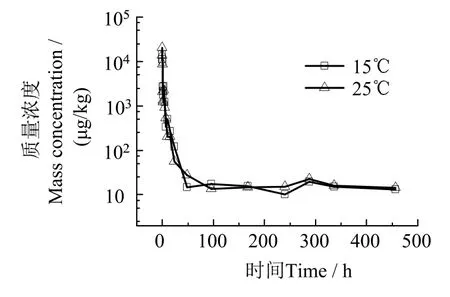
图10 不同温度下复苏过程肌肉中丁香酚药-时曲线Fig.10 Eugenol concentration in muscle during the period of recovery at different temperature
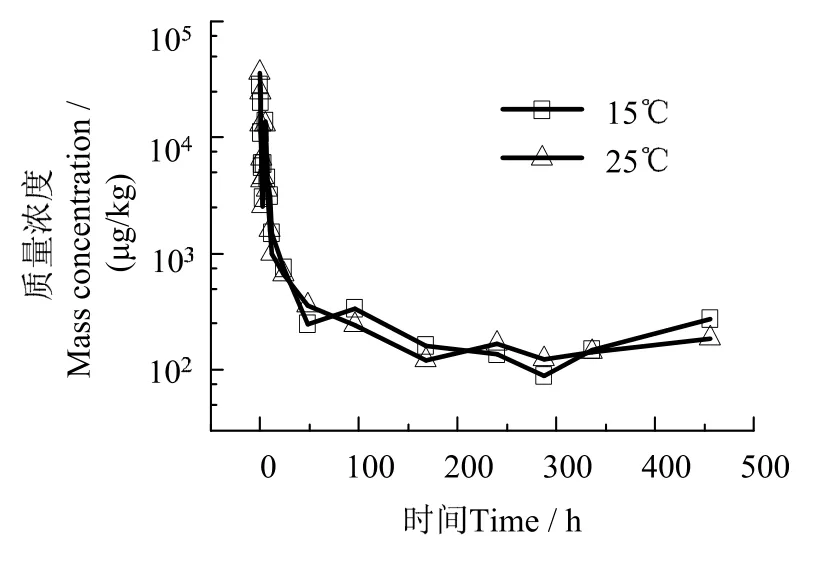
图11 不同温度下复苏过程肝脏中丁香酚药-时曲线Fig.11 Eugenol concentration in liver during the period of recovery at different temperature
2.3 丁香酚在鱼肌肉中的休药期
将表7 中肌肉丁香酚浓度值取自然对数,最小二乘法线性回归方程为y=-0.092 7x+6.907 0,相关系数R=0.915 8。以线性回归统计分析估算休药期,所采用的数据需满足方差齐性检验、失拟检验、残差正态分布检验要求。如数据未通过这些检验,说明数据中存在离群值或所采用的时间点组织中药物不在代谢末端消除期,需剔除离群值或重新选择其他时间点的数据进行计算。
以柯克伦(Cochran)检验不同时间点残留浓度对数值的方差齐性[23],计算得统计量C=0.407,小于显著水平α=0.05 统计量临界值C=0.590,因此不同组数据的方差齐性符合要求;为确保拟合回归线性相关性满足统计要求需进行失拟检验,过程见表8。对给定显著水平α=0.05,计算所得统计量F=0.421 1 <F0.95(2,22)=3.44,因此认为,残留浓度对数值是时间的线性函数;在线性回归模型中,残差应服从正态分布。将残差除以Sy·x(剩余标准差)进行标准化,数值范围在-2.022~ 1.439 之间,均未超过4 倍剩余标准差的判定限。应用SPSS22.0软件“探索分析”功能,对标准化残差进行正态分布检验(Shapiro-Wilk),同时绘制正态分布检验Q-Q图,观察是否有离群值。Shapiro-Wilk 检验的显著性P=0.315 > 0.05,接受残差正态分布的假设。标准化残差分布均在预期直线周围,未发现较大偏离值如图12。通过上述3 项检验,说明用于休药期估算所采用的24 个数据符合线性回归分析要求。

表8 肌肉残留方差分析Table 8 ANOVA for muscle

图12 残差正态分布检验Q-Q 图Fig.12 Resdiuals normality test Q-Q plot
以正态分布单侧95%置信限95%容许上限计算药物在组织中不同时间点残留量水平,绘制曲线如图13。该曲线低于最高残留限量(MRL=50 μg/kg)对应时间50 h,即2.08 d。因此,休药期确定为3 d。
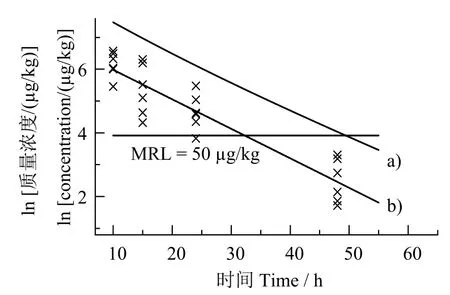
图13 肌肉休药期计算结果(95%置信度95%容许上限)Fig.13 Withdrawal period calculation for muscle(95%tolerance limit with 95% confidence)
3 讨论
3.1 丁香酚残留检测方法
目前,动物体内丁香酚残留检测方法主要包括液相色谱法[24-25]、气相色谱法[26]和质谱联用法[27-28],其前处理方法主要为均质震荡提取、液-液分配萃取、固相萃取等。近年来有学者采用QuEChERS 法前处理[29],以简化前处理过程,提高检测效率。因此,本研究运用QuEChERS 技术检测前处理样品,采用GC-MS/MS 进行定量检测。
3.2 丁香酚在斜带髭鲷体内累积及代谢动力学特征
本研究表明,麻醉过程中各组织丁香酚达峰时间血液最小,肌肉和肝脏次之,说明药物先进入血液循环,随血液分布到肌肉和肝脏;肝脏中丁香酚浓度峰值远高于其他组织,说明丁香酚在肝脏蓄积,丁香酚可能主要在肝脏中代谢;升温加快了丁香酚在鱼体内的蓄积并提高其峰值浓度,Kildea等[19]用 15 mg/L 丁香酚麻醉银鲈(Bidyanus bidyanus)时发现,高温也导致银鲈鱼体内丁香酚蓄积浓度有所提高。梁政远等[13]和陈德芳等[14]研究认为,温度升高会加快麻醉液经鳃丝或体表渗入鱼的速率,缩短麻醉作用时间,与本研究结果一致。
斜带髭鲷经丁香酚麻醉8 h 后放入海水中复苏,体内丁香酚浓度快速下降。血浆、肌肉和肝脏中丁香酚浓度在10 h 内下降超过50%,这与丁香酚在虹鳟鱼(Oncorhynchus mykiss)[17]、罗非鱼(Oreochromis niloticus)[18]、银鲈(Bidyanus bidyanus)[19]、凡纳滨对虾(Litopenaeus vannamei)[20]中消除规律类似。斜带髭鲷在复苏过程中丁香酚在血浆、肌肉和肝脏中表现出滞留的现象,在其他动物体也有类似特点,如丁香酚在蛙(Xenopus laevis)血浆中半衰期为4 h[30],在大鼠(Rattus norvegicus)血浆中半衰期为18.3 h[31]。复苏过程斜带髭鲷血浆、肌肉和肝脏中丁香酚降解均出现浓度反复现象,可能是丁香酚在鱼体内存在肝肠循环、胃肠循环现象所致。类似情况也出现在凡纳滨对虾[20]和大鼠[32]中,丁香酚等苯酚共轭化合物在动物体内代谢过程中,往往出现再循环现象。
研究表明,经丁香酚麻醉的鲤鱼(Cyprinus carpio)[13]和鲫鱼(Carassius auratus)[14]复苏时间随温度的升高而缩短,本研究中,温度升高亦加快丁香酚在鱼体内的代谢速度。可能是因为随着水温升高,鱼体的心跳和呼吸频率加快,新陈代谢较低温时期增强,加快了丁香酚在鱼体内的代谢,符合鱼类的代谢规律[14]。
Kildea 等[19]研究表明,首次使用丁香酚麻醉银鲈,48 h 后在鱼肉中未检出丁香酚;二次充分麻醉,一周后仍可在银鲈肌肉中检出丁香酚。方晓磊等[22]研究认为,活鱼对初次吸收的丁香酚消除能力强,鱼肉中丁香酚残留消除快,但也削弱了鱼体对丁香酚消除能力,二次给药后的鱼肉中丁香酚残留消除时间长。本研究长时间药浴麻醉类似于连续多次给药,导致丁香酚在鱼体内保持低浓度长时间残留。这可能是麻醉过程中丁香酚随血液分布到组织中与蛋白结合的结果。由于麻醉时间长,丁香酚与蛋白充分结合,鱼体内结合型丁香酚远高于游离型,起药库的作用。将鱼放入海水复苏后,体内游离丁香酚浓度逐渐降低,与蛋白结合的丁香酚缓慢释放,同时还存在肝肠循环、胃肠循环等现象,导致低浓度游离丁香酚在鱼体内长时间存在。
温度对低浓度药物在动物体内长时间残留影响不显著。Kildea 等[19]研究不同温度下复苏麻醉的银鲈(Bidyanus bidyanus),结果发现鱼体内低浓度丁香酚残留量差异也不显著。笔者认为可能是由于鱼体内结合型丁香酚和游离丁香酚之间的化学平衡,在15~ 25 ℃范围内受温度影响小,仍需进一步研究证实。
3.3 丁香酚休药期估算
孙宇航等[18]根据丁香酚在罗非鱼血浆消除规律方程估算8 d 后血浆中丁香酚低于检测限,确定休药期为8 d;彭勤等[20]根据经丁香酚麻醉后的凡纳滨虾48 h 后体内丁香酚浓度降低至0.8~1 μg/kg,得出休药期不少于48 h;Kildea 等[19]检测麻醉一周后的银鲈肌肉浓度平均值为0.32 mg/kg,依据每日允许摄入量(ADI)推算该浓度不会对人体健康产生影响。这些关于休药期的估算是以用药后某个时间点丁香酚残留量低于安全限为依据,未充分考虑到该时间点药物在动物体内代谢所处阶段、生物个体间代谢能力差异和统计学上合理偏差范围。以这种方式估算的休药期可能与实际情况存在一定偏离。本研究参照EMA 估算动物休药期指南,运用统计学方法将可能导致结果偏离的不确定因素考虑在内,绘制95%置信度95%容许上限曲线,以日本对鱼体中最大残留限量50 μg/kg 限量标准为界,得出3 d 休药期的结果。由于不同种类水产动物生理特点不同,对丁香酚代谢能力较大差异,丁香酚的使用浓度差别大。因此确定水产品运输合理的丁香酚休药期,还应对不同种类水产品开展休药期研究,按水产动物类别综合考虑制定休药期。
4 结论
1)在15℃以上水温条件下,经丁香酚麻醉8 h的斜带髭鲷,放到海水中3 d 复苏,肌肉中丁香酚浓度在95%置信度95%容许上限低于50 μg/kg,符合日本对鱼体最大残留限量要求。建议经丁香酚麻醉运输的斜带髭鲷休药期为3 d。
2)经丁香酚长时间麻醉的斜带髭鲷,该药物在鱼体内保持低浓度长时间存在。
