山奈酚肠溶复合纳米粒的体外释放和药代动力学研究
2020-01-16陈剑秋齐祥秋
陈剑秋,黄 洁,徐 雯,齐祥秋,杜 倩*
(1.徐州医科大学 药学院,江苏 徐州 221004;2.江苏省新药研究与临床药学重点实验室,江苏 徐州 221004)
山奈酚(Kaempferol)是一种黄酮类化合物,主要来源于姜科植物山奈的根茎,药理活性确切,可用于肿瘤、心血管疾病、糖尿病和帕金森病的预防和治疗[1,2]。然而山奈酚为生物药剂学分类系统(BCS)中的Ⅱ类药物[3],口服生物利用度低,因此,提高其生物利用度对于临床应用具有重要意义。多项研究[4-6]表明,多层结构的复合纳米粒,如壳聚糖衍生物表面修饰的脂质纳米粒能够促进难溶性药物的口服吸收。其中脂肪酸接枝三甲基壳聚糖可作为“壳”修饰于脂质载体的表面,形成“壳-核”结构,有效提高难溶性药物的口服吸收度[5]。本课题组的前期研究制备了癸酸接枝三甲基壳聚糖修饰的山奈酚纳米结构脂质载体,粒径为(112.3±3.3)nm,载药量为5.45%。本文进一步采用肠溶材料(Eudragit L30D-55)对纳米粒进行包覆以提高肠部吸收作用,同时考察其体外释放行为和体内药动学特征。
1 仪器与试药
1.1 仪器
Primaide日立高效液相色谱仪(日本日立公司);JY 92-IIN超声波细胞粉碎机(宁波新芝生物科技公司);RCT B S025恒温磁力搅拌器(德国IKA集团);MS104S/01分析天平(梅特勒-托利多公司);AB265-S电子天平(梅特勒-托利多公司);H1850台式高速离心机(湖南湘仪实验室仪器开发有限公司);SHZ-82A数显恒温振荡器(金坛区白塔新宝仪器厂);透析袋(上海源叶生物有限公司,截留分子量:8000 Da)。
1.2 药品与试剂
山奈酚(成都普菲德生物技术有限公司批号:18042303);肠溶丙烯酸树脂Eudragit L30D-55(Evonik_Rhom,pH>5.5溶解,批号:B130814318);硬脂酸(上海阿拉丁生化科技股份有限公司,批号:I1516021);单硬脂酸甘油酯(萨恩化学技术有限公司,批号:CE050024);辛酸癸酸甘油三酯(上海源叶生物有限公司,批号:Y29M9S62440);二乙二醇单乙基醚(山东优索化工科技有限公司,批号:S12907115);聚氧乙烯蓖麻油EL(德国BASF,批号:D1627045);大豆磷脂(上海艾韦特医药科技有限公司,批号:SY-SI-151004);癸酸接枝三甲基壳聚糖(DT,由本课题组制备);其余试剂均为分析纯或色谱纯。
1.3 实验动物
雄性SD大鼠,体重(200±20)g,购自济南朋悦实验动物繁育有限公司,许可证号 SCXK(鲁)2014-0007。
2 方法与结果
2.1 山奈酚肠溶复合纳米粒制备
称取处方量的硬脂酸、单硬脂酸甘油酯、辛酸癸酸甘油三酯、二乙二醇单乙基醚和聚氧乙烯蓖麻油EL,水浴加热熔融作为油相;另称取山奈酚和大豆磷脂溶解于少量无水乙醇并与油相混匀,之后在65 ℃水浴和800 rpm磁力搅拌下,缓慢滴加适量超纯水,继续搅拌60 min形成初乳并挥去有机溶剂,最后超声探头分散6 min(功率:650 W,频率:20 kHz),0.45 μm微孔滤膜滤过,即得山奈酚纳米结构脂质载体(KNLC)。将适量DT溶解于超纯水,缓慢加入上述KNLC纳米分散液,37 ℃孵育180 min,得癸酸接枝三甲基壳聚糖修饰山奈酚纳米结构脂质载体(DT-KNLC)。将稀释至适宜浓度的Eudragit L30D-55水分散液与适量DT-KNLC混合,100 rpm磁力搅拌30 min,即得山奈酚肠溶复合纳米粒(EL-DT-KNLC)。
2.2 体外释放试验
采用动态透析法。根据文献,选择35%乙醇溶液为释放介质[7-8](分别用盐酸和柠檬酸-柠檬酸钠缓冲盐调节至pH=1.0和6.0),以达到漏槽条件。分别精密量取1 mL DT-KNLC和EL-DT-KNLC分散液装入透析袋,投入到50 mL释放介质中,于37 ℃气浴中恒温振荡(100 rpm),分别在10 min、30 min、1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h取样1 mL,每次取样后补加1 mL等温释放介质,取出的溶液用0.45 μm微孔滤膜滤过,HPLC测定,计算山奈酚浓度和累积释放率,绘制体外释放曲线。使用OriginPro 8.0软件对体外释放曲线进行一级、Higuchi、Ritger-Peppas和Weibull方程拟合。由图1可知,EL-DT-KNLC在pH=1.0的介质中0~4 h几乎无释放,而在pH=6.0介质中,0~4 h累积释放量可达28.77%,DT-KNLC在pH=1.0和6.0的两种介质中的释放曲线接近。结果表明EL-DT-KNLC能极大地减少山奈酚在胃酸环境下的释放,达到肠溶效果。曲线拟合结果见表1,从回归系数可以判断,pH=6.0的介质中EL-DT-KNLC的释放曲线与Higuchi方程相关性最好,且Ritger-Peppas方程拟合结果n>0.89,表明山奈酚的释放机制为扩散与溶蚀作用相结合。
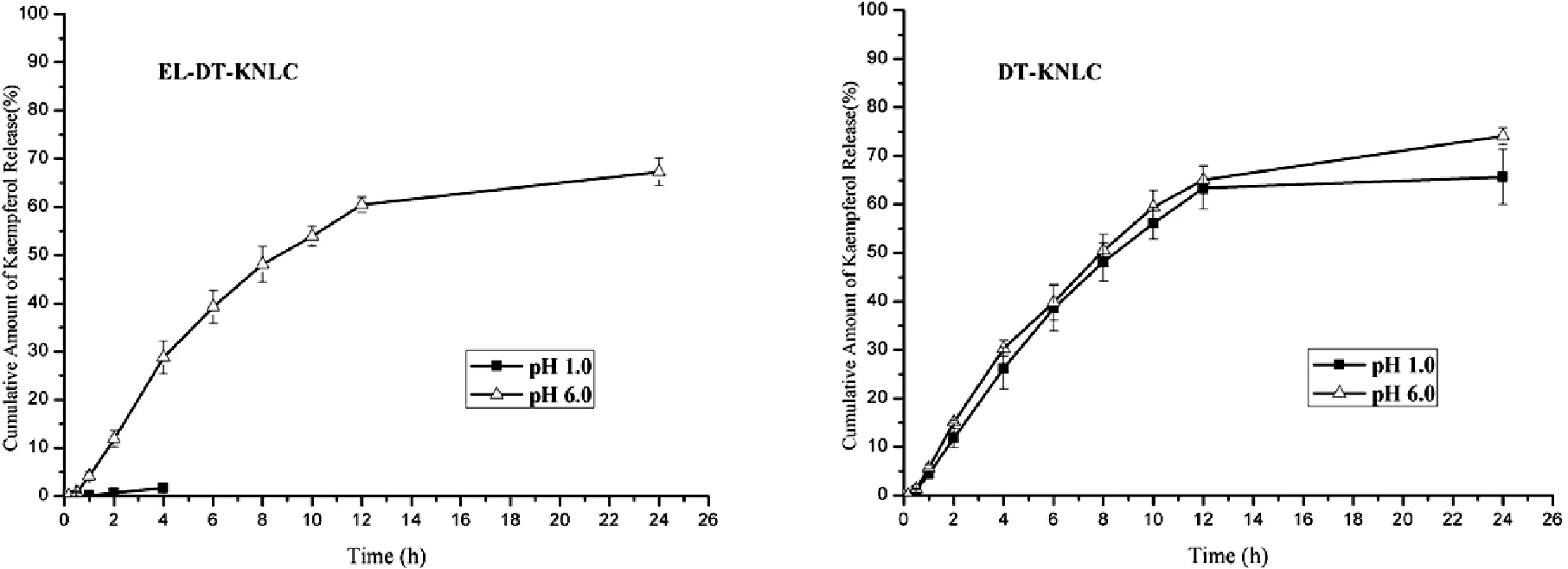
图1EL-DT-KNLC和DT-KNLC的体外释放曲线

表1EL-DT-KNLC体外释药拟合方程
2.3 大鼠口服药代动力学
2.3.1 给药方案与样品采集 将6只雄性SD大鼠随机分为DT-KNLC和EL-DT-KNLC组,每组3只。所有大鼠禁食12 h,不禁水,口服灌胃给药,给药剂量为16 mg/kg。给药后于10 min、20 min、1 h、4 h、6 h、8 h、10 h、12 h、24 h和72 h从大鼠眼眶静脉丛取血,全血置于1.5 mL肝素化EP管中,6 000 rpm离心10 min,分离出血浆,置于-20 ℃保存备测。
2.3.2 血浆样品处理 精密吸取血浆样品100 μL,依次加入100 μL盐酸(2 mol/L)和10 μL抗坏血酸溶液(5%,w/v),80 ℃水浴加热30 min。待冷却至室温,加入300 μL乙酸乙酯,涡旋3 min,10 000 rpm离心10 min,吸取全部上层有机相,再加入100 μL乙酸乙酯重复上述步骤。将乙酸乙酯在40 ℃下真空浓缩挥干,残留物中加入100 μL甲醇超声复溶,12 000 rpm离心10 min,取上清液至棕色进样小瓶中,进HPLC测定。
2.3.3 色谱条件 色谱柱:Wondasil C18-WR(4.6 mm×250 mm,5 μm);流动相:甲醇-0.05%三氟乙酸水溶液(65∶35);流速:1 mL/min;检测波长:360 nm;进样体积:5 μL;柱温:35 ℃。在上述色谱条件下,大鼠血浆样品中山奈酚的峰形良好,在出峰处无杂质干扰,专属性结果见图2。
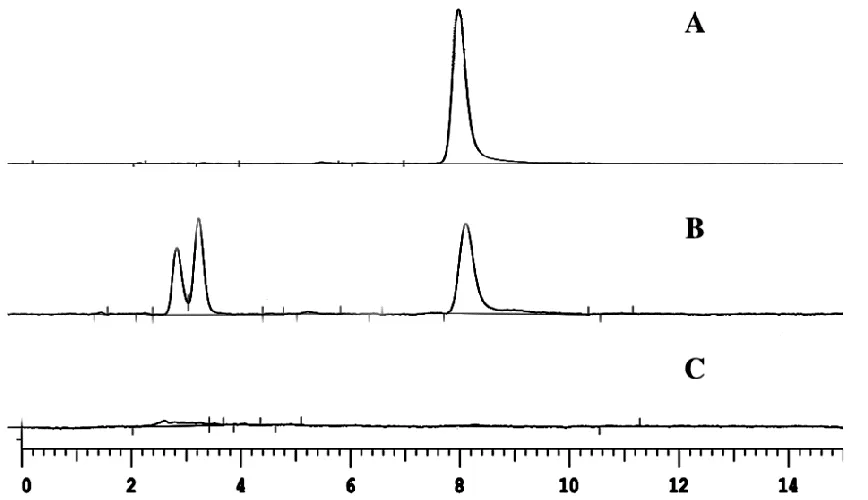
(A:山奈酚标准溶液;B:给药后的血浆样品;C:空白血浆)
2.3.4 方法学考察 精密吸取100 μL大鼠空白血浆6份,加入山奈酚对照品贮备液,配制山奈酚浓度分别为22.32、7.44、1.86、0.89、0.60、0.15 μg/mL的质控样品,按血浆样品处理方法操作,进HPLC依次分析,记录峰面积。分别以峰面积(X)为横坐标,浓度(Y)为纵坐标,进行线性回归运算。结果表明,山奈酚在0.149~22.32 μg/mL浓度范围内与其峰面积积分线性关系良好,回归方程为Y=8.07(10-5X+ 0.10,r=0.999 9。浓度为0.83、2.58、22.32 μg/mL的山奈酚质控样品的提取回收率分别为85.74%、95.78%、92.68%;日内精密度分别为2.12%、0.74%、1.62%;日间精密度分别为3.91%、0.54%、1.11%;24 h放置(室温)以及反复冻融3次条件下样品浓度的RSD值均小于5%,符合生物样品定量分析的要求。
2.3.5 测定结果 使用DAS 2.0(BioGuider Co.,Shanghai,China)软件拟合药时曲线并计算药动学参数,大鼠血浆中山奈酚的血药浓度-时间曲线见图3,主要药动学参数见表2。从结果可以看出,EL-DT-KNLC的药时曲线更加平缓,其达峰时间Tmax是DT-KNLC的1.57倍,平均驻留时间是DT-KNLC的1.15倍,差异均具有统计学意义(P<0.05),结果提示肠溶丙烯酸树脂的包覆推迟了药物的达峰并延长了其在大鼠体内的停留时间。

图3山奈酚药-时曲线
表2 山奈酚主要药动学参数
注:与DT-KNLC组比较,*P<0.05。
3 讨论
壳聚糖及其衍生物能够可逆地打开肠道上皮细胞的紧密连接,并且能依靠其良好的生物黏附性与之紧密结合,增加药物的接触时间,减少药物清除,提高生物利用度,因此可作为脂质载体的外部修饰材料[9]。在此基础上,本文进一步尝试将带有负电荷的Eudragit L30D-55肠溶丙烯酸树脂通过静电吸附作用包覆于DT-KNLC的表面,使纳米颗粒获得肠溶特性。为了准确检测大鼠血浆中山奈酚的质量浓度,本研究建立了血浆样品中山奈酚的含量测定方法。据文献[10]报道,山奈酚口服给药后,会在大鼠的肝脏部位发生代谢,与葡萄糖醛酸结合,吸收入血后的山奈酚主要以该结合物的形式存在,因此本研究采用盐酸酸化加热[11]的方式使山奈酚与葡萄糖醛酸解离,并同时加入了抗坏血酸避免药物在加热过程中氧化,最后采用乙酸乙酯进行萃取,最终获得了85%以上的药物提取回收率。
最后,本研究以上述测定方法为手段,比较了EL-DT-KNLC与DT-KNLC在大鼠体内的药动学特征。结果显示,EL-DT-KNLC的药-时曲线发生了明显变化,Tmax和MRT0-t均有显著增加(P<0.05),表明本文制备的山奈酚肠溶复合纳米粒具有小肠定位释放性能,并能够明显延长山奈酚在大鼠体内的滞留时间,具有缓释作用。
