核转录因子-κB通路在BQ-123与单肺通气预处理兔肺损伤中的作用
2020-01-16徐家行陈宝钧刘勇张亚楠殷桂林
徐家行 陈宝钧 刘勇 张亚楠 殷桂林
1华中科技大学同济医学院附属武汉中心医院胸外科(武汉430014);2中国人民解放军中部战区总医院心胸外科(武汉430070)
单肺通气指利用人工管道置入患者或实验动物的气管及支气管内,主动将左、右主气管进行隔离,使患侧或实验侧肺组织不通气而萎陷,只使健侧或非实验侧的肺进行通气的方法。这种通气方式是胸外科手术中为获得更大的手术操作空间及更好的手术视野的一种特殊的呼吸模式[1]。但与此同时,大量实验及临床相关资料表明,在进行单肺通气后,随着未通气侧肺泡组织的萎陷,因其组织形态及血流动力学的相应改变从而导致未通气侧肺组织发生损伤,其损伤程度与单肺通气时间呈正相关[2-4]。
在减轻单肺通气所致肺损伤的研究中,对肺组织进行预处理较为常见,相关的预处理包括药物预处理和单肺通气预处理[5]。药物预处理是指在单肺通气前进行药物提前干预,其中BQ-123是目前在缺血-再灌注领域研究中较热门的一种药物。BQ-123是一种内皮素-1(endothelin-1,ET-1)受体拮抗剂,理论上其可以通过阻断血管内皮素受体而对肺组织起到保护作用[6-8]。预处理在干预缺血再灌注损伤中研究较多,多采用5 min阻断5 min开放的模式进行干预[9]。刘文雄等[10]观察到在肺癌患者开始手术前将患侧肺进行单肺-双肺通气各5 min 3次后,患者肺损伤相关指标有所好转。笔者受到启发后决定对兔使用单肺通气预处理,在单肺通气开始前对实验兔进行单肺通气-双肺通气各5 min 3次循环提前干预,其目的是使萎陷侧肺组织对其后的单肺通气进行预适应,以期于减轻单肺通气时肺组织损伤的程度。但是目前关于单肺通气所致肺损伤的研究中,与BQ-123及单肺通气预处理相关的研究较少,而且针对于两者产生相关作用的信号通路研究更是尚无定论。考虑到核转录因子-κB(nuclear factor-κB,NF-κB)通路是典型的炎症信号转导通路,在调控多种炎症因子发挥重要作用[11-12],本研究拟通过实验探讨BQ-123联合单肺通气预处理对单肺通气肺损伤保护作用及进一步揭示其与NF-κB信号通路的关系。
1 材料与方法
1.1 实验主要器材及主要试剂多功能实验动物呼吸机(EMC2002,北京),3.0带气囊气管插管导管(COVIDIEN Ⅱc,美国),Tunel试剂盒(Roche),General ET ELISA Ki(elkbiotech),Rabbit TNF-α ELISA Kit(优尔生),Rabbit caspase-3 Elisa kit(elkbiotech),SDS-PAGE凝胶制备试剂盒(ASPEN),BCA蛋白质浓度测定试剂盒(ASPEN),ECL化学发光检测试剂盒(ASPEN),Protease Inhibitor Cocktail(Roche)。
1.2 动物及分组本实验所采用实验动物为日本大耳白兔,由武汉市万千佳兴生物科技有限公司提供,15只健康清洁级日本大耳白兔(实验动物许可证号:SCXK(鄂)2016-0011),体质量(2.5± 0.3)kg,性别不拘。大耳白兔饲养于医院实验动物房,单笼喂养,调整室内温度为22~25℃,湿度50%~60%,人工12 h/12 h昼夜周期,自由饮食水。随机对其分为3组进行实验(n=5):O组,通气条件为单肺通气2 h,双肺通气0.5 h。OP组,行单肺通气前予以静脉注射 BQ-123 50 μg/kg[1],通气条件同O组。BP组,在给予BQ-123前肺通气预处理(单肺5 min,双肺5 min)× 3,通气总时间同O组[9]。
1.3 实验动物模型的建立常规术前禁食、禁水,从兔左侧耳缘静脉注射10%水合氯醛注射液(2 mL/kg)进行麻醉,间断予以推注肌松剂阿曲库铵0.1 mg/kg及每40 min静脉推注10%水合氯醛2 mL维持麻醉。常规术区皮肤去毛、消毒,游离右侧颈静脉并放置24 G留置针建立静脉通路,同法游离左侧股动脉并置24 G留置针,外接心电监护仪动脉压力模块用于监测实验兔动脉有创血压情况。甲状软骨下第3个气管环处“T”型切开气管,插入带气管插管导管,连接呼吸机。双肺通气时小动物呼吸机参数设置如下:呼吸频率设置为35次/min,潮气量设置为10 mL/kg,吸呼比设置为1∶1,吸入氧浓度设置为100%。单肺通气时小动物呼吸机参数调整为:呼吸频率设置为40次/min,潮气量设置为8 mL/kg,其余参数同前,并实验中检测兔动脉血气分析,根据其监测的动脉血气分析结果调整小动物呼吸机参数。单肺通气时在兔左侧胸壁外侧第6肋间切开长约1 cm观察左肺萎陷情况,直视下见左侧肺组织由膨胀变为完全萎陷可作为左侧单肺通气模型建立成功。实验过程中室温维持在(26±2)℃,实验中监测兔肛温[13]。
1.4 ELISA法检测兔肺组织中ET-1、肿瘤坏死因子-α(tumornecrosis factor-α,TNF-α)、半胱氨酸天冬氨酸蛋白酶(caspase)-3含量 实验动物在实验结束后通过快速放血法处死,留取左下肺组织大小约1 cm×1 cm×0.3 cm,用生理盐水反复冲洗去除残留血液,将肺组织剪碎并进行匀浆,取其上清液,根据ELISA试剂盒上的说明书步骤进行操作,使用双抗体夹心ELISA法测肺组织中的ET-1、炎症相关因子(TNF-α)、凋亡相关因子(caspase-3)。
1.5 采用TUNEL法计算细胞凋亡指数(apoptoticindex,AI) 取另外一块同等大小兔左下肺组织,生理盐水冲洗后10%甲醛溶液进行固定,制成切片保存。取2 μm切片脱蜡并进行水化,PBS溶液冲洗后用蛋白酶K室温下消化,再用PBS溶液冲洗3次,根据TUNEL试剂盒上面的说明书步骤进行操作。染色后每张玻片在400倍光学显微镜下随机选取5个视野进行观察,分别记录视野中细胞核上染有棕黄色颗粒物质的细胞及细胞总数,根据公式:AI=阳性细胞/细胞总数×100%,对统计值取平均值[14-15]。
1.6 采用Westernblot法测定兔左下肺组织中NF-κBp65及IκBα蛋白表达水平 取同等大小兔左下肺组织标本,予以PBS溶液冲洗去除残血,剪成小碎块后加入组织裂解液,匀浆提取肺组织中的总蛋白,以BCA蛋白质浓度测定试剂盒测定实验样品蛋白浓度。使用SDS-PAGE法将组织样品经行电泳,蛋白凝胶电泳检测组织中NF-κBp65及IκBα蛋白表达水平,以β-Actin为内对照,将胶片进行扫描存档,图像经过AlphaEaseFC软件处理系统分析目标带的光密度值,计算NF-κBp65及IκBα蛋白条带与β-Actin蛋白像素灰度值比值作为蛋白表达相对水平[16]。
1.7 统计学方法采用SPSS 22.0统计学软件对实验所得数据进行统计学分析,实验数据中计量资料以均数±标准差进行表示,组间整体比较采用方差分析,两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 ET-1、TNF-α及caspase-3的含量O组、OP组和BP组之间进行比较,左下肺组织中ET-1、炎症因子TNF-α及促凋亡关键因子caspase-3含量O组最高,OP组较O组下降,但高于BP组,3组之间差异有统计学意义。但OP组与BP组间进行比较,两者之间差异无统计学意义(P>0.05)。见表1。
表1 各肺组织中ET-1、TNF-α及caspase-3的水平比较Tab.1 Comparison of level of ET-1,TNF-α and caspase-3 in the lung tissue of each group(n=5) ± s,pg/mL
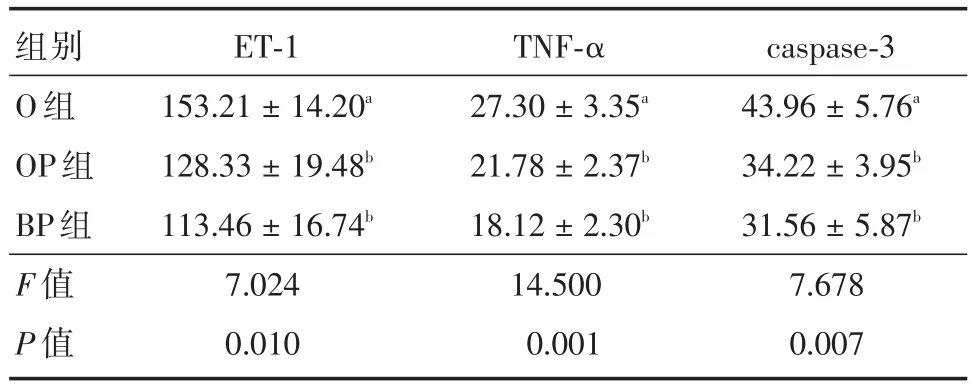
表1 各肺组织中ET-1、TNF-α及caspase-3的水平比较Tab.1 Comparison of level of ET-1,TNF-α and caspase-3 in the lung tissue of each group(n=5) ± s,pg/mL
注:标有相同字母表示组间差异无统计学意义(P>0.05);标有不同字母表示组间差异有统计学意义(P<0.05)
组别O组OP组BP组F值P值ET-1 153.21±14.20a 128.33±19.48b 113.46±16.74b 7.024 0.010 TNF-α 27.30±3.35a 21.78±2.37b 18.12±2.30b 14.500 0.001 caspase-3 43.96±5.76a 34.22±3.95b 31.56±5.87b 7.678 0.007
2.2 肺组织中细胞凋亡率的变化在400倍显微镜下观察,经TUNEL染色后凋亡细胞的核呈棕黄色或深褐色。通过公式计算AI指数,O组最高,OP组较O组下降,但高于BP组。但通过两两之间比较,在OB组、BP组两者之间的差异无统计学意义(P>0.05)。见表2。
2.3 Westernblot实验测定3组兔单肺通气肺组织中NF-κBp65及IκBα蛋白表达 OP组和BP组左下肺组织NF-κBp65表达水平显著下调,NF-κBp65与内参β-actin的灰度比值分别为OB组、BP组,均显著低于O组,其中BP组最低,3组之间比较差异有统计学意义(P<0.05)。但在OB组、BP组两者之间比较,两者之间的差异无统计学意义(P>0.05)。OP组和BP组左侧肺组织IκBα表达水平显著上调,IκBα与内参β-actin的灰度比值分别为OB组、BP组,均显著高于O组,其中BP组最高,3组之间比较差异有统计学意义。同样在OB组、BP组两者之间比较,两者之间的差异无统计学意义(P>0.05)。见图1、表3。
表2 各组兔肺组织中AI的比较Tab.2 Comparison of AI in the lung tissue of rabbits of each group(n=5) ±± s
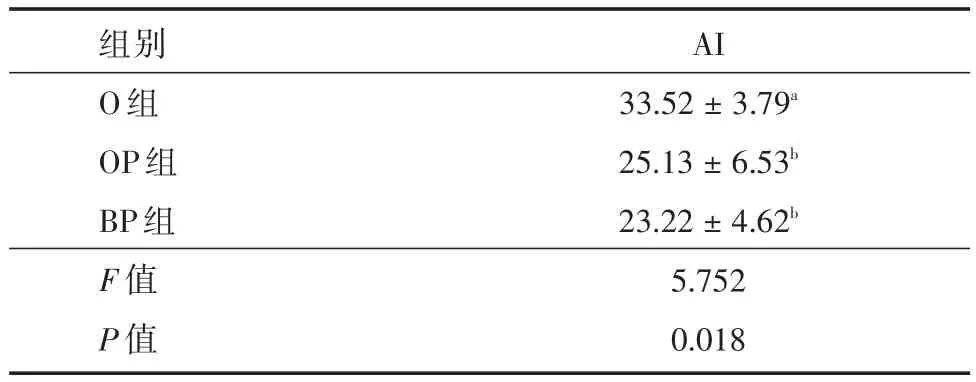
表2 各组兔肺组织中AI的比较Tab.2 Comparison of AI in the lung tissue of rabbits of each group(n=5) ±± s
注:标有相同字母表示组间差异无统计学意义(P>0.05);标有不同字母表示组间差异有统计学意义(P<0.05)
组别O组OP组BP组F值P值AI 33.52±3.79a 25.13±6.53b 23.22±4.62b 5.752 0.018

图1 Western blot法肺组织中NF-κBp65及IκBα蛋白表达Fig.1 Expression of NF-κBp65 and IκBαprotein in lung tissue with Western blot
表3 各组兔肺组织中NF-κBp65及IκBα蛋白表达水平比较Tab.3 Comparison of NF-κBp65 and IκBα protein in lung tissue of each group(n=5)±s

表3 各组兔肺组织中NF-κBp65及IκBα蛋白表达水平比较Tab.3 Comparison of NF-κBp65 and IκBα protein in lung tissue of each group(n=5)±s
注:标有相同字母表示组间差异无统计学意义(P>0.05);标有不同字母表示组间差异有统计学意义(P<0.05)
组别O组OP组BP组F值P值NF-κBP65 0.60±0.09a 0.43±0.05b 0.39±0.06b 13.166 0.001 IκBα 0.12±0.08a 0.60±0.15b 0.64±0.12b 29.153<0.001
3 讨论
单肺通气过程中,肺组织萎陷时,由于失去肺泡表面张力,肺组织出现不同程度损伤[17]。单肺通气所致肺损伤的本质是单肺通气时机械性因素通过相关信号通路导致肺组织产生炎症反应,其基本表现是炎症反应。其中,ET-1为目前研究较多的一种肺损伤相关的重要因子[18],其主要通过与其受体结合而实现作用,除收缩血管外,其还有致血管内皮细胞纤维化,促进活性氧生成并参加氧化应激反应。肺组织内血管丰富,既有肺循环的肺动静脉亦有体循环的支气管动静脉,ET-1含量丰富[19]。本实验中兔进行单肺通气,因肺泡萎陷造成肺泡表面张力以及肺内血管含氧量的改变,从而导致单肺组织内血管形态及血流的改变。因而发生肺损伤的组织中,与血管损伤相关的ET-1含量亦会与损伤程度有关。而本实验不仅对单肺通气肺组织中ET-1含量进行测定,而且实验中使用ET-1受体拮抗剂BQ-123进行干预,其主要目的是通过抗ET-1收缩血管效应,降低毛细血管通透性并减少炎症细胞聚集从而对组织起到保护作用。反映单肺通气后肺损伤严重程度的炎症因子中,TNF-α是目前研究较多的一种[20]。其主要为单核-巨噬细胞分泌的早期炎症递质,可引发炎性级联反应,是炎症反应程度的关键一环其水平的高低可反应组织损伤的严重程度,是有效衡量应激反应的指标。通过本实验相关数据表明OP组和BP两组肺组织中ET-1及TNF-α含量较O组均明显减少,且在BP组中下降更为明显,差异有统计学意义,从而可以进一步推论得出,3组实验动物中,肺组织损伤程度依次下降。
肺损伤的过程中会出现肺组织细胞凋亡,细胞凋亡导致的肺组织细胞丢失可导致肺功能受损,发生细胞凋亡越严重的肺组织内,其肺损伤越严重。细胞凋亡的主要途径是死亡受体通路和线粒体通路,两条通路最终都通过激活caspase-3执行凋亡[20],因而,本实验拟通过测量不同条件下肺组织caspase-3的含量,从而对单肺通气后肺损伤程度进行评定。结果显示,OP组和BP组中促进凋亡的caspase-3蛋白表达较O组中明显降低,且BP组降低更加明显,进一步提示肺通气预处理和BQ123减轻了兔单肺通气后肺细胞凋亡。本研究发现,TUNEL染色显示肺泡及血管内皮细胞呈现凋亡现象,提示细胞凋亡参与了肺损伤。进一步分析凋亡指数,OP组和BP组中的AI较O组中明显降低,且BP组降低更加明显,这与肺组织caspase-3的含量相一致。
NF-κB信号通路是一种细胞核转录因子,其中以p50和p65二聚体的形式最为常见,并可与抑制因子IκB结合。NF-κB信号通路是典型的炎症信号转导通路,NF-κB调控一大类基因的表达,其调控的靶基因包括细胞因子(如TNFα)等,并在调控细胞凋亡、炎症反应等方面发挥重要作用[22-23]。本研究结果显示:O 组肺组织中 NF-κB p65蛋白表达明显升高,IκB蛋白表达降低明显,与OB组及BP组相比,差异具有统计学意义(P<0.05)。NF-κB p65蛋白表达与上文中所提及的ET-1、TNF-α、caspase-3以及 AI呈现出正相关,IκB蛋白表达与上文中所提及的ET-1、TNF-α、caspase-3以及AI呈现出负相关。表明在实验过程中,BQ-123和单肺通气预处理上调了单肺通气肺组织IκB蛋白表达,通过NF-κB信号通路,抑制了单肺通气肺损伤过程中相关的炎症反应与细胞凋亡。
本实验中,先使用ET-1受体拮抗剂BQ-123进行预处理干预,观察其在单肺通气肺损伤中的相关作用,并在此基础上进一步采用单肺通气-双肺通气各5 min 3个周期循环进行预处理,已期于肺组织提前对单肺通气进行适应,从而进一步减轻单肺通气时对肺组织的损伤程度。但是,在实验过程中观察,虽然3组之间差异有统计学意义,但OP组及BP组两组之间进行比较,两者之间差异并不大,分析其可能存在的原因是单肺通气预处理的对肺损伤保护作用相对BQ-123的预处理较弱,两者之间相互叠加作用不明显。
综上所述,经过BQ-123进行干预处理后,兔单肺通气肺损伤明显减轻,在此基础上予以单肺通气预处理,兔单肺通气肺损伤得以进一步减轻;相关数据表明,NF-κB信号通路可能在兔单肺通气肺损伤的发生与发展中起到了关键的作用。
