耐多药肺结核患者外周血CTL细胞抗结核活性的实验研究
2020-01-16刘婷赖惠婷郭夏娜
刘婷 赖惠婷 郭夏娜
1深圳市宝安中医院(集团)/广州中医药大学附属宝安中医院检验科(广东深圳518133);2深圳市宝安区慢性病防治院检验科(广东深圳518100)
2018年,全球确诊为结核病患者中对利福平耐药的患者从2017年的41%上升到51%[1]。由于多药耐药结核病(multidrug-resistant tuberculosis,MDR-TB)和广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB)的与日剧增,对结核分枝杆菌(mycobacterium tuberculosis,MTB)耐药检测手段的局限和治疗上困难,使病程向慢性化发展。有证据表明结核分枝杆菌(mycobacterium tuberculosis,MTB)能在肺空洞中躲避免疫因子的作用并只对抗菌药物有较低的可接触性,从而为耐药性的发展提供了完美的条件[2]。可见MTB感染人体的转归在很大程度上取决于人体免疫状态[3]。免疫功能低下可能是是导致结核病感染慢性化且出现耐药的原因之一,因此,本研究选择研究MTB耐药的免疫学机制,试图从CD8+T淋巴细胞(CD8+T lymphocytes,CTL)为切入点初步探索它们在MTB耐药免疫学机制中的作用,以期为耐药结核病的临床免疫诊断和治疗提供新的理论依据。
1 材料与方法
1.1 研究对象选择2016年2月至2017年9月就诊于深圳市宝安区慢性病防治院,经Ⅹ光检查,痰涂片抗酸杆菌检查,痰结核杆菌培养结合临床症状确诊为初治肺结核患者56例,根据痰标本的XpertgeneMTB/RIF检测结果初步分为原发性耐药组和非耐药组。耐药组(异烟肼和利福平双重耐药)26例,其中男16例,女9例,平均年龄(34.92±11.14)岁;非耐药组(无耐药现象)30例,其中男18例,女12例,平均年龄(33.62±9.93)岁。健康对照组为宝安区健康体检中心的健康体检者30例,其中男18例,女12例,平均(35.38±7.94)岁。对各组性别、年龄比较差异均无统计学意义(P>0.05)。根据实验需要,分别有以下研究对象:经自身MTB刺激的耐药组巨噬细胞(RMTBRMAC)、经自身MTB刺激的非耐药组巨噬细胞(SMTBSMAC)、未经MTB刺激的健康对照组巨噬细胞(NMac)、耐药组CTL(RCTL)、非耐药组CTL(SCTL)以及健康对照组CTL(NCTL)。
1.2 实验材料、试剂淋巴细胞分离液为天津灏洋生物公司产品,完全RPMI-1640细胞培养液为美国Gibco公司产品,台盼蓝染液为北京Solarbio公司产品,穿孔素(perfoin)、颗粒酶B(GranB)、颗粒溶素(Granu)及TLR2的ELISA检测试剂盒为武汉伊莱瑞特生物公司产品,Caspase-3分光光度法检测试剂盒为南京凯基生物公司产品,MB-580型酶标仪和PW-960G型洗板机为深圳汇松公司产品[4]。
1.3 研究方法
1.3.1 MTB分离与培养于药物干预前根据XpertgeneMTB/RIF检测结果收集耐药组和非耐药组MTB,于罗氏培养基37℃,5%CO2至对数生长期,收集菌株,贮存于-70℃。待痰结核杆菌培养和比例法药物敏感试验结果出来后,根据比例法和Xpert gene结果进一步细化实验分组:两者结果均耐药者纳入耐药组(结核菌药敏试验至少对利福平、异烟肼耐药);两者结果均敏感者纳入非耐药组;两者结果不一致者不纳入实验研究范围。每组选取10例临床结核杆菌分离株(如分组时各组大于10例,采取随机数字表随机抽样方法选出10菌株)。
1.3.2 各免疫细胞的分离于药物干预前抽取各组患者EDTA抗凝血6 mL,分离出PBMC,后者进一步分离出巨噬细胞(Mac)和CD8+T淋巴细胞(经抗原刺激活化后即为CTL[5]),体外培养至对数生长期,冻存于-196℃液氮罐中,待MTB培养出后根据细胞生长状态选择生长良好的10株细胞株进行进一步的实验(如大于10株,随机数字表随机抽样10株细胞)。
1.3.3 MTB抗原制备收集耐药组和非耐药组MTB菌株,于罗氏培养基37℃,5%CO2至对数生长期,收集菌株,用无菌PBS洗涤3次后,重悬于PBS。于80℃加热1 h灭菌,用无菌PBS调整细菌浓度至1×106/mL),贮存于-20℃,备用。此菌悬液包含有MTB的可溶性和颗粒性抗原。
1.3.4 检测不同CTL经各组MTB-Ag刺激后分泌各种细胞毒分子的能力于12孔细胞培养板中每孔加入各组Mac(2×105个/mL)及相应组MTB-Ag 1 mL[即耐药组MTB+耐药组Mac(RMTB-RMac)、非耐药组MTB+非耐药组Mac(SMTB-SMac),同时设立未加菌株的健康对照组Mac空白对照(NMac)]培养18 h后,在培养板中每孔加入各组CTL(2×106cells/mL)1 mL,具体实验分组情况如下:SCTL+SMTB-SMac、SCTL+RMTB-RMac、SCTL+NMac、RCTL+SMTB-SMac、RCTL+RMTB-RMac、RCTL+NMac、NCTL+SMTB-SMac、NCTL+RMTB-RMac、NCTL+NMac。上述各组再继续培养4 h后,收集各孔细胞上清液,用ELISA分别检测各上清液中穿孔素、颗粒酶B、颗粒溶素水平。每份标本同时平行检测3次。
1.3.5 检测不同CTL对各组Mac凋亡的影响12孔细胞培养板中每孔加入各组Mac(2×105cells/mL),待其贴壁后加入相应组MTB-Ag 1 mL[即耐药组MTB+耐药组Mac(RMTB-RMac)、非耐药组MTB+非耐药组Mac(SMTB-SMac)],培养18 h后,在培养板中每孔加入各组CTL 1 mL(2×106个/mL),具体实验分组情况如下:SCTL+SMTB-SMac、RCTL+SMTB-SMac、SCTL+RMTB-RMac、RCTL+RMTB-RMac、SMTB-SMac对照、RMTB-RMac对照。上述各组再继续培养4 h后,去除CTL细胞,清洗Mac两次后,加入完全RPMI-1640继续培养4 h,收集细胞上清及Mac细胞。消化收集各实验组内贴壁的Mac,调整细胞浓度为1×105个/mL,按照南京凯基公司的化学发光法Caspase-3检测试剂盒说明书操作检测各组Mac中Caspase-3水平;收集细胞培养上清液,ELISA检测各组巨噬细胞培养上清液中TLR2浓度水平。
1.4 统计学方法实验数据采用SPSS 19.0及GraphPad Prism7.6软件进行分析,计量资料组间差异采用两因素方差分析及独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 模型构建体外模拟耐药组及非耐药组MTB患者体内环境,成功构建MTB-Ag+Mac+CTL的细胞模型后,检测了经耐药组及非耐药组MTB-Ag刺激后各组CTL细胞培养上清中穿孔素,颗粒酶B和细胞溶素的水平及两组MTB-Ag刺激后Mac上凋亡指标TLR2与Caspase-3的水平。见图1、2。
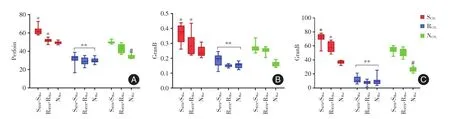
图1 不同MTB-Ag刺激后各组细胞毒分子水平Fig.1 RCTL express lower levels of different groups after adifferent MTB-Ag stimulated
2.2 不同MTB-Ag刺激后各种CD8+T淋巴细胞细胞毒分子水平
2.2.1 耐药患者CTL经自身MTB-Ag刺激后分泌细胞毒分子的能力低于非耐药患者CTLRCTL+RMTB-RMac组上清液中三种细胞毒分子水平小于SCTL+SMTB-SMac(穿孔素t=16.960,P<0.001;颗粒酶Bt=10.953,P<0.001;颗粒溶素t=24.611,P<0.001)。除颗粒酶B(t=1.704,P=0.106)外,RCTL+RMTB-RMac组穿孔素(t=3.529,P=0.004)、颗粒溶素水平小于 NCTL+NMac组(t=12.898,P<0.001)。见图1。
2.2.2 耐药组CTL经不同MTB-Ag刺激后分泌细胞毒分子的水平RCTL+SMTB-SMac、RCTL+RMTB-RMac和RCTL+NMac组的培养上清液中各细胞毒分子水平除去颗粒酶B(F=6.119,P=0.006)以外,穿孔素(F=0.497,P=0.614)、颗粒溶素水平没有差异(F=1.779,P=0.188)。见图1。
2.2.3 三种细胞毒分子的分泌水平非耐药组CTL经耐药MTB-Ag刺激后,分泌三种细胞毒分子的能力显著高于耐药组CTL。虽然SMTB-SMAC及RMTBRMAC均能刺激SCTL上穿孔素,颗粒酶B和颗粒溶素高水平表达,SCTL+RMTB-RMAC组中细胞培养上清液中这些细胞毒分子水平却明显低于SCTL+SMTB-SMAC(穿孔素t=6.513,P<0.001;颗粒酶 Bt=2.558,P=0.02;颗粒溶素t=3.822,P=0.001),可同时又显著高于RCTL+RMTB-RMAC(穿孔素t=14.722,P<0.001;颗粒酶Bt=5.397,P<0.001;颗粒溶素t=20.293,P<0.001)。SCTL与SMTB-SMac,RMTB-RMac,NMac共培养后穿孔素、颗粒酶B和颗粒溶素高水平表达,显著高于RCTL及NCTL组(均P<0.0001)。见图1。
2.3 不同MTB-Ag及CTL对各组巨噬细胞上凋亡指标TLR2与Caspase-3的影响
2.3.1 经不同MTB-Ag刺激后不同组巨噬细胞的TLR2与Caspase-3水平不同组Mac经相应的MTB-Ag刺激后,结果发现,耐药组Mac(RMTB-RMac)的 TLR2(t=4.538,P<0.001),Caspase-3(t=18.136,P<0.001)水平均小于非耐药组(SMTBSMac)。非耐药组CTL对相应组SMTB-SMac的TLR2,Caspase-3刺激作用高于耐药组CTL。SCTL+SMTBSMac与 RCTL+RMTB-RMac相比,TLR2(t=10.030,P<0.001)、Caspase-3有差异(t=18.136,P<0.001)。见图2。
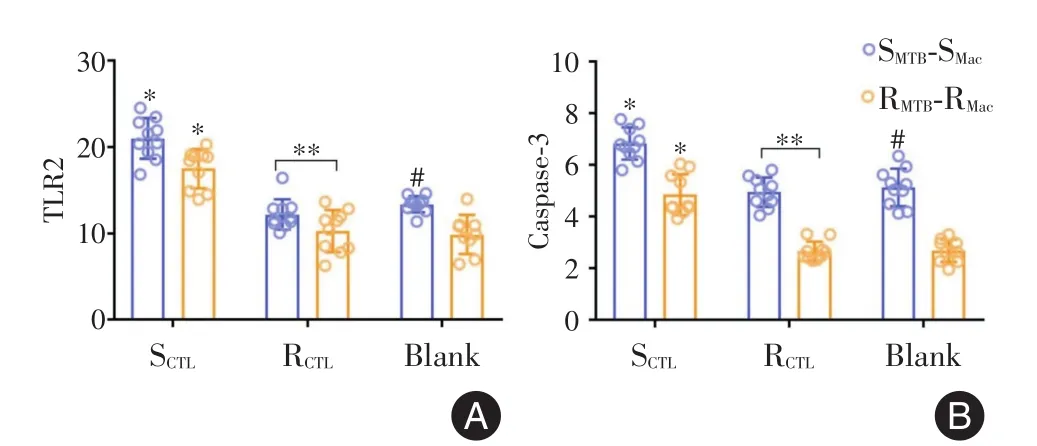
图2 不同MTB-Ag及CTL对各组Mac上凋亡指标TLR2与Caspase-3的影响Fig.2 The effect of different MTB-Ag and CTL on the level of TLR2 and Caspase-3 on macrophage
2.3.2 非耐药病人体外模型与耐药病人模型结果比较非耐药组CTL对相应组SMTB-SMac的TLR2,Caspase-3刺激作用高于耐药组CTL。SCTL+SMTB-SMac与 RCTL+RMTB-RMac相比,TLR2(t=10.030,P<0.001)、Caspase-3差异具有显著统计学意义(t=18.136,P=0.000)。见图2。
2.3.3 非耐药组CTL能提高耐药组RMTB-RMac的TLR2与Caspase-3表达水平SCTL+RMTB-RMac的TLR2(t=6.484,P<0.001),Caspase-3(t=7.657,P<0.001)显著高于RMTB-RMac,也显著高于RCTL+RMTB-RMac[TLR2(t=6.874,P<0.001),Caspase-3(t=9.206,P<0.001)]。见图2。
3 讨论
目前,对结核病的免疫学研究多以CD4+T淋巴细胞为主[5],对CTL在抗结核中的作用关注甚少。越来越多的证据表明CTL在对抗MTB免疫中亦发挥了非常重要的作用[6]。在人MTB感染中,MTB特异性CTL活化在MTB感染4周内就已产生并且能持续至少9个月。
在特异性免疫应答中,巨噬细胞将MTB抗原通过MHC-I类分子提呈给CTL,后者释放溶细胞分子如穿孔素,颗粒酶及颗粒溶素,穿孔素先在细胞膜上打孔以便颗粒酶或颗粒溶素进入细胞成分[6],一旦进入靶细胞,颗粒酶A和B及颗粒溶素,通过Caspase途径触发受感巨噬细胞的凋亡并直接攻击感染细胞中内体/溶酶体中的MTB来减少其生长。
已发现慢性肺结核的发展与感染部分CTL穿孔素和颗粒溶素的减少有关,后者的减少又与CTL成熟障碍相符合[7],说明这些溶细胞分子的增加与MTB生长控制是有关的。而且研究发现缺少了穿孔素的CTL细胞毒功能减弱。这些已有研究证明在宿主CTL对MTB的免疫过程中,穿孔素,颗粒酶等溶细胞分子诱导受感巨噬细胞凋亡起到了关键作用。
本研究观察到耐药MTB刺激其耐药组Mac后再与耐药组CTL(RCTL+RMTB-RMac)共培养后,其分泌三种细胞毒分子水平均显著低于非耐药组(SCTL+SMTB-SMac)。说明耐药结核患者体内分离出的CTL细胞分泌细胞毒分子的功能确实较非耐药组弱。并且即使是在体外培养,耐药MTB也对CTL的分泌能力起到抑制作用。GEFFNER等[8]研究发现MTB耐药菌株M在体外只能激活极低的CTL活性,且脱颗粒信号CD107减少,其后续报道[9]指出经菌株M刺激的健康自愿者CTL仅表现出少量的溶细胞分子和CCL5表达。
本研究发现正常对照组CTL与其相应巨噬细胞(NCTL+NMac)培养后其上清液中也可检测出少量的溶细胞分子水平,推测是由于自身抗原(如体内衰老死亡的红细胞等)被Mac吞噬后引起的一种微弱的免疫反应,但不足以引起机体的免疫应答。然而RCTL+RMTB-RMac组各溶细胞分子的水平与正常对照组无差别,甚至小于正常对照组,说明耐药结核患者机体的免疫应答水平极低,甚至低于正常健康时的免疫耐受状态,这可能是由于耐药结核病患者体内Mac无法正常识别或处理MTB-Ag肽并提呈给CTL引起,也有可能是由于CTL功能缺陷,无法正常分泌细胞毒分子引起的。RCTL作用于SMTB-SMac,RMTB-RMac,Mac空白对照后,其分泌穿孔素与颗粒溶素水平组间差异无统计学意义,这可能由于耐药结核病患者CTL细胞功能受损,在体外单独培养后,也保持免疫缺陷特性,即使是非耐药MTB-Ag刺激,也无法使RCTL发挥正常的细胞毒作用。RCTL经SMTB-SMac和对照组NMac刺激后各细胞毒分子分泌水平不仅显著低于SCTL组,甚至明显低于NCTL组,特别就颗粒溶素,分泌量极低,这进一步说明耐药MTB患者CTL细胞免疫功能受损,其细胞毒活性远低于非耐药MTB患者,且低于正常健康人群。
非耐药组患者外周血中CTL与不同MTB-Ag共培养后,其分泌细胞毒分子水平都显著高于耐药组和正常组CTL,说明非耐药结核患者体内的免疫状态良好,并被积极调动参与到机体对MTB的防御中,即使是在体外培养,SCTL仍能发挥良好的细胞毒作用。当耐药患者MTB-Ag体外刺激相应Mac,再与非耐药MTB患者CTL细胞共培养(SCTL+RMTB-RMac),发现其对SCTL细胞毒作用的激活能力确实较SMTB-SMac组(SCTL+SMTB-SMac)弱。这可能就由于耐药MTB患者其自身Mac在分离之前已经出现免疫损伤,其抗原摄取,处理及提呈MTB-Ag过程中某个环节能力减弱,或者是均有所损伤,从而导致耐药MTB患者的MTB-Ag肽对SCTL的刺激强度不够;或者与CTL结合能力受损,导致其刺激SCTL分泌细胞毒分子的能力较非耐药MTB患者的Mac弱。同时,SCTL+RMTB-RMac的穿孔素,颗粒酶B和颗粒溶素虽然低于SCTL+SMTB-SMac,却远远高于RCTL+RMTB-RMac组,甚至其颗粒溶素及颗粒酶的分泌量还高于NCTL+RMTB-RMac。说明即便是耐药患者Mac可能存在功能受损,能够提呈的MTB-Ag肽有限,SCTL也能对这有限的耐药MTB-Ag刺激产生良好免疫应答。
耐药组Mac上TLR2及Caspase-3水平显著低于非耐药者,其诱导自身凋亡能力减弱。Toll样受体(Toll-like receptors,TLRs)为膜结合的一类模式识别受体(pattern recognize receptors,PRRs),TLR2在抗结核中发挥重要作用。结核分枝杆菌能通过抑制免疫应答来增强其在巨噬细胞的存活期,有部分原因是因为它复杂的细胞壁结构。结核杆菌的脂蛋白能被TLR2识别激活固有免疫细胞,介导抗分枝杆菌适应性免疫,巨噬细胞内P38磷酸化和细胞因子的产生都依赖于TLR2[10]。有研究发现MTB刺激的TLR2能在P38MAPK(p38 mitogenactivatedprotei kinase)持续磷酸化的作用下增强ROS产物,ROS可以通过Caspase途径引起细胞凋亡。移植了已感染MTB的预凋亡Mac后可以增强T细胞免疫并控制感染[11],感染了MTB细胞的凋亡可以增强对细胞内细菌复制的控制并增强特异性CD8+T细胞应答,后者需要凋亡Mac提呈相应MTB抗原,而前面已述CTL可以通过分泌溶细胞分子经Caspase途径促进Mac凋亡。
笔者发现SMTB-SMac上清液中TLR2及Caspase-3水平明显高于RMTB-RMac,说明非耐药组巨噬细胞较耐药组巨噬细胞能更高水平地表达TLR2及Caspase-3,进而更好的识别,吞噬MTB-Ag并提呈给CTL,并且能更好地促进已吞噬了MTB的巨噬细胞的凋亡;在SMTB-SMac,RMTB-RMac分别加入相应CTL后,发现SCTL+SMTB-SMac细胞上清液中TLR2(t=6.735,P< 0.001)及Caspase-3(t=5.602,P<0.001)水平明显高于SMTB-SMac,而RCTL+RMTB-RMac与,RMTBRMac没有统计学意义(TLR2(t=1.536,P=0.142)Caspase-3(t=0.089,P=0.930),这反应出可能在耐药结核患者机体内RCTL并不能上调对Mac表达TLR2,但是非耐药结核患者的SCTL具有这种正向调节能力。SCTL+SMTB-SMac与RCTL+RMTB-RMac相比较更是差异显著。说明SCTL与吞噬了SMTB的巨噬细胞结合后,可以上调其表达TLR2,更有助于后者将MTB-Ag提呈给SCTL,发挥SCTL细胞免疫功能。以上两点进一步说明在非耐药结核患者体内无论是CTL还是Mac的细胞免疫功能都高于耐药结核患者。
同时,在实验中观察到SCTL作用于RMTB-RMac(SCTL+RMTB-RMac)后,后者 TLR2与Caspase-3水平明显较RCTL+RMTB-RMac提高。因此笔者大胆推测SCTL能够促进RMTB-RMac的自身凋亡,从而达到杀伤清除吞噬在其内体中的耐药MTB。
综上,经耐药MTB-Ag致敏的耐药CTL细胞分泌穿孔素,颗粒酶B和细胞溶素的能力及其Mac上TLR2和Caspase-3表达确实显著低于非耐药MTB-Ag致敏的SCTL,说明耐药MTB的耐药特性与其能使CTL活性受损且不能有效诱导巨噬细胞凋亡,进而逃避机体的免疫应答有一定关系;同时实验发现将非耐药肺结核患者的CTL与耐药MTB-Ag共同培养后上述溶细胞分子分泌水平明显高于耐药患者的CTL,且耐药Mac上TLR2和Caspase-3表达也大幅提高。当然,本实验仅仅是对异烟肼和利福平双重耐药肺结核患者的CTL的抗结核免疫功能作了一个初步探讨,其具体还涉及到哪些免疫分子和信号传导通路,尚未可知,还有待进行一步研究。
