叶酸诱导肾损伤的小鼠肾组织水通道蛋白表达随病程迁延而减少
2020-01-16邢佳黄宇颖陈慧云王恺悦翟效月
邢佳,黄宇颖,陈慧云,王恺悦,翟效月*
(1中国医科大学组织胚胎学系,2中国医科大学第二临床学院,沈阳110122)
叶酸(folic acid, FA)诱导肾损伤模型目前被广泛应用于研究肾小管来源的急性(2d)转慢性(14d)肾损伤与肾小管间质纤维化的发病机制。随着FA晶体快速出现在肾小管中,其本身的直接细胞毒性及物理堵塞导致管状上皮细胞损伤[1]。肾脏作为调节机体水平衡的主要器官,水通道蛋白(aquaporin,AQP)的主要成员AQP-1和AQP-2在上述肾损伤模型中的变化尚无报道。
正常肾脏中,AQP-1主要表达于近端小管、长髓襻降支细段的细胞膜游离面及侧基底面,以及髓质直小血管下降支内皮细胞膜上,介导原尿中60%~80%水分的吸收[2-4]; 而AQP2主要表达于连接小管及集合管主细胞游离面细胞膜或胞质内囊泡[5,6]。在顺铂诱导的大鼠多尿模型中,AQP-1和AQP -2表达明显降低[7]。但是,免疫组织化学技术显示大多数病变肾脏的肾小球及肾小管上AQP-1表达上调[8,9],这表明不同损伤导致肾损伤部位及病理改变不同。
在FA诱导急性转慢性肾损伤模型中尚无相关研究。本研究通过检测AQP-1和AQP-2在FA诱导肾损伤后2d、7d、14d的表达水平变化,探讨AQP在FA肾损伤模型中的作用及对肾小管水重吸收的调节能力。
材料与方法
1 实验动物及FA诱导肾损伤模型的建立
C57BL/6雄性小鼠(6周龄)购买自辽宁长生生物,在标准SPF级环境饲养一周后造模。造模当日上午8:00称量体重。于11:00予以腹腔注射FA 250mg/kg(溶于0.3mmol/L NaHCO3)。小鼠饲养于(21±1)℃,湿度 50%±10%的环境,保持 12h 的明/暗光照周期,并提供充足的水和食物,分别于2d、7d、14d时在代谢笼中收集24h尿液,待麻醉后眼球取血,经心脏灌流取肾脏,每个时间点各10只。本动物实验按照世界医学会伦理标准,并获得中国医科大学医学伦理委员会批准。
2 实验试剂
抗体:兔抗AQP1抗体(ab65837,Abcam,Cambridge,UK)、兔抗AQP2抗体(A7310,Sigma);山羊抗兔(P450,DAKO,Glostrup,Denmark);
试剂:叶酸(F7876,sigma)、牛血清白蛋白(A1933,Sigma)、DAB试剂盒(ZLI-9017,北京中杉金桥),糖原PAS染色试剂盒(G1281,索莱宝,中国)。
3 肾脏石蜡切片标本制备
实验小鼠腹腔注射1%戊巴比妥钠(2mg/kg)。麻醉后,通过心脏灌流4%多聚甲醛后取出肾脏,置于4%多聚甲醛连续固定48h,取出修块,梯度乙醇脱水,二甲苯透明,石蜡定向包埋,石蜡切片机(徕卡 RM2245, 德国)制备3~5µm切片。
4 PAS染色
将正常对照鼠、FA 2d、FA 7d、FA 14d小鼠肾脏石蜡切片置于二甲苯中脱蜡,高至低浓度乙醇水化,蒸馏水洗3次,每次5min。切片置于氧化剂(试剂A)中,室温放置6min,后经自来水洗2min,蒸馏水浸洗2次,暗室环境下置于Schiff Reagent(试剂B)浸染15min,自来水洗10min。置于苏木素中染色液(试剂C)中1min,酸分化液中(试剂D)分化3s,自来水洗10min,使其返蓝,逐级梯度增高乙醇脱水,二甲苯透明,中性树胶封固。
5 Masson染色
将正常对照鼠、FA 2d、FA 7d、FA 14d小鼠肾脏石蜡切片脱蜡、水化后,蒸馏水洗3次,每次5min。切片置于Masson丽春红酸性复合染液中15min,0.2%醋酸浸洗3次。以5% 磷钨酸溶液分化7min,0.2%醋酸洗3次,后经甲苯胺蓝染3min,0.2% 醋酸浸洗3次,逐级梯度增高乙醇脱水,二甲苯透明,中性树胶封固。
6 免疫组织化学染色检测AQP-1和AQP-2表达特点
将正常对照鼠、FA 2d、FA 7d、FA 14d小鼠肾脏石蜡切片脱蜡、水化,PBS洗3次,每次5min。切片经微波修复抗原(柠檬酸盐修复液),常温下PBS(3% BSA、0.05%皂苷、0.2%明胶、PH7.4)预孵育30min后,滴加AQP-1抗体(1:1500)和AQP-2抗体(1:1500),湿盒内4℃过夜。室温PBS洗3次,3% H2O210min封闭内源性过氧化物酶,PBS(0.1% BSA)洗3次,每次10min。随后滴加山羊抗兔(1:200),常温下孵育1h,PBS滴洗3次,每次10min。蒸馏水洗5min,DAB显色1~3min,苏木素复染25s后1%盐酸酒精分化3s,流水冲洗20min返蓝,经梯度乙醇和二甲苯脱水、透明、中性树脂封片。以PBS代替一抗作阴性对照,最终在显微镜(Nikon90i,日本)下采集图像。
结 果
1 FA诱导肾损伤模型鼠的肾组织结构发生破坏及其变化特点
PAS和Masson染色结果显示,正常对照组刷状缘及基底膜均为紫红色染色,代表糖原或糖蛋白沉着(图1A)。与正常对照组相比,FA 2d的肾皮质及外髓外带近端小管受损严重,表现为结构紊乱、细胞肿胀并呈现水变性及空泡变性,崩解的细胞碎屑与刷状缘脱落于管腔(图1B)。相较于FA 2d和FA 7d皮质小管结构恢复至接近正常,小管上皮较正常组薄,管腔扩大,管周间隙增大,胞质少,且胞质及核均浓染(图1C)。FA 14d皮质浅层及中层小管普遍扩张,近端小管结构再次紊乱,与FA 2d相似,而髓放线中远端及集合管结构排列整齐,类似于FA 7d恢复中的近端小管,即管腔扩张、管壁变薄,胞质及核深染(图1D);此时,PAS阳性的小管基底膜增厚,而Masson染色显示管周间隙中纤维成分有沉积,呈蓝色(图1D)。

图1 PAS及Masson染色显示肾脏组织结构。A,正常对照组PAS染色,插入框为对应Masson染色局部图;B,FA 2d PAS染色;C,FA 7d PAS染色;D,FA 14d PAS染色,插入框为Masson染色局部图;星号,近端小管;双黑箭头,刷状缘脱落;单黑箭头,基底膜间断性断裂;白箭头,上皮细胞水变性和空泡变性;无尾黑箭头,增宽的管周间隙;比例尺,25μmFig. 1 Renal microstructure of normal and FA induced renal injury mice with PAS and Masson staining. A, PAS staining of control group, insert box corresponding to local Masson staining figure; B, PAS staining of FA 2d; C, PAS staining of FA 7d; D, PAS staining of FA 14d, insert box corresponding to local Masson staining figure;asterisk, proximal tubule; double black arrows, deciduous brush border; single black arrow, discontinuous rupture of basement membrane; white arrow, hydropic and vacuolar degeneration in the epithelial cells; tailless black arrow, widened interstitium between tubules;scale bar, 25μm
2 FA诱导肾损伤模型鼠肾的AQP-1和AQP-2表达变化规律
正常小鼠中,AQP-1表达于近端小管的腔面和侧基底面及髓襻降支细段,在皮髓质中,广泛分布于微动脉内皮细胞膜表面,包括髓质中的直小血管下降支(图2A1);而AQP-2则表达于皮质中的连接小管及贯穿皮髓质走行的集合管主细胞表面(图2A2)。
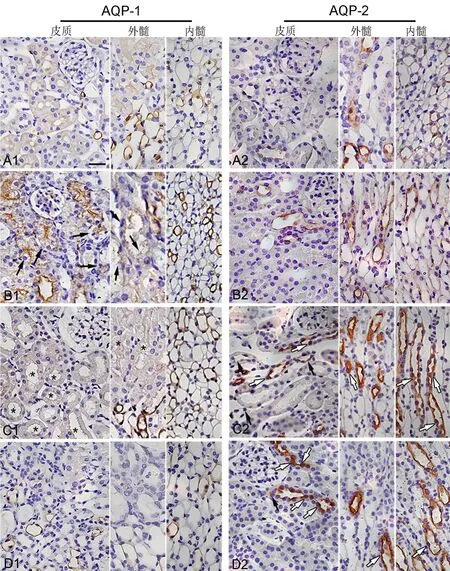
图2 正常及FA诱导肾损伤模型鼠肾的AQP-1和-2免疫组织化学染色。A1和A2,分别为正常对照鼠肾AQP-1和-2表达; B1,C1和D1,分别为FA 2d、FA 7d、FA 14d AQP-1表达;B2,C2和D2,分别为FA 2d、FA 7d、FA 14d AQP2表达;黑箭头,损伤严重近端小管和集合管细胞几乎不表达AQP-1和AQP-2;白箭头,AQP-2在集合管顶部的胞质部分表达明显增多;比例尺,25μmFig. 2 Immunostaining of AQP-1 and AQP-2 in the kidney of FA induced renal injury mice and normal mice. A1 and A2, immunohistochemical staining of AQP-1 and AQP-2 in control normal mice, respectively; B1, C1 and D1, immunohistochemical staining of AQP-1 in the kidney of FA induced renal injury mice on FA 2d、FA 7d、FA 14d, respectively; B2, C2 and D2, immunohistochemical staining of AQP-2 in the kidney of FA induced renal injury mice on FA 2d、FA 7d and FA 14d, respectively; black arrow, almost nonexistent of AQP1 and AQP-2 in seriously damaged proximal tubule and collecting tubule cells; white arrow, AQP-2 was signi ficantly increased in cytoplasmic portion at the apical part of the collecting duct principal cells; scale
FA 2d时,皮质及外髓外带结构紊乱的近端小管上皮细胞仍然表达AQP-1,但空泡变性严重的细胞则无AQP-1表达。内髓直小血管及髓襻降支细段的AQP-1表达不受影响,甚至呈现增强。此时,AQP-2在集合管主细胞上的表达未受明显累及,几无变化(图2 B1与B2)。
相较于FA 2d和FA 7d皮质的小管损伤较之前减轻,AQP-1仅弱表达在结构相对较好的近端小管腔面,包括外髓外带;但基底侧面阳性更弱。此时,AQP-2在集合管从皮质到髓质都呈强阳性。
FA 14d时,皮质及外髓小管结构再度紊乱;与FA 2d相比,此时肾组织间质细胞成分增加,小管管壁变薄,以至于很难区分小管节段。整个皮髓质AQP-1仅在少量残存的上皮细胞呈弱阳性表达。此时,集合管较FA 7d时显著扩张,AQP-2在主细胞表达增强,且在顶部的胞质部分明显增多。
讨 论
叶酸诱导肾损伤模型目前被广泛用于研究急性肾损伤及慢性间质纤维化,尽管其与碳酸氢钠混合使用可碱化尿液而减少结晶形成导致的小管堵塞,但其本身的直接毒性及结晶导致的小管堵塞仍使管状上皮细胞受到损伤[10,11],因此,FA常被用于研究以肾小管毒性损伤为主要来源的急性(FA 2d)转慢性(FA 14d)肾损伤的模型,而且FA诱导剂量高低与肾损伤程度密切相关。
本研究中,FA 2d时出现肾小管结构紊乱,尤其以近端小管为严重,出现大量水变性甚至空泡变性的上皮细胞,而集合管未受到明显累及,提示肾脏损伤处于急性期[12]。此时,近端小管仍然表达AQP-1,且由于细胞塌陷,其表达可能会表现得较强,但部分管腔已经被崩解的上皮细胞填塞,加之细胞呈现变性改变,功能会削弱,临床上仍会表现为少尿。当肾小球滤过液在近端小管未能被重吸收时,细段和直小血管下降支为适应损伤,维持正常尿液的浓缩功能,反而增强了AQP-1的表达。
FA 7d时,肾组织结构恢复到接近正常,近端小管变性坏死的细胞较FA 2d减少。此时,近端小管结构虽然完整,但是胞质少,故上皮变薄,胞质及核浓染,AQP-1弱阳性表达,提示小管正经历自我修复。此外,与正常结构不同的是,管周间隙扩大,可能与急性损伤期部分塌陷的小管无法修复导致肾单位萎缩或丢失有关。
FA 14d时,AQP-1在近端小管的表达持续减少,髓质的表达虽增强但阳性小管数目却减少,此时,集合管主细胞受到累及,集合管较FA 7d扩张,少量细胞出现空泡变性,此时AQP-2不仅表达在主细胞细胞膜,在顶部的胞质部分也明显增多,这可能是因为AQP2在细胞内囊泡表达升高,以适应损伤。然而,即使幸存的小管细胞再生修复,但潴留的FA仍持续损伤小管,且部分损伤小管上皮细胞可能转分化形成肌成纤维细胞,分泌细胞外基质。因此,Masson染色可见沉积的胶原纤维,提示损伤的肾可能已经形成纤维化[12,13,14],进一步加重了近端小管、降支细段和集合管损伤,此时,AQP-1和AQP-2的表达均明显减少。
综上所述,FA诱导肾损伤模型中,近端小管损伤较集合管早,急性损伤后坏死的上皮细胞不再表达AQP-1,残存的近端小管及降支细段的上皮细胞通过增强AQP-1表达以适应损伤,在形态学上也观察到肾脏在FA 7d有短暂的修复期。然而,持续的损伤导致肾脏修复不良,集合小管也受累,AQP-2代偿性的在残存集合小管细胞内囊泡的表达升高。表明AQPs参与了肾小管来源的急性(FA 2d)转慢性(FA 14d)肾损伤的发病机制,这为深入研究肾损伤的水平衡能力提供了新的途径。
