Hippo信号通路在肿瘤免疫中的作用
2020-01-16陈庆朱安平李正平王媛殷焦沈关心
陈庆,朱安平,李正平,王媛,殷焦*,沈关心
(1中国人民解放军联勤保障部队第991医院 441010;2湖北文理学院医学院 襄阳 441053;3华中科技大学同济医学院免疫学系 武汉,430030)
Hippo通路最早在果蝇研究中被发现,主要通过调控细胞的增殖和凋亡,进而控制组织器官生长体积的大小。Hippo通路相关的信号分子亦参与免疫应答反应,在哺乳动物中发挥免疫调节作用等。近年研究发现Hippo信号通路与肿瘤的发生密切相关,成为新的研究热点。Hippo通路在肿瘤的发生中发挥至关重要作用,推测其功能障碍可能是肿瘤发生的初始因素之一。本文就Hippo通路相关信号分子在肿瘤免疫中的作用进行综述,旨在深入了解Hippo通路的重要功能,为其作为临床研究抗肿瘤的潜在靶点提供依据。
1 保守的Hippo信号通路
Hippo通路是组织器官体积大小的保守信号通路,同时还可以调节多种生物学功能,包括细胞生长、控制组织器官体积大小,以及干细胞的自我更新等[1,2]。
在果蝇研究中鉴定的Hippo通路有4个主要激酶 成 分:Hippo(Hpo)、Salvador(Sav)、Warts(Wts)和Mob肿瘤抑制因子(Mats);其中任何一个成分失活都会促进细胞生长和抑制凋亡,导致细胞无限制增殖。Hpo-Sav形成复合体通过磷酸化Wts-Mats复合体而激活肿瘤抑制通路,有效控制细胞的增殖。果蝇体内Hippo通路的核心是Yorkie (Yki)蛋白,Yki激活后会发生Hpo/Sav-Wts/Mats轴失去效应,导致细胞的大规模增殖[3];Hpo-sav诱导的Wts磷酸化,继而引起Yki磷酸化,磷酸化Yki增加,滞留在细胞质而无法进入细胞核,使细胞分裂增殖被抑制。
在哺乳动物,Hippo通路每个激酶成分对应的信号分子分别是:MST1/2对应Hpo,SAV1对应Sav,LATS1/2对应Wts,MOB1对应Mats,Hippo信号通路由这4个主要的激酶调控Yes相关蛋白 (Yes-associated protein, Yap)及其旁系同源蛋白TAZ的活性。Yap和TAZ在哺乳动物为肿瘤蛋白,与果蝇的Yki是同源蛋白。
当Hippo通路激活后引起Mst 1/2 活化,与支架蛋白Savl组成复合物使Lats1/2 (large tumor suppressor ; LATS)激酶磷酸化并被激活,与另一支架蛋白Mob1组成复合物,直接使Yap蛋白上S127被磷酸化后产生一个14-3-3的结合基序,与胞浆中的14-3-3蛋白结合而滞留在胞浆中,或进一步被磷酸化后通过蛋白酶体途径被降解[3]。
非磷酸化状态的Yap进入细胞核后,与转录因子结合,发挥其生物学作用。目前公认的转录因子是TEA-domain (TEAD)和p73。核内Yap/TAZ与TEAD结合,促进或抑制TEAD靶基因的表达,如CTGF(connective tissue growth factor,结缔组织生长因子)和Cyr61(cysteine-rich protein 61, 富半胱氨酸肝素结合蛋白61),调节多种生物学功能。例如,发生细胞接触抑制,即当细胞密集接触时,Hippo通路活化,Yap/TAZ磷酸化水平增加、与细胞核隔离,其细胞增殖作用消失;细胞分离时,Hippo通路失活、促进Yap/TAZ迁移至细胞核引导细胞的分裂增殖[4]。Yap/TAZ 是Hippo通路主要的转录辅激活因子,其在细胞核与细胞质之间的位置转移决定Hippo是否被有效激活。
2 Hippo-Yap信号通路与肿瘤免疫
炎症反应的微环境诱导发生有害的突变,使机体发生各类肿瘤的机率大大增加。微环境中的免疫细胞和肿瘤细胞之间一直都在发生相互作用。
研究报道[5]在多种肿瘤组织中发现核内Yap的表达增高,Yap的活性与肿瘤的发生和发展密切相关,肿瘤发生的每个阶段都有过量Yap激活,因此Yap被确定为肿瘤蛋白,与Hippo-Yap通路功能障碍相关所发生的肿瘤称为Yap依赖的肿瘤(Yap-independent cancer)。Hippo通过调控下游蛋白Yap的表达影响肿瘤发生与发展。体外实验报道Hippo信号通路功能失调的肝细胞会发展成恶性肿瘤。
2.1 Hippo-Yap通路与TIC募集巨噬细胞相关
肿瘤发生最初阶段是以单个肿瘤启动细胞(tumor-initiating cell,TIC)存在的时期,活化状态的Yap有助于TIC募集巨噬细胞保护肿瘤细胞、使之免于免疫清除。
正常情况下,TIC微环境中的炎性细胞因子以及IFN等促进树突状细胞成熟、活化以及抗原交叉呈递,扩大并活化效应性CD8+T细胞克隆,从而确保免疫监视及免疫清除。最近研究[6]发现肝细胞MST1/2缺失会引起相关的Yap过表达,直接并显著增强肝细胞分泌单核细胞趋化蛋白-1(monocyte chemoattractant protein,MCP-1),促进巨噬细胞大量浸润(图1a),M1和M2表型混杂。动物实验中证明,转基因表达过量Yap蛋白,沉默MST1/2或敲除SAV1的小鼠发生肝脏肿大,并最终致肝细胞癌(hepatocellular carcinoma,HCC)发生发展。Yap的去除可抑制MST1/2-dko小鼠MCP1表达,恢复正常的肝脏生长。MCP1是肝细胞中Yap的直接转录靶点,在人肝癌中Yap靶点和MCP-1之间存在强基因表达相关性;肝细胞中的Hippo信号通过抑制Yap依赖的MCP1表达,抑制肿瘤前微环境形成过程中巨噬细胞的浸润,维持正常的肝脏生长抑制HCC增殖,为治疗肝癌提供了新的靶点[6]。
赵斌课题组研究发现肝细胞中Yap的激活诱导集落刺激因子1(colony stimulating Factor,CSF-1)和C-C Motif趋化因子配体2(C-C Motif Chemokine Ligand 2,CCL2)两个趋化因子的表达,招募M2型巨噬细胞至TIC周围(图1b),抑制效应T细胞,促使TIC逃逸免疫监视,避免被清除[7]。因此尽管炎症局部微环境中发生着免疫反应,对于癌细胞却依然如“培养基”般使之“茁壮成长”。Hippo通路的激活抑制Yap-TEAD复合物形成,抑制TIC相关巨噬细胞的招募,减少释放对TIC有保护作用的分子,有助于肿瘤杀伤细胞更加有效的发挥作用。这项研究首次证明巨噬细胞在体内单个TIC的存活中起着决定性作用并为通过靶向Yap或巨噬细胞消除TIC提供了原理证明。
Treg细胞的聚集也在TIC的微环境中介导肿瘤细胞的免疫逃逸。研究发现胃腺癌中Hippo通路成分Lats2、Yap的表达与浸润性Treg细胞计数以及肿瘤Foxp3的表达正相关。Hippo通路通过磷酸化Yap,减少浸润性Treg细胞数量并降低其活性,有助于机体的抗肿瘤免疫,抑制TIC增殖[8]。
2.2 Hippo通路与MDSCs相关
肿瘤细胞最初成功的免疫逃逸导致肿瘤的继续发展,与此同时机体针对肿瘤组织发生免疫细胞的浸润;一部分细胞发挥监视并清除突变细胞的功能,另一部分以髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)为代表的免疫细胞则促进机体产生免疫耐受反应。在有关前列腺癌的研究中发现抑制Hippo通路,Yap-TEAD复合物形成增加,进而上调MDSCs的趋化因子CXCL5的分泌[9],促进肿瘤细胞微环境中表达趋化因子受体CXCR2的MDSCs的募集,抑制免疫系统对肿瘤细胞的清除(图1c)。Murakami等随后在胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)小鼠模型研究中发现类似结果,且与临床中观察到的PDAC数据一致[10]。Sarkar等在高分化浆液性卵巢癌小鼠模型研究中还发现Yap作用于肿瘤基因PRKCI,进而上调肿瘤坏死因子α(tumor necrosis factor ,TNF-α)的表达,募集MDSCs,抑制细胞毒性T细胞(cytotoxic T cell,CTL)功能[11]。
2.3 Hippo信号通路与PD-L1相关
从单个TIC的形成到发展为恶性肿瘤的整个过程中,Hippo信号通路的抑制有助于肿瘤从宿主免疫监测中逃逸,特别是在Yap相关的肿瘤发生中。参与调节免疫监测的重要分子程序死亡配体1(programmed death ligand,PD-L1),与PD-1的相互作用诱导并维持T细胞耐受,延长肿瘤细胞的存活(图1d)。
在非小细胞肺癌的研究[12]提示Hippo-Yap信号与PD-L1密切相关,细胞核内Yap-TEAD复合物的形成促进肿瘤细胞PD-L1的表达,进而可导致免疫监控系统对恶性肿瘤细胞的失能。在肿瘤组织中Yap和PD-L1表达显著相关,表达高水平PD-L1细胞系中,磷酸化Yap/Yap的比率低,抑制Yap可降低PDL1的mRNA和蛋白水平;Yap基因的强制过度表达提高PD-L1的mRNA和蛋白质水平。染色质免疫沉淀(CHIP)分析使用Yap特异性单克隆抗体导致PD-L1增强子区域的沉淀,包括两个假定的TEAD结合位点。
在人乳腺癌和肺癌细胞系体外模型研究中均证实TAZ和PD-L1蛋白水平的相关性,表明Hippo通路效应因子YAP和TAZ直接上调PD-L1的表达,抑制抗肿瘤T细胞免疫反应[13]。CHIP和荧光素酶检测发现TAZ/YAP/TEAD复合物增强PD-L1 启动子活性,共培养实验证明其在肿瘤细胞免疫逃逸中的具有重要意义。Lee等认为[14]Yap是人类肺腺癌细胞PD-L1表达的转录调控因子;表皮生长因子受体(epidermal growth factor receptor,EGFR)酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的耐药与Yap、PD-L1表达具有相关性;Yap敲除的肿瘤细胞PD-L1表达水平降低;上游调节因子(PI3K、RAF)和Hippo通路中的信号分子(MST1/2, LATS1/2)也可调控PD-L1的表达。Hippo信号可能通过调控PDL1的表达参与免疫逃避。但这种调节机制尚未在小鼠细胞系模型中发现。
Feng等研究证实Hippo信号在人类肺腺癌中的表达受细胞外环境pH值的影响,进而导致TAZ介导的PD-L1上调。在肿瘤乳酸水平和PD-L1表达相关性研究模型中,G蛋白偶联受体 81 (G-protein-coupled receptors, GPR81)通过细胞内cAMP的耗竭启动乳酸诱导的PD-L1上调水平,抑制蛋白激酶A(protein kinase A, PKA),激活Yap/TAZ; Hippo信号通过PD-L1介导局部免疫抑制,重塑肿瘤微环境;Yap/TAZ抑制肿瘤细胞外围的适应性T细胞对肿瘤细胞免疫应答反应;肿瘤细胞可能通过局部微环境中物理、生化刺激Hippo信号调控PD-L1表达以逃避免疫清除[15]。
3 Hippo信号通路中Yap磷酸化存在的争议
Hippo信号通路发挥效应的核心归因于Yap磷酸化,磷酸化的Yap决定Hippo信号是否激活或失效。其他激酶也可调节磷酸化Yap水平和活性。如胞浆中Yap 在S127上磷酸化后使之滞留在细胞质,或进一步被酪蛋白激酶1(casein kinase 1,CK1)磷酸化、并通过蛋白酶体使其降解;在S381上磷酸化会导致Yap的降解;在Y357上磷酸化可诱导细胞凋亡,但在Yes1上的磷酸化会诱导抗凋亡作用[16,17]。细胞所处环境以及磷酸化的位点不同而产生不同效应[18],因此Hippo-Yap信号通路在某些情况下表现出双重性。
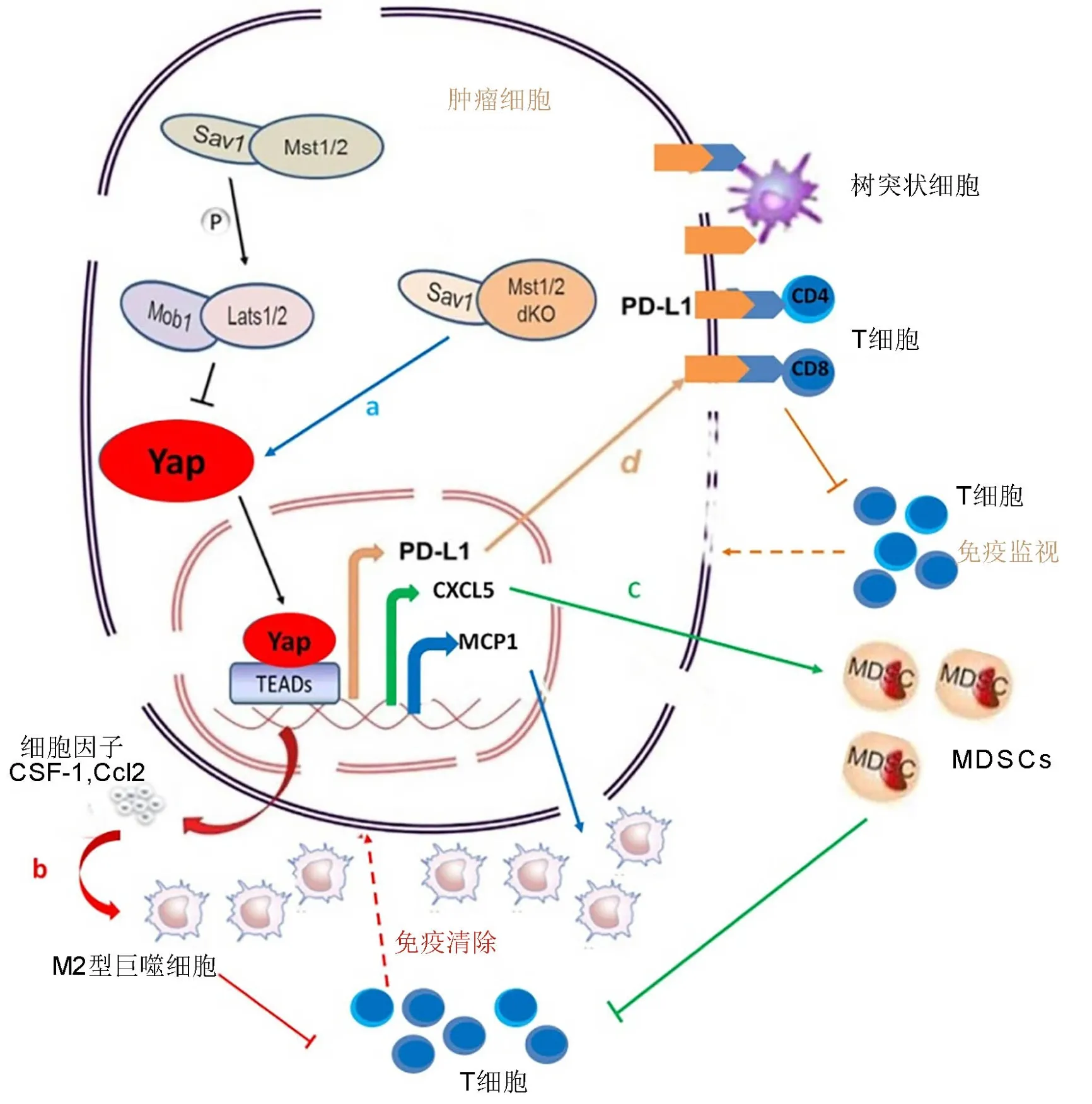
图1 Hippo通路与肿瘤免疫。a,dKO MST1/2诱导Yap依赖的MCP1过表达,促进肿瘤相关巨噬细胞聚集;b,单个肿瘤细胞调节Hippo通路并激活Yap,表达细胞因子并招募II型巨噬细胞,抑制T细胞免疫清除; c,活化的Yap提高了Cxcl5水平,促进MDSCs招募和T细胞抑制;d,Yap通过促进PD-L1的表达使肿瘤细胞逃避宿主免疫监视,抑制细胞免疫Fig. 1 Hippo pathway is involved in tumor immunology. A, dKO MST1/2 induced the Yap-dependent MCP1 overexpression and promoted the aggregation of tumor-related macrophages; b, a the tumor cell can modulate Hippo pathway to activate Yap, and thus express certain cytokines and recruit type II macrophages, which prohibit immune clearance of T cells; c, activated YAP raises Cxc15 level, so MDSCs are recruited and T cells are suppressed;d, Yap promotes the expression of PD-L1 to enable tumor cells to evade host immune surveillance and suppress cellular immunity
对于非Yap依赖的肿瘤研究发现,有研究证明Yap可抵消主导肠组织自我更新和再生的信号通路Wnt/β-catenin通路的促肠组织的再生的作用[2];在淋巴瘤、骨髓瘤等恶性血液病中Yap通过与p53的同源基因p73相互作用,促进肿瘤细胞发生凋亡[19]。除了Yap,Hippo信号通路的上游成员LATS1/2也表现为两方面的作用[20]:LATS1/2磷酸化Yap,促进其细胞质隔离以及限制细胞增殖;但LATS1/2失活会促发针对自身细胞的免疫反应,进而破坏LATS1/2沉默的相应细胞,维持个体的免疫稳态。
Moroishi等人提出Hippo通路的分子LATS1/2缺失引发抗肿瘤反应[20]:尽管LATS1/2作为Hippo通路中Yap的上游信号分子,通过磷酸化Yap防止核易位,但其敲除后引发的抗癌反应远远强于激活Yap引发的促生长效应。LATS1/2敲除的细胞在体外实验中表现出更强的增殖能力,表明细胞生长的最初并不依赖于Yap过表达或Hippo通路功能障碍。LATS1/2敲除的肿瘤细胞通过分泌更多富含核酸的细胞外囊泡(extracellular vesicles,EVs),进而激活Toll样受体(Toll-like receptors,TLRs)。下游涉及TLRs的内源性核酸通路被激活,进而激活免疫应答,这项研究证明LATS1/2敲除的细胞引导机体发生更强大的免疫反应消灭自身。
4 展望
综上所述,越来越多Hippo通路相关的分子机制的发现拓宽了研究视野,复杂的微环境可能导致Hippo通路作用的多重性,Hippo通路的调节处于动态调节的过程,以调控细胞的增殖与凋亡的平衡,以及内环境的稳定;Hippo信号在不同的环境中发挥不同效应,其详尽机制仍有待探讨。近年来其相关抗癌治疗的药物,例如以Yap为治疗靶点的抗肿瘤药物的开发还处于初级阶段,其应用前景正逐步在扩大;若联合通过阻断T细胞活化共抑制信息分子(co-inhibitory molecules)的癌症监测点阻断(immune checkpoint blockade)免疫治疗,或可成为影响癌症的策略和手段。全面揭示Hippo-Yap信号通路精确的分子调控机制,为临床抗肿瘤治疗研究寻求潜在靶点,为精准治疗药物的研发提供广阔的思路。
