给水厂污泥陶粒制备及其对氮磷吸附研究*
2020-01-15蒋善庆武福平
郑 凯 蒋善庆 武福平#
(1.兰州交通大学环境与市政工程学院,甘肃 兰州 730070;2.常州大学环境与安全工程学院,江苏 常州 213164)
氮磷是天然水体中的关键污染物。因为氮磷而产生的水体富营养化现象给自然生态环境造成了严重危害[1]。因此,必须有效控制水环境中氮磷含量。去除水中氮磷有多种方法。生物法处理氮磷虽然二次污染小但是应用条件要求高[2]。化学法往往会产生二次污染而且处理成本较高[3]。相比较而言,吸附法具有二次污染小,操作简单等优点[4-5]。一些固体材料如工业废物、天然黏土等[6-7]已被用于氮磷的去除。
原水中的悬浮物和残留的水处理药剂在长期累积下形成了给水厂污泥。给水厂污泥所含的主要化合物为SiO2、CaCO3、Al2O3、Fe2O3等。给水厂污泥处理不当会给环境造成一定危害[8],通常送到垃圾填埋场处理[9]。给水厂污泥可作为吸附剂,对磷具有良好的吸附效果[10]。然而,目前以给水厂污泥作为潜在吸附材料同步吸附氮磷方面的研究还鲜有报道。
因此,本研究利用给水厂的两种污泥在3种烧结温度下制备出陶粒,对比陶粒同步吸附氮磷的效果,筛选最适陶粒,考察该陶粒同步吸附氮磷的影响因素,为低成本同步吸附氮磷提供技术支撑。
1 材料和方法
1.1 实验材料
1.1.1 陶粒的制备与筛选
实验所用给水厂污泥来自于江苏省常州市武进区西部礼河水厂。其设计规模2×105m3/d,校核能力3×105m3/d,水源为长江水。本研究中污泥分别选取了平流沉淀池湿污泥(SHST)和干泥饼(MC)。先将污泥、黏土和黏结剂Na2SiO3干燥至恒重,按比例混合,再倒入蒸馏水搅拌。待混合均匀后,控制混合材料的含水率。将混合材料取出制成圆形生料球。每颗生料球的质量在0.2 g左右,粒径为2~4 mm。在前期试烧实验的基础上选择预热温度300 ℃,预热时间 2 h,烧结温度500~700 ℃,烧结时间2 h,污泥与黏土质量比为3.5∶1.0等工艺参数来烧制污泥陶粒,以SHST和MC为原料制作的陶粒分别称为SHST陶粒和MC陶粒。
分别取100 mg/L氨氮与25 mg/L磷酸盐各100 mL,再分别单独投加20 mg/L SHST陶粒和MC陶粒,在25 ℃下静置吸附50.0 h,然后取少量上清液过滤,计算陶粒对氨氮和磷酸盐的吸附量,筛选最适陶粒。
1.1.2 实验废水
为避免实际废水水质波动对实验结果的影响,本研究采用模拟废水。用KH2PO4配制50 mg/L磷酸盐储备液;用NH4Cl配制1 000 mg/L氨氮储备液。
1.2 实验方法
1.2.1 pH和陶粒投加量对同步吸附的影响
取100 mg/L氨氮与25 mg/L磷酸盐的混合溶液100 mL。研究pH的影响时,陶粒投加量为20 mg/L,分别调节混合溶液pH至2~10。研究陶粒投加量的影响时,混合溶液pH为7,陶粒投加量分别为10、20、40、60、80 mg/L。在25 ℃下静置吸附50.0 h,然后取少量上清液过滤,计算吸附量。
1.2.2 吸附动力学实验
取100 mg/L氨氮与25 mg/L磷酸盐的混合溶液100 mL,调节pH为7,陶粒投加量为20 mg/L,然后置于25 ℃下静置吸附。分别在0、0.5、1.0、2.0、4.0、6.0、24.0、48.0、72.0 h取少量上清液过滤,计算吸附量。
1.2.3 等温吸附实验
取20、40、80、100、200、400 mg/L氨氮分别与5、10、20、25、50、100 mg/L磷酸盐配制混合溶液100 mL,调节pH为7,陶粒投加量为20 mg/L。25 ℃下静置吸附72.0 h,然后取少量上清液过滤,计算吸附量。
1.2.4 分析方法
总磷采用过硫酸钾消解—钼锑抗分光光度法测定,氨氮采用纳氏试剂分光光度法测定。陶粒的表面形貌采用场发射扫描电子显微镜(FESEM,Supra 55)观察。
2 结果与讨论
2.1 烧结温度对氮磷吸附效果的影响
通过图1可以看出,在600 ℃制备条件下,无论是SHST陶粒还是MC陶粒,对氨氮和磷酸盐的吸附量均最大。600 ℃时两种陶粒对氨氮吸附量在0.6~0.8 mg/g,而SHST陶粒对磷酸盐的吸附量为0.85 mg/g左右,比MC陶粒高出大约1倍。因此,进一步实验都将采用烧结温度为600 ℃的SHST陶粒。随着烧结温度升高,有机物分解加剧,可使陶粒表面孔隙变多,孔径增大,增强吸附效果;然而,烧结温度过高也可能会导致与吸附相关的金属氧化物升华,弱化陶粒的吸附性能。
2.2 pH对同步吸附氮磷的影响

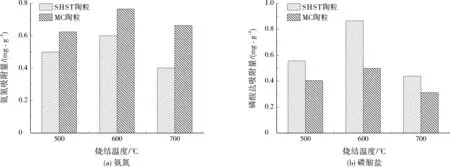
图1 不同烧结温度下两种陶粒对氮磷吸附效果比较Fig.1 Comparison of nitrogen and phosphorus adsorption effects of the two types of ceramsite at different sintering temperatures
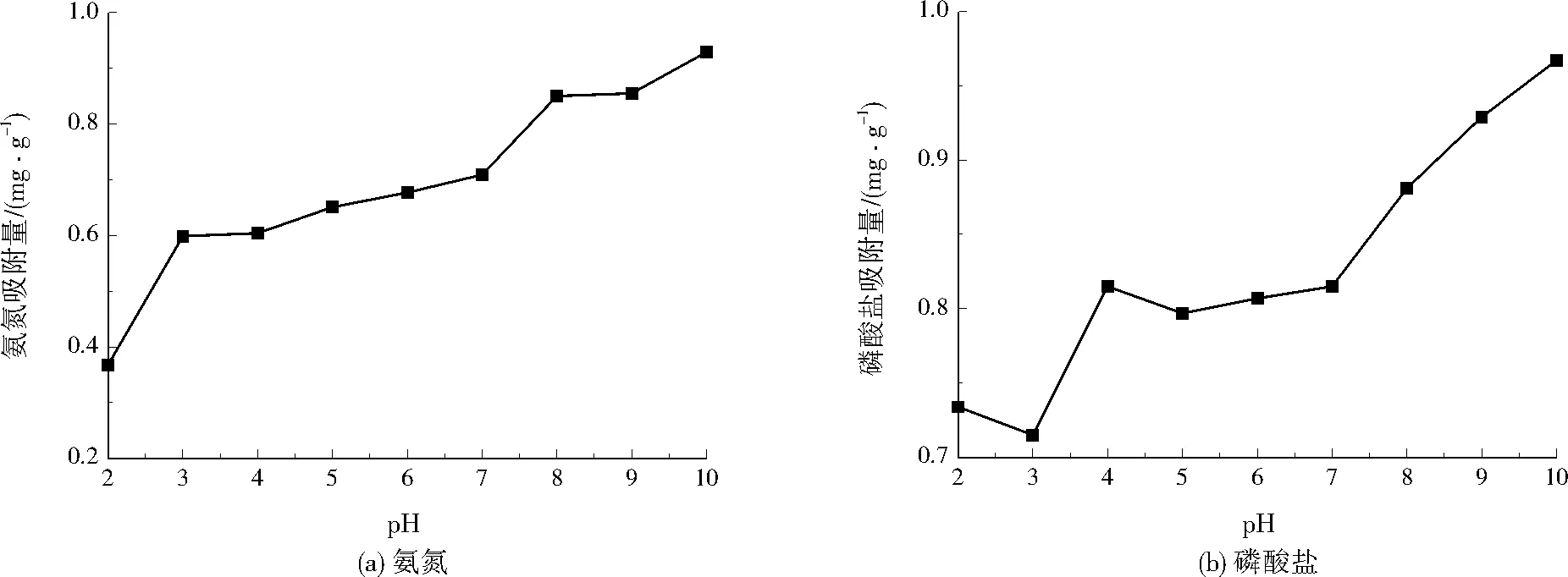
图2 不同pH对同步吸附氮磷的影响Fig.2 Effects of different pH on simultaneous adsorption of nitrogen and phosphorus
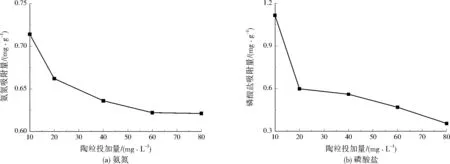
图3 不同陶粒投加量对同步吸附氮磷的影响Fig.3 Effects of different dosages of ceramsite on simultaneous adsorption of nitrogen and phosphorus
2.3 陶粒投加量对同步吸附氮磷的影响
从图3看出,陶粒对氨氮的吸附量随着投加量增大呈现下降趋势。随着陶粒投加量增大,陶粒的整体吸附能力变强;但是,陶粒吸附位点的利用率下降,导致其吸附量下降。同理,陶粒对磷酸盐的吸附量呈整体下降趋势。
2.4 吸附动力学结果
由图4可以看出,在50 h左右时,陶粒对氨氮和磷酸盐分别达到了平衡吸附量(0.650、0.706 mg/g),高于常规填料废弃砖块[12]和粉煤灰[13]的最大吸附量。

图4 氮磷吸附量随时间的变化Fig.4 Adsorption capacity of nitrogen and phosphorus varied with time
采用准一级动力学和准二级动力学模型对实验数据进行拟合,拟合结果如表1和表2所示。陶粒同步吸附氮磷时,对氨氮、磷酸盐的吸附过程均更符合准二级动力学模型,说明陶粒吸附氨氮、磷酸盐的过程均存在化学吸附作用。

表1 陶粒吸附氨氮的动力学拟合参数1)
注:1)qe为平衡吸附量,mg/g;K1为准一级反应速率常数,d-1;K2为准二级反应速率常数,g/(mg·d)。表2同。

表2 陶粒吸附磷酸盐的动力学拟合参数
2.5 等温吸附实验结果
采用Langmuir和Freundlich模型对实验数据进行拟合,拟合结果如表3和表4所示。陶粒同步吸附氮磷时,对氨氮、磷酸盐的吸附等温线均更符合Langmuir模型,说明陶粒对氨氮和磷酸盐的吸附过程主要发生在陶粒表面。

表3 陶粒对氨氮的吸附等温线拟合参数1)
注:1)qm为单层最大吸附量,mg/g;KL为Langmuir系数,L/mg;KF为Freundlich系数,mg1-1/n·L1/n/g;n为Freundlich常数。表4同。

表4 陶粒对磷酸盐的吸附等温线拟合参数
2.6 FESEM分析
对比吸附前后陶粒FESEM图发现,吸附前的陶粒孔隙明显,并且表面具有明亮的片状物质;而吸附后的陶粒表面更密实,孔隙趋于饱和(见图5)。

图5 吸附前后陶粒的FESEM图Fig.5 FESEM images of ceramsite before and after adsorption
3 结 论
(1) 以给水厂污泥为主要原料制备陶粒,600 ℃烧结温度下制备的SHST陶粒吸附氮磷的综合效果最好。
(2) 陶粒同步吸附氮磷时,对氨氮和磷酸盐的吸附量随着pH增大而上升,随着陶粒投加量增大而下降。
(3) 陶粒同步吸附氮磷时,在50 h左右能达到吸附平衡,陶粒对氨氮和磷酸盐的平衡吸附量分别达到0.650、0.706 mg/g。
