茶叶加工与样品制备对同位素分馏和测定的影响
2020-01-15邵圣枝张永志KaryneRogers袁玉伟
邵圣枝 聂 晶 刘 志 张永志 王 钫 Karyne M.Rogers 袁玉伟
(1浙江省农业科学院农产品质量标准研究所/农业农村部农产品信息溯源重点实验室,浙江 杭州 310021;2新西兰GNS国家同位素中心,惠灵顿 下哈特5040,新西兰)
近年来,元素分析-稳定同位素比率质谱(elemental analysis-stable isotope ratio mass spectrometry,EA-IRMS)联用技术广泛应用于食品安全掺假鉴别领域,如蜂蜜掺假鉴别[1-3]、酿造调味品真伪鉴别[1,4-5]、果汁掺假[6-8]、有机食品鉴别[9-11]、产地溯源[12-14]等,为产品品牌保护、健康饮食和消费者权益保障提供了科学支撑。
同位素比值测定对方法精度要求高,不同样品前处理方式可能对样品中稳定同位素比值测定造成影响,从而导致分析结果不准确。生物样品通常需在仪器分析前进行酸化处理,消除干扰物质对测定结果的影响。Yoder等[15]利用低浓度缓冲类型的酸和未含缓冲类型的酸对骨磷石碳进行预处理,结果表明2种酸处理未对 δ13C和 δ18O测定造成显著差异。Turner Tonaszewicz等[16]对海洋动物中不同新鲜程度的皮质骨进行酸化处理,虽然δ13C和δ15N有一定程度的变化(<1‰),但可通过建立方程对测定值进行校正。Connolly等[17]以海草和以海草为食的海洋动物为研究对象,发现酸化处理对δ34S影响较大,平均降低了2.6‰,有的单个样品偏差甚至达到7.0‰。除此之外,脱脂[18]、干燥[19]等方法也可能会对动物样品中同位素产生影响。Vizza等[20]对比了保存在乙醇中不同时间段的鱼鳍样品中δ13C、δ15N以及C∶N的变化情况,结果显示δ13C变大,而δ15N保持不变,在极大程度上与碳氮含量相关。对于大部分植物样品,脂肪和蛋白质含量极低,前处理中无需进行酸化处理,直接对植物样品进行真空冷冻干燥后保存。王周锋等[21]分别对4种不同植物样品经过杀青干燥和直接干燥处理后δ15N的变化进行对比,结果发现2种方式对δ15N均无影响。我国茶叶生产地域广泛、种类繁多,主要有黑茶、红茶、白茶、绿茶、黄茶和乌龙茶,其中绿茶为非发酵茶,红茶属于全发酵茶,都要经过不同工艺加工而成。在茶叶产地溯源中应用稳定同位素检测已有较多文献报道[22-24],稳定同位素δ13C、δ18O、δ15N 和 δ2H 已成为重要的地理标识特征指标。与其他生物样本相比,茶叶加工和样品制备较为简单。刘志等[13]对比了5种烘干方式对茶叶中 δ13C、δ18O、δ15N和 δ2H 的影响,结果显示不同干燥方式对4种同位素比值并不会产生较大影响。然而,国内外鲜有相同原料加工的绿茶和红茶是否发生同位素分馏,不同目数制备样品是否影响同位素比值测定的报道。
本研究首先建立EA-IRMS测试方法,探讨相同鲜茶叶所加工的绿茶和红茶是否发生同位素分馏现象,并考察不同目数的样品对同位素测定的影响,以期为茶叶产地溯源同位素数据库构建和样品制备方法的规范化提供理论基础。
1 材料与方法
1.1 试验材料与试剂
采集同一批崂山绿茶鲜叶(一芽一叶或一芽两叶)(2015年),分别按照绿茶(非发酵茶)和红茶(全发酵茶)加工工艺制备,由山东省崂山海瀛茶厂加工制备。
氢氧化钠、五氧化二磷购自德国Millipore公司;稳定同位素标准物质IAEA-CH-6(蔗糖,δ13CV-PDB=-10.449‰±0.033‰)、IAEA-600(咖啡因,δ13CV-PDB=-27.771‰±0.043‰,δ15Nair=1.0‰±0.2‰)、IAEAN-2(硫酸铵,δ15Nair=20.3‰±0.2‰)、IAEA-601(苯甲酸,δ18OV-SMOW=23.14‰±0.19‰)、IAEA-602(苯甲酸,δ18OV-SMOW=73.35‰±0.39‰)、IAEA-CH-7(聚乙烯,δ2HV-SMOW=-100.3‰±2.0‰),均购自国际原子能机构(IAEA,奥地利);B2203(δ2HV-SMOW=-25.30‰ ± 5.10‰)、B2155(δ15Nair=5.94‰ ±0.08‰)、B2174(δ13CV-PDB=-37.421‰±0.017‰),购自英国Elemental Microanalysis公司。
1.2 主要仪器与设备
Vario PYRO cube元素分析仪,德国Elementar公司;Isoprime 100型同位素质谱仪,英国Isoprime公司;FW100型粉碎机,天津市泰斯特仪器有限公司。
1.3 样本制备
茶叶样品用高速粉碎机循环研磨5次,每次时长30 s,间隔10 s,形成粉末状,然后制备分别经80目(孔径 0.180 mm)、100目(孔径 0.150 mm)、120目(孔径0.125 mm)孔筛和未过筛4种样本。红茶和绿茶样品各10个样本,同种茶叶不同目数样品数量为40个,共计80个,常温避光保存。
1.4 同位素比率值测定
1.4.113C和15N同位素比值测定 称取1.5~2.5 mg茶叶样品包样于锡杯;元素分析仪主要参数:燃烧管温度920℃,还原管中温度600℃,TCD温度60℃,氦气吹扫流量250 mL·min-1,氧气流量 40 mL·min-1;参考气体仪主要参数:氦气压力2 psi,参考气二氧化碳和氮气的压力分别为12 psi和5 psi;质谱主要参数:离子源加速电压3.97 kV,磁电流3 500 mA。茶叶中含碳量较含氮量偏高,同时测定过程中,仪器方法中设置二氧化碳气体稀释步骤。
1.4.22H和18O同位素比值测定 称取0.95~1.05 mg茶叶样品包样于银杯;元素分析仪主要参数:裂解管温度 1 450℃,TCD温度 60℃;氦气流量 300 mL·min-1;参考气体仪主要参数:氦气压力1.5 psi,参考气氢气和一氧化碳的压力分别为18 psi和5 psi;质谱主要参数:离子源加速电压4.23 kV,磁电流为2 200 mA。茶叶中含氢量较含氧量偏低,同时测定过程中,仪器方法中设置一氧化碳气体稀释步骤。
1.4.3 稳定同位素比率值计算 由于元素重同位素自然丰度相对较低,国际上通常采用将已知同位素比率的标准品作为参照,计算样本中稳定同位素比率的相对值。稳定性同位素比率计算公式为:
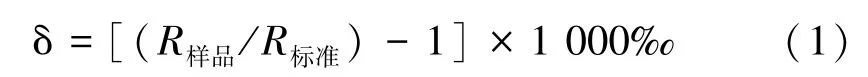
式中,R样品为所测样品中重同位素与轻同位素丰度比,即13C/12C、15N/14N、18O/16O、2H/1H;R标准为标准样品中重同位素与轻同位素丰度比。
测定样品时,δ13C和δ15N采用三点校正法,δ2H和δ18O采用两点校正法对结果进行定值,且在测定过程中每间隔16个样品需测定同位素标准物质作为样品测定过程中稳定性指标,稳定性要求经校正后的比值的标准偏差在证书标定范围内。
1.5 数据分析
采用Origin 8.0软件对数据进行整理,SPSS 18.0软件进行单因素方差分析。
2 结果与分析
2.1 测定方法准确性和稳定性验证
在样品测定前,首先进行参考气体稳定性和线性测试,然后再进行标准物质的稳定性和线性测试,最后以标准物质的测定结果为基础,保证测试样品在规定的响应强度范围内。以仪器信号5 nA左右作为参考气和标准物质稳定性的固定响应标准。
参考气体稳定性和线性:各参考气体的线性测试范围均为:CO2的标准偏差 0.02‰、CO2的线性0.03‰·nA-1;N2的标准偏差 0.04‰、N2的线性0.03‰·nA-1;CO 的标准偏差 0.03‰,CO 的线性0.02‰·nA-1;H2的标准偏差 0.12‰,H3+校正因子为7.2。以上气体稳定性和线性均符合仪器限定标准。
标准物质稳定性:分别称取各标准物质相近质量多份(n=10)进行测定,结果如表1所示,标准偏差均符合各标准物质限定的范围要求,方法可行。
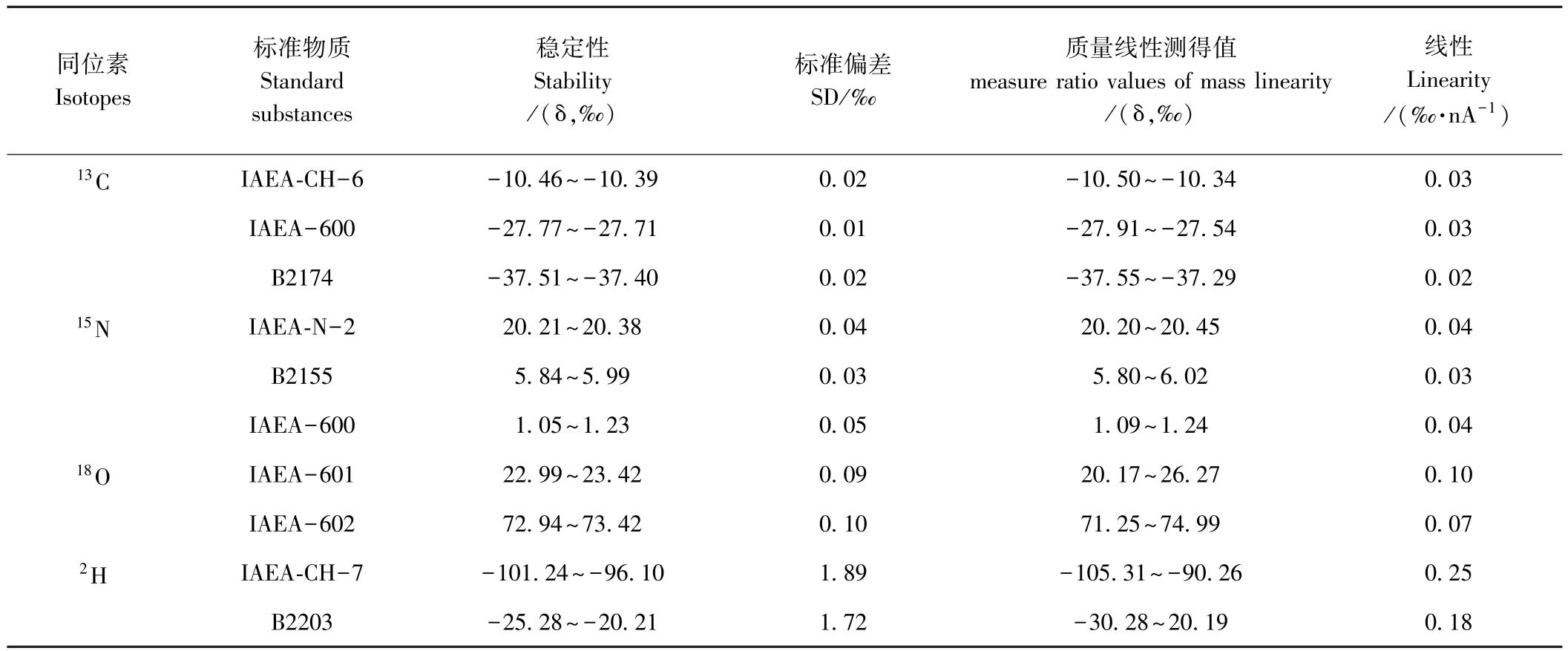
表1 标准物质稳定性和线性测定结果Table 1 Stability and linearity results of standard substance
标准物质线性:分别称取各标准物质差异质量多份(n=3或5);CO2(44m/z)响应强度在3~7 nA下,3种标准物质的δ13C较为稳定,称量质量对该定值影响较小;N2(28m/z)响应强度在2~9 nA下,2种标准物质的δ15N值较为稳定,称量质量对结果影响也较小;CO(28m/z)和H2(2m/z)响应强度在2~10 nA下,各标准物质的δ变化相对较大,为使测定结果更准确,规定在测定过程中称取相近质量的样品保证其响应强度为5 nA左右。
校准曲线:δ13C和δ15N分别采用3种标准物质构建校准曲线,其校准曲线的相关系数(R2)均大于0.999;δ2H和δ18O分别采用2种标准物质构建校准曲线,其校准曲线的相关系数(R2)均大于0.999。
长期稳定性:在测试期间,多次更换气瓶、填充原料,在以上仪器参数条件下,测定结果均保持稳定。
2.2 加工工艺对茶叶中稳定同位素比率值影响
红茶与绿茶样品分别经过不同的加工工艺制成,即红茶(全发酵)经过萎凋-揉捻-发酵-干燥等步骤,而绿茶(非发酵)经过摊青-杀青-揉捻-制形-干燥等步骤。为考察2种加工工艺对茶叶中同位素分馏的可能影响,将红茶与绿茶样品经过粉碎后,过相同目数筛后进行测定,红茶 δ13C值变化范围在-28.1‰~27.7‰之间、δ15N 范围在 3.7‰~4.1‰、δ2H 范围在-66.1‰~-54.6‰、δ18O 范围在 18.5‰~22.9‰;绿茶δ13C值变化范围在-28.2‰~-27.7‰之间、δ15N范围在 3.9‰~4.5‰、δ2H 范围在-67.1‰~-50.6‰、δ18O范围在20.0‰~22.7‰,结果如图1所示。结果表明,红茶和绿茶中4种稳定同位素比率的均值虽有不同,但差别不大,均值和标准偏差均接近,两者间无显著差异(P>0.05)。由此可知,在加工过程中,茶叶中单体成分或某些组分可能会发生同位素比值的分馏变化,但并未发生质量的损失,根据同位素质量平衡原理,其总体的同位素比值将保持不变。
2.3 单因素方差分析过筛目数对红茶与绿茶中稳定同位素比率值影响
将红茶和绿茶样本粉碎后,设置未过筛和分别过80目、100 目、120 目筛处理,测定 δ13C、δ15N、δ2H、δ18O等4种同位素比值,单因素方差分析比较4种不同目数茶叶样本的差异性,结果见表2和表3。4种稳定同位素比值的平均值和标准偏差均相近,红茶δ13C值变化范围在-28.0‰~-27.6‰之间、δ15N范围在3.5‰~4.4‰、δ2H 范围在-67.1‰~ -52.6‰、δ18O 范围在 19.5‰~23.0‰;绿茶中 δ13C值变化范围在-28.1‰~-27.7‰ 之间、δ15N 范围在 3.9‰~4.4‰、δ2H范围在-60.1‰~-55.6‰、δ18O范围在19.3‰~22.7‰。通过单因素方差分析,植物样品制备过程中过筛目数对红茶和绿茶4种同位素比值均无显著影响(P>0.05),也说明样品在粉碎过程中具有均一性,不同目数过筛对测定结果无影响。
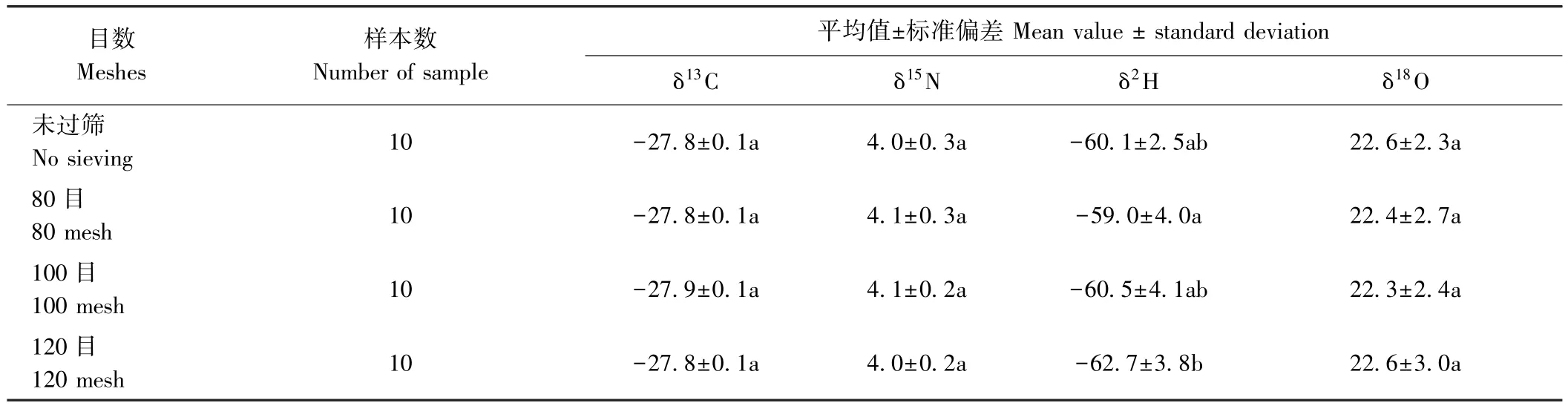
表2 红茶样本经不同目数过筛对不同稳定同位素的测定影响Table 2 Effects of mesh screening on the determination of different stable isotopes in black tea /‰
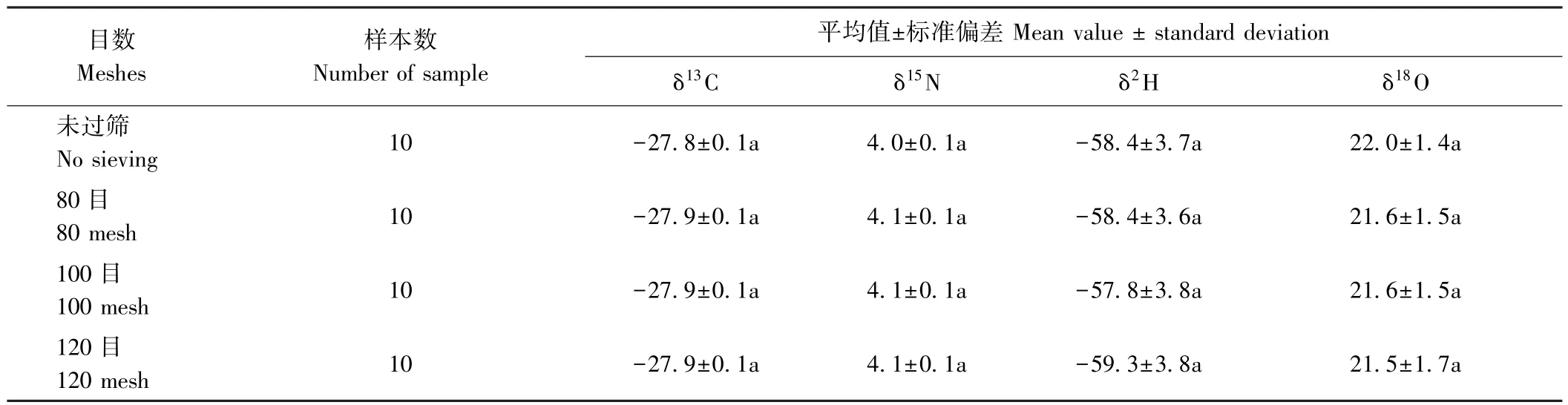
表3 绿茶样本经不同目数过筛对不同稳定同位素的测定影响Table 3 Effects of mesh screening on the determination of different stable isotopes in green tea /‰
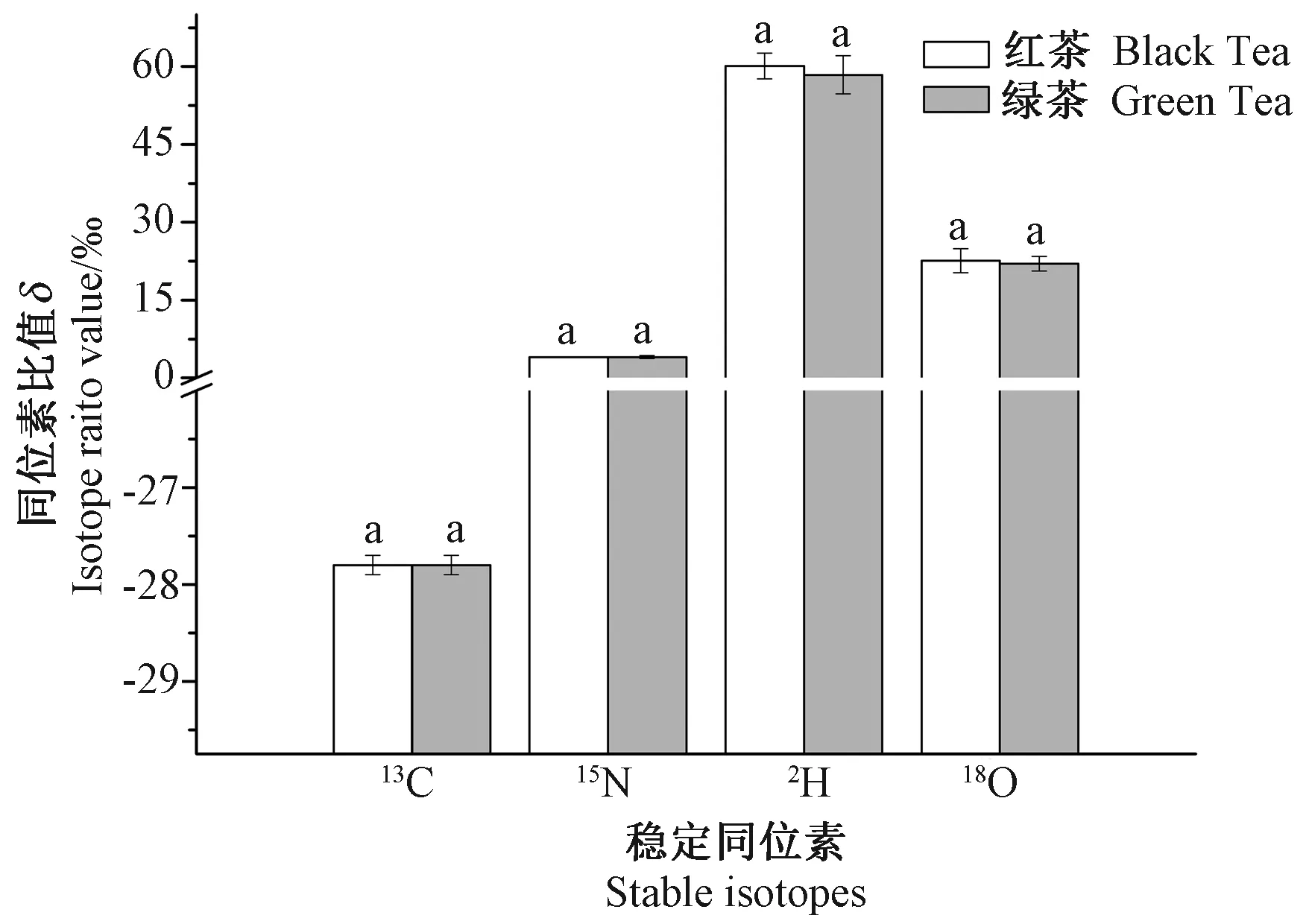
图1 红茶与绿茶中稳定同位素值比较Fig.1 Comparison of stable isotope value between black tea and green tea
3 讨论
在分析测试体系建立研究中,首先参考气体的稳定性和线性良好,这是下一步测试样品的基础;以标准物质作为参照,δ13C与δ15N检测结果受仪器响应信号强弱的影响较小,因此样品质量对定值影响较小;而δ2H与δ18O检测结果受仪器响应信号强弱的影响较大。因此,为保证数据的准确性,需按照一定质量进行称量,满足稳定性和准确性要求。在实际样品测定过程中,通过两点法或三点法构建的校准曲线具有很好的相关性,能够满足测试精度要求。此外,固体δ2H测量还存在交换氢的现象,利用相同基质或相同交换氢百分比的标准物质进行校正所得的结果更加准确和稳定[25]。
由于同位素之间在物理、化学性质上的差异,在物理、化学及生物化学作用过程中一种元素的不同同位素在两种或两种以上物质(物相)之间的分配具有不同的同位素比值现象,称为同位素分馏。绿茶加工过程中,摊青仅使叶片中的水蒸发,杀青步骤使得叶片中的酶失活;而红茶的加工过程中,萎凋使得叶片中酶活性增强,揉捻步骤增加了茶多酚与酶接触面积,是下一步发酵过程的关键步骤。2个不同的加工过程,不同的酶活性使得叶片中的物质发生了生物化学变化。根据质量守恒定律[26],针对同一种元素:δXbulk=(δC1·C1+δC2·C2+δC3·C3+……+δCn·Cn)/(C1+C2+C3+……+Cn),其中δCn代表不同化合物的同位素比值,Cn代表不同化合物的百分含量;从该式可知,即使不同的加工过程,单体化合物的同位素发生分馏并不影响总体同位素比值。植物中碳同位素比率主要与植物的光合作用途径[C3、C4和景天酸代谢(crassulacean acid metabolism pathway,CAM)途径]有关,由于C3植物和C4植物各自独特的碳循环系统,其对CO2的吸收能力各不相同。C3植物的δ13C值变化在-22‰~-34‰之间,C4植物的δ13C值变化在-9‰~-19‰之间,茶树属于C3植物,测定的δ13C范围在-28.0‰~-27.7‰之间,均处在C3植物范围内。δ15N主要与施肥活动密切相关,袁玉伟等[27-28]指出配施不同比例的有机肥-化肥会影响大白菜与黄瓜叶片中δ15N,并且可以通过该值判定植物在生长过程中是否使用化肥。冯海强等[29]认为如茶叶中δ15N在7以下,则大多使用化肥氮肥。结合本研究结果认为,该批茶叶使用化肥的可能性较大,这与实际情况也较为符合。植物组织中δ2H、δ18O与其产地环境的经纬度、海拔、降水、气温等密切相关,能直接反映其生长的地域信息[12,30]。
经测定分析,相同新鲜茶叶原料经过不同加工工艺对同位素比值影响较小,即红茶与绿茶中4个同位素比值均基本保持不变,整体上无明显分馏现象,对产地溯源数据库建立提供理论依据;此外,在植物样品前处理过程中,过筛目数对同位素比值影响较小,说明在粉碎过程中样品具有充分均一性,对样品中总体值测定几乎无影响。
4 结论
基于 EA-IRMS 所建立的 δ13C、δ15N、δ2H、δ18O 4种同位素测试方法,通过两点法或三点法构建的校准曲线具有很好的相关性,能满足测试精度要求。同一产区相同新鲜茶叶原料经过不同工艺过程制成的红茶和绿茶样品,4种稳定同位素比值均无显著差异(P>0.05);在植物样品制备中,过筛目数对红茶和绿茶种稳定同位素比值也无显著差异(P>0.05)。因此,不同加工工艺(全发酵和非发酵)对茶叶中 δ13C、δ15N、δ2H、δ18O同位素比值基本无影响,整体上未发生分馏现象;不同目数制备对4种稳定同位素组成也均无影响,说明在粉碎过程中样品已具有良好的均一性,不同实验室的样品制备能够满足检测要求。本研究结果可为不同类型茶叶同位素数据库构建和样品制备提供测试方法基础和理论依据。
