甘薯病毒病害(SPVD)的分子生物学研究进展
2020-01-15孙钟毓毛碧增
孙钟毓 龚 莺 赵 琳 石 江 毛碧增
(1浙江大学生物技术研究所,浙江杭州 310058;2农业农村部作物病虫分子生物学重点实验室,浙江杭州 310021;3杭州市农业科学研究院,浙江杭州 310021)
我国是世界上最大的甘薯生产国,据统计,甘薯种植面积达670万hm2,年产量约1亿t,甘薯已成为我国主要的经济和粮食作物之一[1]。但甘薯易受多种病毒病复合侵染,造成巨大的经济损失[2]。美国、肯尼亚、以色列等国家相继发现被甘薯病毒病(sweet potato virus disease,SPVD)侵染的植株表现出矮化、皱缩、褪绿、叶片变窄、花叶明脉等症状[3]。1976年,Schaefers等[4]发现以上病症是由甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)和甘薯褪绿矮化病毒(Sweet potato chlorotic stunt virus,SPCSV)2种病毒共同侵染形成SPVD造成的。此后,大量研究者针对甘薯病毒病害进行了广泛研究。
本文综述了引起SPVD的2种病原的分子特征和部分基因功能及其遗传变异的最新研究进展,初步探讨了SPFMV和SPCSV这2种病毒的协同致病机制,旨在为SPVD和其他病毒病复合侵染的研究与防治奠定一定的理论基础,为阐明多种病毒混合侵染机制研究提供一定的理论依据。
1 病毒生物学特性
SPCSV为长线形病毒科(Closteroviridae)毛形病毒属(Crinivirus),目前在西班牙、美国、中国等国家的甘薯中分布较广泛[5-7]。SPCSV病毒粒子呈弯曲线状,其长度为850~950 nm,传播介体主要为烟粉虱B型(Bemisia tabaci biotype B)和纹翅粉虱(Trialeurodes abutilonea),以半持久方式传播,不经汁液接种传播,主要存在于寄主韧皮部细胞内,并在维管束内堆积[8-9];SPFMV为马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus)是甘薯上最常见的病毒之一,广泛分布于世界各地的甘薯中,该病毒粒子为长丝状,长约830~850 nm,是马铃薯Y病毒属中病毒粒子最长的成员[10]。其可通过嫁接和机械摩擦传播,也可由蚜虫非持久性传播,不经种子、花粉或植物间接触传播。稀释限点为10-3~10-4,体外存活期为12 h,热灭活温度为60~65℃,此外,SPFMV在寄主内可诱导出胞质风轮状内含体[11]。
2 检测方法
2.1 RT-PCR
虽然常规PCR、限制性内切酶片段长度多态性分析(restriction fragment length polymorphism,RFLP)、扩增产物的测序等技术可用于多种病毒的快速鉴定和分析,但由于甘薯富含多糖多酚物质,严重干扰核酸的提取质量,用以上方法效果不佳[12]。Deng等[13]运用纳米磁珠RT-PCR技术发现,核酸吸附于纳米磁珠上,从黏性悬浮样品中抽离,提高了核酸提取质量;王文重等[14]研究表明,免疫捕捉技术无需抽提病毒RNA便可将目标病毒与抗原结合后固定在固相上,经洗脱处理后富集病毒,再进行RT-PCR反应,避免了从植物组织中分离核酸的繁琐过程。表明纳米磁珠RT-PCR技术和免疫捕捉RT-PCR技术很好地解决了核酸提取的质量问题。
与常规PCR检测技术相比,多重RT-PCR技术能够在一次反应中同时检测多种病毒,极大缩短了反应时间,提高了检测效率。张盼等[15]建立了能同时检测SPVD 2种病原的多重 RT-PCR方法,且能够区分SPFMV的2个主要株系类型SPFMV-CH和SPFMVCH2。李华伟等[16]发现甘薯G病毒(sweet potato virus G,SPVG)单独侵染甘薯时,症状不明显,与SPFMV和SPCSV共同侵染时造成严重的灾害,因此建立了准确高效且可同时检测这3种病毒的多重RT-PCR体系。多重RT-PCR具有成本低、效率高等特点,可将不同病毒的基因序列和特征进行对比分析并分离鉴定,能用于甘薯脱毒和病毒病快速检测。
2.2 实时荧光实时定量PCR
实时荧光定量PCR反应可根据标准曲线对未知模板进行定量分析,实时监测整个PCR过程。实时荧光定量PCR需要将mRNA的扩增或宿主基因的编码序列分别作为RNA或DNA病毒检测的内部对照[17]。甘薯的内参基因包括18S、26S rRNA、细胞色素氧化酶(cytochrome oxidase,COX)等,这些基因被用来测定实时荧光定量PCR反应中不同样品RNA和DNA浓度的差异。王丽等[18]应用该方法对SPCSV-WA株系进行了定量检测,结果表明通过1个TaqMan定量检测系统可检测出3.31个拷贝数的目的病毒,灵敏度较普通PCR高1 000倍。卢会翔等[19]采用双内参基因检测引物,建立了快速检测甘薯病毒病SPVD的实时荧光定量 PCR反应,与硝酸纤维素膜-酶联免疫法(nitrocellulose membrane-enzyme-linked immunosorbent assay,NCM-ELISA)相比,更加准确高效。虽然实时荧光定量PCR技术较省时省力,检测灵敏度也较高,但其引物和TaqMan探针的序列特异性以及昂贵的试剂和仪器,可能会限制该方法的推广应用。
3 病毒基因组特征及分子变异
3.1 基因组特征
SPFMV基因组长约10 kb,为正义单链RNA,5′末端非编码区(untranslated regions,UTR)和共价结合的基因组连接蛋白(viral protein genome-linked,VPg)均对翻译起着特定的作用,3′末端为poly(A)尾,该病毒基因组包含1个较大的开放阅读框(open reading frame,ORF),翻译成1个约360 kD的多聚蛋白,在蛋白水解酶的作用下催化裂解成10个成熟的蛋白质,即Pl、HC-pro、P3、6K1、CI、6K2、NIa-Vpg、NIa-Pro、NIb、CP[20-21]。有研究表明,SPFMV通过+2移码在P1和P3内部编码1个额外的P3N-PIPO和P1N-PISPO蛋白[22](图1)。且发现P1N-PISPO仅存在于SPFMV组成员中,而P3N-PIPO存在于所有马铃薯Y病毒科病毒中[23];SPCSV基因组长约15.3~16.0 kb,为双组份正义单链RNA,2个基因组RNA的3′端UTR基本一致。Kreuze等[24]测定RNA1和RNA2分别含有9 407和8 223个核苷酸,其中RNA1包含2个相互重叠的ORFs,编码能抑制RNA沉默的RNase3和p22。RNA2具有典型的长线形病毒科特征,ORFs编码热激蛋白70(heatshockprotein70,Hsp70)、55~64 kD 蛋白质产物、外壳蛋白(coat protein,CP)及外壳蛋白类似物(图2)[25]。
RNA沉默(RNA silencing)是植物的抗病毒防御系统,是针对病毒RNA、转基因RNA、转座子RNA、发夹结构RNA等的一种防御机制,而RNA沉默抑制蛋白(RNA silencing suppressor,RSS)是病毒为了成功侵染植物演化而来的反防御系统,是病毒与寄主之间共同进化的结果[26]。Llave等[27]将携带HC-Pro表达载体的土壤杆菌注射进GUS转基因沉默的组织内,发现HC-Pro可抑制1个或多个沉默维持步骤;Untiveros[28]通过瞬时表达的SPFMV基因产物与标记基因在本氏烟草中的渗透过滤表明,P1和P1N-PISPO蛋白均有RSS的作用。P1N-PISPO可能用过阻断传播至邻近细胞的信号,抑制沉默的细胞间移动,P1蛋白仅在局部抑制沉默,位于P1的P1N部分的保守甘氨酸/色氨酸基序在RSS活性中起关键作用,已发现SPCSV存在2种RNA沉默抑制蛋白,即 RNase3和 p22。Kreuze等[29]研究表明SPCSV的RNase3能增强p22的RNA沉默抑制活性,这2个独立的蛋白质共同参与RNA沉默抑制。RNase3是1种双链RNA特异性内切核酸酶,Cuellar等[30]研究表达RNase3的转基因甘薯植株进一步发现,单独表达该蛋白质可消除植株的抗性,且在SPFMV侵染植物后产生SPVD症状。推测RNase3是通过降解病毒防御中的双链小干扰RNA分子(small interfering RNA,siRNA)来克服植物的防御反应[31]。但目前关于RNase3具体作用机制尚不清楚,仍需进一步更深入的研究。
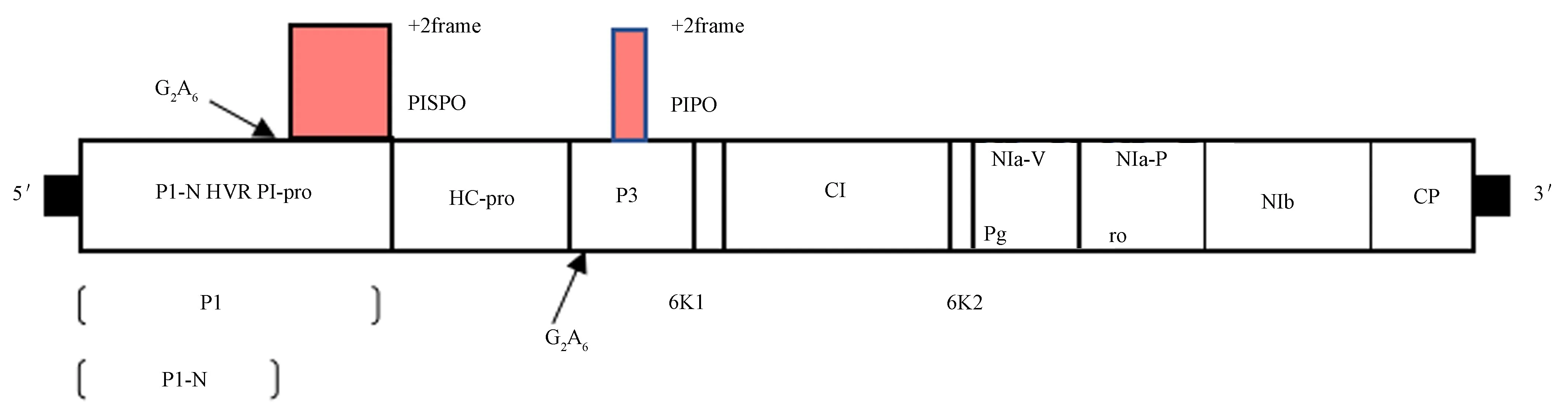
图1 SPFMV的基因组结构图[22]Fig.1 Genome organization of SPFMV[22]
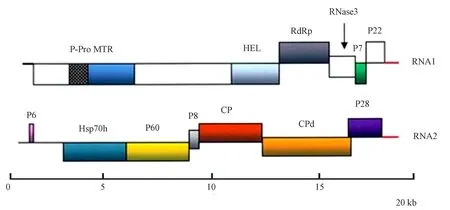
图2 SPCSV的基因组结构图[25]Fig.2 Genome organization of SPCSV[25]
3.2 病毒遗传多样性
CP蛋白氨基酸序列以及核苷酸序列的系统发育和遗传多样性分析表明,SPFMV可分为3个株系[32],分别为普通(ordinary,O),东非(East African,EA),和龟裂 RC(russet crack)。SPCSV分为2个株系[33],分别为东非(East African,EA)和西非(West African,WA)。Ishak等[34]分析了SPVD的2种病原物的遗传多样性,基于3′末端的基因组序列分析表明,SPFMV分离株属于RC株系,利用单克隆抗体的血清学检测和Hsp70基因的部分序列的系统发育分析表明,SPCSV为非 EA株系。Kwark等[35]对侵染甘薯的SPFMV分离物进行RFLP分析,将其分为SPFMV-RC,SPFMV-O+SPFMV-RC和SPFMV-O共3种类型,且基于CP基因序列分析表明,其中17个SPFMV分离株可分为2组,组内和组间的一致性分别为97%~99%和91%~93%。根据CP、Hsp70h基因序列和EA株系的单克隆抗体分析表明,非洲的SPCSV-EA核苷酸序列显示出高度的保守性,CP核苷酸序列的两两比对显示SPCSVEA分离株之间差异小于4%。但这些序列与已报道的SPCSV-WA的Hsp70h序列相比较,核苷酸序列一致性最高达34.6%,证实了EA和WA株系的Hsp70h序列之间的关系较远[36]。
2012年,张振臣等[37]对来自广东、江苏、四川、安徽等地的10份SPVD分离株进行全面分析表明,SPFMVCP基因核苷酸序列一致性为77%~94%,SPCSVHsp70基因的核苷酸序列一致性达78%~99%,根据系统进化树分析发现我国甘薯的SPFMV和SPCSV均存在明显的株系分化。Deng等[13]分析了四川甘薯SPFMV分离物的CP基因序列遗传多样性,结果表明,核苷酸序列一致性达77.3%~99.8%。系统发育分析将SPFMV分离株分成RC、O和C组。包改丽等[38]研究表明云南甘薯上的SPFMV分离物存在EA、O株系,且与已发现的株系亲缘关系较远,有可能是新的株系。姜珊珊等[39]分析了来自山东的6个SPFMVCP基因序列,其核苷酸和氨基酸的相似性分别为77.43%~98.52%和82.86%~98.1%,并发现山东的 SPFMV种群发生了新变化。Qin等[40]基于Hsp70基因序列系统发育,研究了来自四川、安徽、江苏、福建等地的20个SPCSV分离物的遗传多样性,发现核苷酸和氨基酸序列的一致性分别为79%~100%和92%~100%,且大多数为WA株系,表明WA株系在我国的地理分布较EA株系更广泛。
3.3 病毒分子进化
RNA病毒依赖于RNA的RNA聚合酶(RNA-dependent RNA polymerse,RdRp)或复制酶,自身缺乏校正功能,导致RdRp错配率接近10-4,植物RNA病毒通过点突变、重组、缺失、插入、重配等变异,以提高病毒适应不同寄主能力和生存力[41]。研究表明重组是马铃薯Y病毒科病毒进化过程中的重要变异,因此识别重组热点的基因组区域对于理解重组在新病毒株进化中的作用具有重要意义[42]。Tugume等[43]对14种野生SPFMV分离株进行序列分析表明,SPFMV不同株系之间存在一定程度的重组现象,且6K2-Vpg-NIa-Pro区是SPFMV-EA基因组上的1个重组热点区域,EA株系在东非国家有很高的遗传多样性。Kwak等[44]基于成熟蛋白质氨基酸序列的系统发育树分析发现,P1蛋白是感染甘薯马铃薯Y病毒属的种内和种间高度可变的区域,且HC-Pro和NIa-Nib也被认为是重组中的热点区域。
4 SPVD的协同作用侵染机制
目前,虽然对SPVD病毒引起的症状观察、病原鉴定和检测的研究较多,但对病毒分子水平的研究主要集中在全基因组测序和遗传多样性分析上,对病毒基因编码蛋白的功能及其协同致病机理的研究还不够深入。Kokkinos等[45]运用cDNA 微阵列技术比较SPFMV-RC和SPCSV的单一侵染与混合侵染对甘薯基因表达的影响,结果表明单独侵染 SPFMV和SPCSV的植物中差异表达的基因数量分别仅有3个和4个,受SPVD侵染的植物有超过200个基因是差异表达的。
Karyeija等[46]发现甘薯植株感染 SPVD后,SPFMV的含量比单独SPFMV侵染时大约高600倍,而SPCSV的含量却几乎不受影响或者稍微降低。马铃薯Y病毒属病毒在协同作用中通常是增强子,P1和HC-Pro融合表达抑制RNA沉默,表明SPCSV增强了SPFMV的作用[47]。Choi等[48]发现SPCSV与SPMMV复合侵染甘薯的表现出的形状与SPVD的2种病原SPFMV和SPCSV相互作用相似。通过实时荧光定量PCR分析发现,SPCSV使SPMMV含量提高了约1 000倍,而SPCSV含量降低了2倍,表明二者存在拮抗作用。Kokkinos等[49]发现SPCSV增强了甘薯Y病毒(Sweet potato virus Y,SPVY)、甘薯G病毒(Sweet potato virus G,SPVG)的复制能力。
5 综合防治策略
5.1 推广应用脱毒健康种苗
甘薯脱毒苗的培育过程是利用甘薯顶端分生组织无毒的原理,将茎尖分生组织离体培养诱导成苗,并进行病毒检测,确认完全脱除病毒后进行快繁、种植。目前,甘薯脱毒的主要技术有热处理脱毒法、化学疗法、组织培养脱毒法和超低温脱毒法等[50]。马代夫等[51]经过多年多点鉴定生产上推广面积较大的几个甘薯品种的脱毒效果,发现不论地点、年份和品种,脱毒甘薯均表现出增产,增产幅度为14.95%~91.61%。Wang等[52]利用茎尖结合超低温冷冻疗法脱除SPFMV和SPCSV,效果显著,茎尖再生率为100%。但目前关于国内将多种脱毒方法相结合脱除SPVD的研究尚未见报道。
5.2 SPVD抗病种质的创制
筛选和种植抗病品种是经济有效的防治SPVD的方法之一,而建立科学的SPVD抗性鉴定方法是筛选抗病品种的基础[53]。Mwanga等[54]利用劈接技术进行嫁接,可使接穗的成活率达100%,进而能快速鉴定甘薯群体对SPVD的抗性。王爽等[53]建立了田间人工嫁接病毒接穗的方法,有效地对12个甘薯品种进行了大规模的田间抗性鉴定。研究发现普遍侵染SPCSV的地区往往有抗SPVD的品种,如New Kawogo为SPCSV抗性最强的甘薯之一[55]。
5.3 转基因培育抗病品种
随着生物技术的迅猛发展,自20世纪90年代中期以来,基因工程已被广泛应用于培育甘薯抗病品种。如Cipriani等[56]利用水稻半胱氨酸蛋白酶抑制剂基因水解马铃薯Y病毒属的多聚蛋白功能,诱导甘薯产生对SPFMV的抗性。Okada等[57]成功将SPFMV的CP基因导入到受体细胞中,并发现这些转基因植株嫁接到不同地域的分离物中同样具有抗性。近年来,RNA沉默介导诱导抗性植株的技术已应用于多种植物抗病毒的转基因育种中,但对于甘薯植株中抗病毒的转基因报道较少。Kreuze等[29]以靶向SPCSV和SPFMV的复制酶编码序列为目标,利用内含剪接发夹的结构对秘鲁甘薯Huachano进行改造。在3次转化试验中,利用高毒性农杆菌菌株和胚胎再生获得了28个独立的转基因植株,其中10个转基因植株在感染后表现出轻微或无任何症状,且SPCSV含量显著降低。采用RNA干扰技术同时靶向引起SPVD的SPFMV、SPCSV编码的RSS,为未来抗病分子育种的研究提供了新方向。
5.4 加强病害流行学检测与引种的检疫
甘薯是无性繁殖作物,种苗和种薯调运是SPVD远距离传播的主要材料,减少跨区调运可有效减少病害远距离传播,蚜虫和烟粉虱分别是SPFMV、SPCSV近距离传播的介体,由于 SPFMV普遍存在,防治SPCSV的传播是控制SPVD流行的根本。而加强对甘薯大田烟粉虱的防治,可有效防控SPVD的流行,加强产地检疫,此外,采用高效快速的检测技术也可有效预防SPVD的传播与流行[58]。
6 展望
我国是世界上最大的甘薯生产国,已发现SPCSV与大多数马铃薯Y病毒科病毒如SPMMV、SPVG等共同侵染甘薯,在SPVD的基础上引起更严重的病毒侵染病害。但目前关于SPVD的2种病毒的非典型性协同作用机制的研究尚鲜见报道,对SPVD的综合防控能力较弱。新发现的RSS蛋白P1N-PISPO可能与SPVD有关,但需要更深入的研究,才能阐明SPCSV的RNase 3和SPFMV的P1N-PISPO在SPVD协同侵染中的具体作用机制。
目前,培育栽培抗病甘薯品种的进程缓慢,耗时较长,而病毒进化又会进一步干扰抗病品种的选育。采用RNA干扰技术同时靶向引起 SPVD的 SPFMV、SPCSV编码的主要RSS,是未来抗病分子育种研究的新方向。建立甘薯脱毒健康种苗体系已是十分成熟的常规实验操作技术,脱毒苗生产基地已初具规模,但仍存在生产上所用脱毒甘薯品种单一、茎尖分生组织培养的再生率比较低、耗时长等问题。脱毒效果因甘薯品种的基因型不同存在较大差异,传统的脱毒方法已无法满足多种病毒侵染的甘薯健康种苗培育体系的建立,因此采用生物技术对进一步开拓和完善多种病毒侵染的机制具有重要意义。本文为甘薯多种病毒侵染机制的研究提供了方向,同时也为遗传育种工作提供了一定的理论依据。
