切花菊茎秆性状的生长动态与遗传分析
2020-01-15吴洋洋徐婷婷迟天华管志勇房伟民陈发棣
吴洋洋 徐婷婷 迟天华 马 杰 管志勇 房伟民 陈发棣 张 飞
(南京农业大学园艺学院,江苏南京 210095)
菊花(Chrysanthemum morifoliumRamat.)是我国传统名花和世界重要切花之一,具有很高的观赏和经济价值。据统计,我国切花菊销售量已经连续5年超过21亿枝,其中 2016年为 26.53亿枝,销售额高达15.18亿元,产业发展势头良好[1-5]。随着切花菊在园林和观光农业产业中的广泛应用,对其品质要求也逐渐增加。除了新奇特花型外,花期持久、抗逆性强等性状也逐渐得到关注,而这些性状与健壮的茎秆密切相关。长势旺盛、茎秆直顺是切花菊的重要品质性状之一,健壮的茎秆不仅可以增强花枝的吸水性以延长花期,而且耐运输,在一定程度上可提高抗逆性。因此,明确切花菊茎秆相关性状的生长动态和遗传机制对提高其育种效率至关重要。
目前,关于切花菊品种株高、茎粗等茎秆性状在特定光温、水分和氮素等栽培环境条件的生长模型已有相关报道[6-8]。在菊花茎秆相关性状的遗传机制方面,张飞等[9]通过切花菊和盆栽小菊杂交后代的配合力分析,发现菊花的株高主要由非加性效应控制;张飞等[10]研究发现盆栽小菊和匍匐型地被菊杂交后代株高的杂种优势为正向显著、节间长度的杂种优势负向显著,通过主基因+多基因混合遗传模型分析发现节间长度主要由一对负向完全显性主基因控制,而未检测到株高的主基因效应;张飞等[11]通过单因素方差分析检测到菊花株高和节间长度相关的分子标记位点。近年来,关于菊花株高、茎粗、节间长度等茎秆相关性状的关联分析和QTL定位研究也有相关报道[12-14]。然而,菊花茎秆性状在不同杂交组合后代的生长动态和遗传情况尚不完全清楚。因此,本研究拟通过调查切花菊不同杂交组合后代茎秆相关性状,比较分析在不同遗传背景条件切花菊茎秆性状的生长动态和杂种优势,并通过单个分离世代的主基因+多基因混合遗传模型剖析其主基因遗传效应,以期进一步丰富菊花杂交育种理论,为提高切花菊杂交育种效率提供参考依据。
1 材料与方法
1.1 试验材料
供试的蒙娜丽莎白、寒小白和Qx097 3个切花菊亲本品种均来自南京农业大学中国菊花种质资源保存中心,其中蒙娜丽莎白和Qx097为长势旺盛品种,寒小白长势较弱(表1)。2015年秋,以寒小白(HB)和Qx097为母本,以蒙娜丽莎白(MB)为父本,通过人工辅助授粉分别获得寒小白×蒙娜丽莎白(MH)和Qx097×蒙娜丽莎白(MQ)两个杂交组合群体,2016年春进行穴盘播种。

表1 3个切花菊亲本品种的株高、茎粗和节间数Table 1 Plant height,stem diameter and internode number of the three parental cut-chrysanthemums
1.2 田间试验与性状调查
2016年7月23日,在各杂交组合中任选110个F1株系,连同亲本材料一起扦插,待生根后于2016年8月10日定植于大田,定植后按正常栽培生产管理。在定植后 15、30、45、60、75 d 分别调查株高、节间数和自顶芽向下第2片新叶下节间的茎粗3个茎秆性状,茎粗的测定为固定位点,自定植后15 d第一次测定后,作上标记,定期测其茎粗,每个株系(基因型)重复3次。
1.3 数据分析
基于株高、茎粗和节间数等茎秆性状的调查数据,计算各性状的变异系数、杂种优势率、累积生长率和相对生长率,绘制株高、茎粗和节间数累积生长曲线和相对生长曲线。各指标的计算方法如下:

式中,F1为杂交子代性状的平均值;MPV(middle parent value)为双亲性状的平均值,即中亲值。
株高(G′H)、茎粗(G′D)和节间数(G′N)的相对生长率分别定义为:

式中,H表示株高;D表示茎粗;N表示节间数;t表示测定时间;数字1、2表示相邻的前、后测定时期。采用Microsoft Office Excel 2013和SPSS v20软件进行数据分析。
此外,根据数量性状的主基因+多基因混合遗传模型中的单个世代(F2)分离分析方法[15],利用Windows软件包SEA[16]分析最后一次测定的茎秆性状的主基因遗传效应。用极大似然和期望最大化算法估计分布参数,AIC(Akaike’s information criterion)值较小且适合性检验最优的模型为适宜遗传模型。根据最优模型采用最小二乘法估计出主基因的效应值、方差和遗传率等遗传参数。
2 结果与分析
2.1 切花菊茎秆性状的生长动态
通过累积生长曲线可知,切花菊株高和茎粗在定植后30 d内生长均较缓慢,株高在定植后30~60 d生长较快,定植后60~75 d生长又变缓;而茎粗在定植后30~45 d生长较快,定植后45 d生长逐渐变缓,因此,株高和茎粗整体符合S型生长曲线;在节间数方面,除了定植后60~75 d增加较缓外,其他各阶段生长较均匀。由相对生长率曲线可知,切花菊株高在定植后15~30 d和30~45 d的相对生长速率较大,之后下降较快;茎粗在定植后30~45 d的相对生长速率最大,其他时间段均较缓;节间数在定植后15~30 d的相对生长速率最大,之后呈梯度下降(图1)。总体而言,切花菊亲本及2个组合间茎秆性状的累计生长率和相对生长率变化趋势一致。
2.2 切花菊杂交后代茎秆性状的遗传变异
由表2可知,MQ组合株高、茎粗和节间数等茎秆性状的平均值在各时期均高于MH组合(定植后15 d时茎粗除外),其中两个组合在株高和茎粗上均表现出显著差异,而节间数在定植后45 d差异不显著。从变异系数看,MH组合株高的变异系数在每个时期都高于MQ组合;而茎粗的变异系数在定植后15 d时MH组合高于MQ组合,但在定植后30 d时MQ组合高于MH组合;在定植后15~30 d时MQ组合节间数的变异系数略高于MH组合,而定植45 d后MH组合节间数的变异系数略高于MQ组合。

图1 切花菊杂交组合后代茎秆性状的累计生长和相对生长曲线Fig.1 Cumulative growth and relative growth rate curves of stem traits of MH and MQ crosses

表2 MH和MQ组合茎秆性状的平均值与变异系数Table 2 Means and coefficients of variation for stem traits of MH and MQ crosses
2.3 切花菊杂交组合茎秆性状的杂种优势
由图2可知,MH与MQ组合之间各茎秆性状的中亲优势率差异较大。在MH组合中,茎秆性状在定植后75 d时的中亲优势率最高,其他各时期较低或为负值;除了定植后30 d时的茎粗和定植后15 d时的节间数为负值外,其他各时期的茎粗和节间数的中亲优势率均为正值,且呈现逐渐增加的趋势。在MQ组合中,除了定植后15 d时茎粗的中亲优势率表现为正值外,其他各时期茎秆性状的中亲优势率均表现为负值,而且最低可达-12%。综上,茎秆性状的杂种优势在不同切花菊杂交组合间以及同一组合的不同生长时期差异均较大。

图2 MH和MQ组合后代茎相关性状在不同生长时期的中亲优势率Fig.2 Mid-parent heterosis of stem traits of the MH and MQ crosses at different growth stages
2.4 切花菊茎秆性状的主基因效应
依据AIC值最小的模型为最适遗传模型的原则,发现MH组合株高和MQ组合茎粗的最佳备选模型为B-3模型,其他各性状的最佳备选模型为A-0模型(表 3)。 利用、、、nW2和Dn对这些备选模型进行适合性检验(表4),发现各统计量差异不显著,说明各备选模型均可作为最适模型。因此,MH组合的株高及MQ组合的茎粗主要表现为加性效应的2对主基因控制,而在这2个组合的其他各茎秆性状上未检测到主基因效应。由表5可知,MH组合控制株高遗传的2对主基因均具有正向增效,加性效应值分别为4.23和14.65,第二对主基因的加性效应大于第一对主基因,主基因遗传率为97.12%。MQ组合控制茎粗遗传的2对主基因也均具有正向增效,加性效应值分别为0.60、0.48,第一对主基因的加性效应大于第二对主基因,主基因遗传率为9.33%。
3 讨论
茎秆性状与作物产量和抗逆性密切相关[17-19]。对于菊花而言,茎秆性状是菊花重要的品质性状之一,与切花品质和抗逆性密切相关。目前,关于菊花的遗传研究主要集中在花部性状和部分抗逆性[14,20-22],而关于菊花茎秆性状生长动态和遗传机制的文献报道较少[13-14,23]。本研究比较分析了切花菊不同杂交组合F1茎秆性状的生长动态、杂种优势和主基因效应,研究结果将有助于理解菊花茎秆性状的生长发育和遗传机制,对今后菊花高效栽培和育种研究具有重要指导意义。本研究结果表明,MH和MQ 2个杂交组合母本的茎秆性状差异较大,但亲本及其F1群体茎秆性状的累积生长曲线和相对生长曲线基本一致,且株高和茎粗的累积生长曲线基本符合S型生长曲线,这与王旭等[24]研究结果一致。此外,亲本和不同杂交组合后代的株高、茎粗和节间数等茎秆性状在定植后45 d以内的生长速率均较快,此时应为切花菊茎秆生长的关键时期。
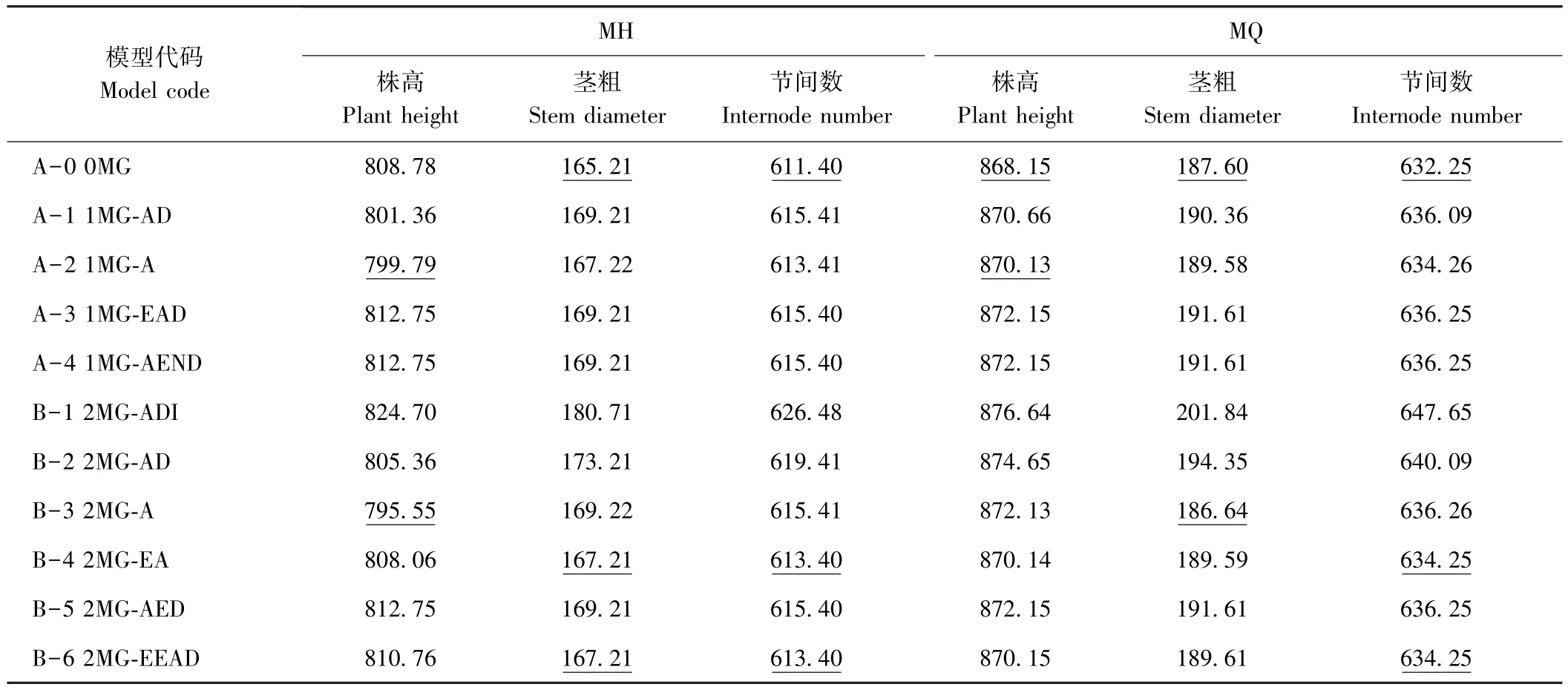
表3 MH和MQ组合茎秆性状分离分析AIC值Table 3 Akaike information criterion(AIC)values of various genetic models for stem traits of MH and MQ crosses

表4 MH和MQ组合茎秆性状入选模型的适合性检验Table 4 Test for goodness-of-fit of selected genetic model for the stem traits of MH and MQ crosses

表5 MH和MQ组合茎秆性状在各最优模型下遗传参数的估计值Table 5 Estimation of genetic parameters for the stem traits of MH and MQ crosses at the optimal models
一般认为,遗传差异较大的亲本之间杂交产生丰富变异的几率也较大[9]。本研究中,除了茎粗数,亲本茎秆性状差异较大的MH组合株高和定植45 d后节间数的变异系数均高于亲本性状差异较小的MQ组合,但是MQ组合茎秆性状的平均值在各时期均高于MH组(定植后15 d时茎粗除外),特别是在株高和茎粗上各阶段均表现出显著差异。表明茎秆性状存在母性遗传效应,且茎秆均值差异较大的亲本品种之间杂交,其后代的变异系数也较大,为强优株系的选育创制了条件。
研究表明,菊花各性状在不同杂交组合中的杂种优势表现程度不同[25]。本试验结果表明,不同杂交组合,甚至是同一组合不同时期茎秆性状的杂种优势表现程度差异较大。其中,亲本差异较大的MH组合茎秆性状在各时期多表现为正向的中亲优势率,这与张飞等[10]在盆栽小菊和匍匐型地被菊杂交后代株高上的报道相似;而亲本茎秆性状差异较小的MQ组合茎秆性状在各时期的中亲优势率多是负值。因此,在菊花实际育种中,应选择茎秆性状差异较大的亲本开展杂交,充分发挥杂种优势的作用。
主基因+多基因混合遗传模型是植物数量性状遗传研究的重要方法,现已广泛用于遗传分析[17,26-28]。该方法在菊花中也有一些报道[20-22,29-31],但多集中在1个杂交组合中,鲜见不同杂交组合背景下的遗传研究。前人研究表明,植物数量性状的主基因遗传模型在不同遗传背景条件下存在较大差异[32-33]。最近研究表明,甜荞的株高和茎秆性状在正反交组合中最适遗传模型均为2对加性-显性-上位性主基因+加性-显性多基因模型,但在主基因和多基因的遗传效应值上存在差异[34]。本研究比较了切花菊茎秆性状在不同遗传背景条件下的主基因效应,仅在MH组合株高和MQ组合茎粗性状上分别检测到2对加性主基因效应(主基因遗传率分别为97.12%和9.33%),在其他茎秆性状上均未检测到主基因效应。株高的加性主基因效应与早期关于菊花株高非加性效应的报道存在差异[9],进一步说明菊花株高等茎秆性状在不同杂交组合或遗传背景中的遗传机制差异较大。因此,菊花茎秆性状的遗传机制仍需进一步研究。
4 结论
本研究明确了切花菊各茎秆性状的相对生长速率在定植后45 d前均较快,且其生长动态与亲本性状差异程度无紧密关系,这为切花菊在栽培调控提供了参考依据。切花菊茎秆性状存在母性遗传效应,且茎秆均值差异较大的亲本品种之间杂交,其后代的变异系数也较大,为强优株系的选育创制了条件。混合遗传分析发现,切花菊茎秆性状的遗传表现在不同遗传背景中差异较大,但在MH组合的株高和MQ组合的茎粗上检测到2对加性主基因效应,为后续茎秆性状的QTL定位研究提供了参考。
