橡胶树茎干褐斑病病原鉴定及室内防治药剂筛选
2020-01-15蒋桂芝刘一贤
蒋桂芝,李 丽,刘一贤,周 明*
(1.云南省热带作物科学研究所,云南景洪666100;2.勐满农场管委会农林水服务中心,云南勐腊666309)
云南植胶区由于特殊的气候环境,橡胶树病害种类较多,随着种植时间延续,一些新病害在不断发生,并逐渐显现出经济上的重要性。上世纪90 年代,云南植胶区持续发生橡胶树小蠹虫(Bark beetle)为害[1];2003-2004 年,西双版纳持续橡胶树盔蚧(Parasaissetia nigraNitner)大发生[2];2005 年,在云南河口发生橡胶树棒孢霉落叶病[Corynespora cassiicola(Berk. & Curt.)Wei][3];2012-2013 年,在云南景洪发生镰刀菌(Fusariumsp.)侵染引起橡胶树的茎基腐病和茎干溃疡病[4],等等。这些病虫害的发生都给生产带来不同程度的损失。
2014 年4 月,笔者在对云南省主要橡胶种植区进行病害普查的过程中,在景洪市勐养农场发现一种橡胶树茎干褐斑病,造成橡胶树茎干树皮溃疡,症状表现为:在感病部位表面有少量点状棕褐色分泌物,分泌物干后呈浅茶色印迹或黑色点状,树皮表层粗皮没有变色坏死现象,感病严重的橡胶树产量大幅下降,同时可引起小蠹虫为害导致橡胶树死亡。此次发现的褐斑病与已知的由疫霉菌(Phytophthorasp.)[6]、镰刀菌(Fusariumsp.)[6-7]引起的橡胶树茎干溃疡有明显的差异。为找到相应的防治措施,笔者对勐养的感病病株进行了采样和病原分离,依据形态、致病性、分子生物学对病原菌进行鉴定,并作病原菌适宜生长温度及防治药剂筛选测试,为进一步开展防治技术研究提供理论依据。
1 材料和方法
1.1 材料
供试病样及植株:于2014 年4 月在云南省景洪市勐养农场银河生产队感病橡胶树采集罹病样品35 株,其 中GT1 品种13 株,PR107 品种12 株,RRIM600 品种10 株。用刀刮除病斑及病健交界处树皮的表层粗皮,然后用灭菌手术刀切取大小为0.3~0.5 cm×0.3~0.5 cm 病健交界处树皮组织,放到无菌的塑料小瓶中作为病原菌的分离材料,带回实验室。分别选用种植3 年的云研77-2幼树和种植14 年的正常橡胶树(林下株)茎干为接种材料。
马铃薯葡萄糖琼脂培养基(PDA)培养基:土豆200 g、葡萄糖20 g、琼脂粉17 g、水1 000 mL。
1.2 方法
1.2.1 褐斑溃疡病病原菌的分离及鉴定
病原菌的分离及形态鉴定:将采集的样本放在直径5 cm 的培养皿中用75%酒精消毒30 s,凉干后在培养皿中加入0.1%的升汞液,使样品完全浸在升汞液中消毒处理1 min,随后将消毒处理过的样本放到灭菌水中清洗1 min,重复清洗3 次,然后用灭菌滤纸吸取样本外多余的水分,将处理好的样本放置在PDA 培养基平板上25℃培养,培养5~7 d 后PDA 平板上有菌落形成。将所得菌落孢子依据方仲达(1990)[8]方法进行单孢分离,依据Hirooka[9]和庄文颖[10]的文献进行形态学鉴定。在PDA 平板上继代培养得到纯培养菌株,用于致病性试验。
ITS 序列比较和系统发育树分析:依据DNA快速抽提试剂盒说明书提取菌丝体中的DNA,利用ITS1/ITS4 引物对其进行扩增和测序[11]。rDNA ITS 区序列扩增及分析采用真菌核糖体基因转录间隔区通用引物ITS1(5′-TTCCGTAGGTGAA CCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGAT ATGC-3′),扩增该病原菌5.8 S rDNA 及其两边的ITS1 和ITS2 基因片段。扩增反应体系50 μL:真菌DNA 模 板0.5~1.0 μL、10 μmol/L ITS1 1 μL、10 μ mol/L ITS4 1 μ L、2× Master Mix25 μ L、ddH2O 10 μL,加水补至50 μL。 PCR 扩增程序:预变性94℃5 min;变性94℃30 s,50℃45 s,72℃45 s,35 个循环;最后72℃延伸7 min。PCR 扩增产物使用琼脂糖凝胶回收,纯化后的PCR 产物克隆至pGEM-T-Easy 载体,并委托生工生物工程(上海)有限公司完成测序。将该病原菌的ITS 序列与GenBank 中核酸数据库中有关序列进行同源性比较,在NCBI 数据库中筛选已公布的丛赤壳菌株ITS 序 列,采 用 软 件Mega 7.0 中 的NJ(Neighbor-Joining)法对选中的ITS 序列进行系统发育树分析,确定其分类地位。
1.2.2 分离物致病性的测定试验及再分离
因橡胶开割树与幼树的树皮厚度、结构差异较大,在感病症状和时间上会表现不一致,同时考虑到材料的来源,先进行橡胶幼树致病性测定试验,感病后再作橡胶割胶树致病测定试验。
测试病原菌在PDA 平板上培养7 d 后,用灭菌打孔器将菌落打成直径5 mm 菌丝块备用。
(1)橡胶幼树致病性测定试验:在橡胶幼树茎干距地面1.0 m 左右的高处用直径5 mm 的打孔器打深度为2 mm 的孔,用灭菌滤纸吸去小孔中渗出的胶乳,然后在小孔中接种备好的测试菌丝块,对照接种直径5 mm 的PDA 琼脂块,随后用保鲜塑料薄膜包裹保湿。第3 天除去包裹塑料薄膜,开始观察接种点树皮组织的变化,以后每隔2 d 观察1 次,当树皮组织出现坏死变褐感病症状后再进行病原菌分离,得到与接种一致的菌落时确认为病原菌。
腿脚不便的老人出趟门也不容易。城乡地区无障碍建设还比较滞后,中国消协与中国残联去年的一项百城调查显示,我国无障碍设施实地体验调查普及率为40.6%,大众感知调查普及率仅为37%。一些行动困难的老人上公厕找不着扶手、坐公交艰难登台阶、下地铁没法坐轮椅、老弱病残孕专座被挤占等麻烦还有很多。
(2)橡胶割胶树致病性测定试验:在割胶树茎干按同样方法(打孔深度5 mm)接种。第7 天除去包裹薄膜开始观察,以后每隔7 d 观察1 次,当树皮组织出现与田间感病症状一致,再进行病原菌分离,得到与接种一致的菌落时确认为病原菌。
1.2.3 病原菌适宜温度的测定
将病原菌扩繁后用灭菌的打孔器打成直径5 mm 的菌丝块,分别接种在PDA 平板上,置于5、10、15、20、25、30、35、40℃温度和80%RH 的培养箱中培养,5 d 后取出,用数显卡尺测量菌落生长直径,依据各处理菌落生长情况确定病原菌的适宜温度。
1.2.4 防治药剂的筛选试验
根据农药对病原菌的不同作用机理,选取11种农药开展试验,依据各农药的推荐使用浓度选中间值计算配制各试验农药的浓度,然后将其配制成含毒培养基。50%异菌脲可湿性粉剂、50%多菌灵可湿性粉剂、50%腐霉利可湿性粉剂、72%霜脲·锰锌可湿性粉剂、40%多·福·溴菌腈可湿性粉剂、40%嘧菌酯悬浮剂、30%苯甲·丙环唑乳油、240 g/L 噻呋酰胺悬浮剂、20%吡唑醚菌酯悬浮剂、240 g/L 戊唑醇悬浮剂、20%噻菌铜悬浮剂等农药制成含毒培养基的有效成分含量分别为0.5、0.5、0.5、0.72、0.2、0.2、0.3、2.4、0.1、2.4、0.16 mg/L。取250 mL 的三角瓶,分别在每个瓶中装入100 mL 的PDA 培养基,灭菌备用;各种农药按有效成分分别配制成母液,用移液枪将各种农药按比例分别加入装有PDA 培养基的三角瓶中摇匀,制成含毒培养基平板,编号备用。将扩繁好的病原菌平板用灭菌打孔器打成直径5 mm 的菌丝块,分别接种到各农药的含毒培养基上,对照接PDA 平板,在25℃条件、80%RH 的培养箱中培养5 d,观察、记录菌落的生长情况。
1.3 数据分析
采用Excel 2007 和SPSS 21 软件对试验数据进行处理,以Duncan 氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 病原菌分离及形态鉴定
经过培养、分离得到一种菌落,通过多次稀释、单孢分离、萌发培养得到纯化菌株,编号XJ140417。在PDA 培养基上,菌落产浅红色色素(图1-a);孢子梗不分枝,直立,近圆柱形,顶部渐尖(图1-b);培养15 d 后,在菌落表面产生疣状物,散生或聚生,表生,为产孢的束丝,新鲜时为橘红色或橙黄色(图1-c);分生孢子卵形、椭圆形、长椭圆形,无隔,表面平滑,无色,4.1 ~6.1 μm×2.3 ~3.8 μm(图1-d)。根据形态特征,鉴定为丛赤壳科丛赤壳属假毛丛赤壳菌(Nectria pseudotrichia)。
ITS 序列比较和系统发育树分析:病原菌DNA利用ITS1/ITS4 引物进行PCR 扩增,获得555 bp ITS序列(登录号为KX869739),XJ140417 的ITS 序列和已公布的丛赤壳菌序列构建的系统发育树(图2)结果表明,XJ140417 与假毛丛赤壳菌(Nectriapseudotrichia)
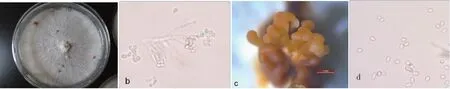
图1 PDA培养的的菌落形态、分生孢子梗、束丝及分生孢子
聚为一支,与丛 赤 壳 菌HM48455.4、
KU940138.1 的ITS 序列同源性均为99% ,分子鉴定病原菌为(N. pseudotrichia)。
形态学鉴定和分子鉴定相一致,确定病原菌为N.pseudotrichia。
2.2 分离物的致病性及发病植株再分离
幼树接种试验:接种10 d 后,发现幼树接种点树皮发生褐色病变,症状与田间相似(图3-a),对照不感病(图3-b)。从发病部位重新分离获得病原物,其培养性状和分生孢子形态与接种菌一致,表明菌株为该病的致病菌。
割胶树致病测试:接种5 d 后除去包裹薄膜,接种30 d 形成的病斑较小,持续观察,接种60 d后出现的感病症状与田间完全一致(图3-c);对照不感病,伤口愈合(图3-d)。从发病部位重新分离获得病原物,其培养性状和分生孢子形态与最初分离物一致,表明菌株为该病的致病菌。
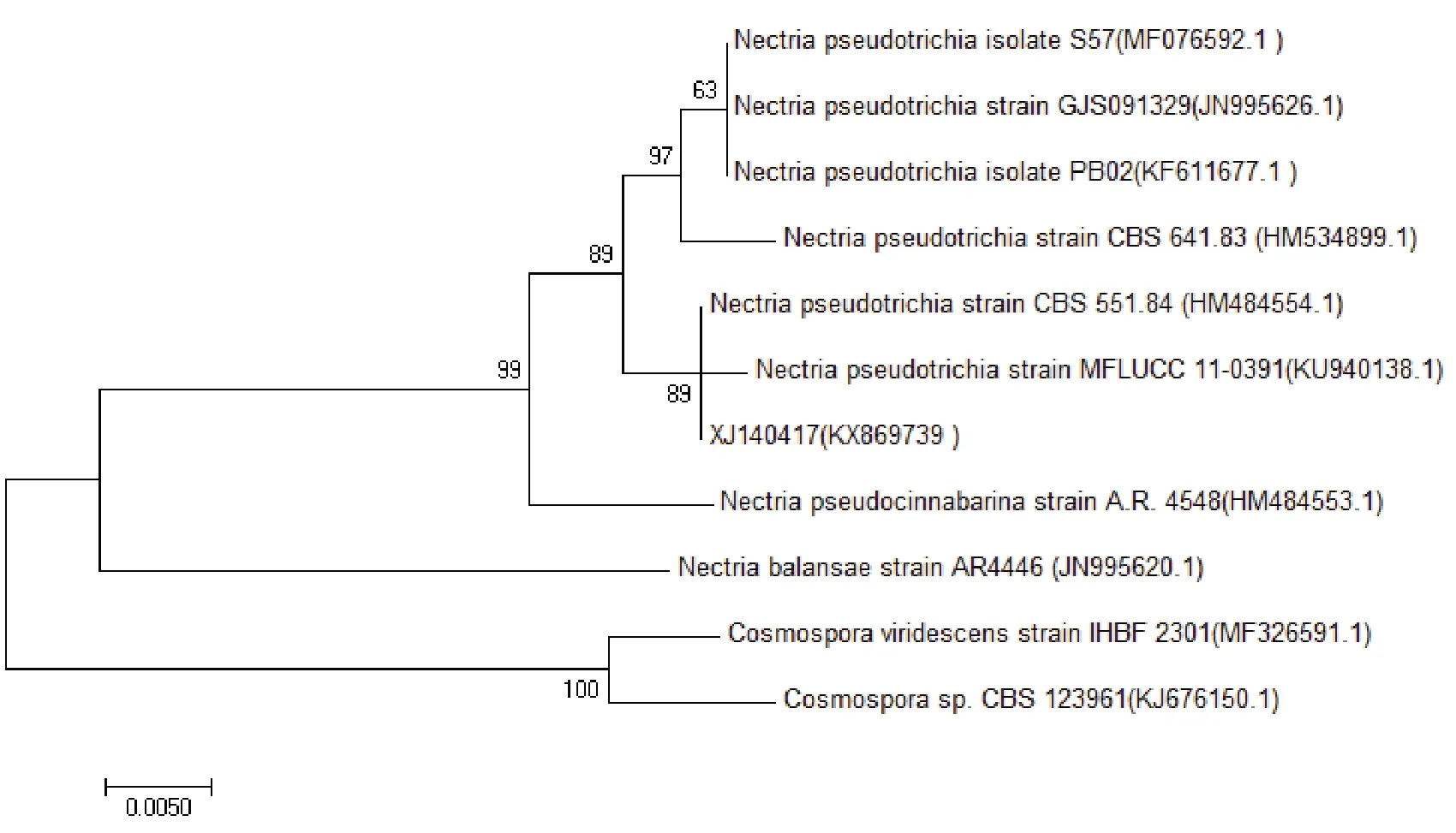
图2222 基于ITS序列病原菌XJ140417和近源物种的系统发育树
2.3 温度对病原菌菌丝生长量的影响
在不同温度下5 d 菌丝生长结果:当温度为20℃时,菌丝生长量达到最大,为61.3 mm;当温度为25、30、15℃时,菌丝生长量分别为47.7、45.0和20.0 mm;在5℃和35℃时,菌丝生长停止。表明该菌最适生长温度为20℃,适宜生长温度为15~30℃,生长范围为5~35℃(图4)。
2.4 防治药剂的筛选

图3 幼树(a和b)和割胶树(c和d)接种后的症状
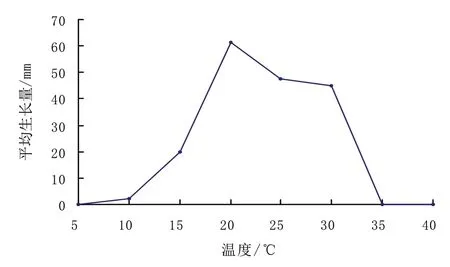
图4 温度对病原菌菌丝生长量的影响
试验结果(表1)表明:在P<0.01 水平上,参试11 种药剂药效差异达极显著,其中50%多菌灵、50%多·福·溴菌腈、30%苯甲·丙环唑、240 g/L戊唑醇等4 种药剂效果最好,菌丝生长分别为0.00、0.00、0.30 和0.15 cm,可以完全控制病原菌菌丝的生长,50%异菌脲、50%腐霉利、72%霜脲·锰锌L、40%嘧菌酯、20%吡唑醚菌酯的效果依次递 减,菌 丝 生 长 分 别 为0.85、2.30、4.98、5.13 和5.55 cm,240 g/L 噻呋酰胺和20%噻菌铜的效果最差,菌丝生长分别为8.10 和8.60 cm,且噻菌铜对病原菌菌丝的生长似乎有促进作用。田间防治推荐选用50%多菌灵、50%多·福·溴菌腈、30%苯甲·丙环唑、240 g/L 戊唑醇。
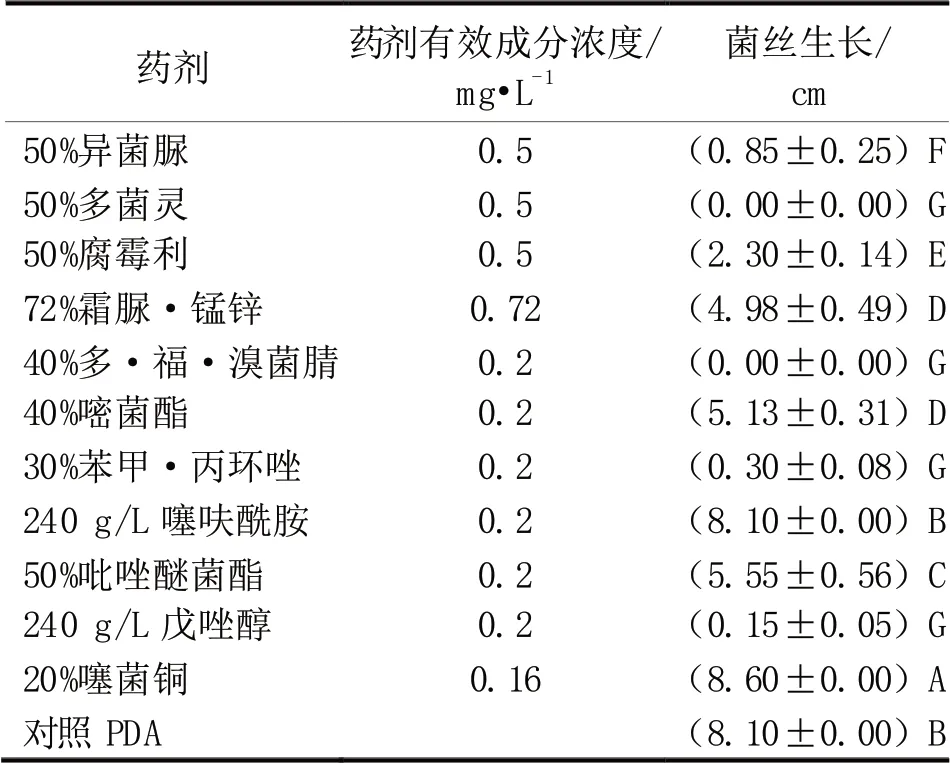
表1 不同药剂对病原菌菌丝生长的影响
3 讨论
云南勐养农场胶园出现的茎干褐斑病主要危害橡胶树主干,早期在感病部位表面有少量点状棕褐色分泌物。笔者从现场采集到茶褐色液体状分泌物样品带回实验室镜检,在分泌物中含有大量的分生孢子,经在PDA 平板上培养,7 d 后形成的菌落形态和分生孢子形态与病斑分离得到的病原菌一致,为假毛丛赤壳菌(N. pseudotrichia);病原菌在PDA 平板上培养15 d 后产生产孢的束丝,束丝有吐水现象,这种现象或许是橡胶树病斑上有分泌物形成的原因。
由假毛丛赤壳菌引起的橡胶树茎干褐斑病在橡胶上是首次报道。国内外有关假毛丛赤壳菌引起植物病害的报道并不多。国外报道其在巴西和澳大利亚分别引起梨溃疡病[12]和澳洲坚果溃疡病[13]。试验表明,该病原菌菌丝生长最适温度为15~30℃,适宜生长范围为10~35℃,与云南热带和亚热带地区的气候特点[14]相吻合。假毛丛赤壳菌的无性和有性阶段广泛分布在热带和亚热带地区,是双子叶植物常见的病原真菌之一[15]。云南橡胶种植区为热带和亚热带地区,褐斑病的病原菌假毛丛赤壳菌的来源区域与资料记载相符。因而,该病害的发生不是偶然的,是外来物种橡胶树适宜云南热带和亚热带地区环境条件的同时,该病原菌也逐渐适应橡胶树的结果。
对橡胶树褐斑病的观察发现,褐斑病病斑周年都在扩展,在每年的10 月至翌年的3 月扩展速度大于4-9 月,这可能与橡胶种植区每年的10 月至翌年3 月的温度相对较低(一般日温度范围在15~30℃较多),4-9 月的温度相对较高(一般日温度范围在21~37℃较多)有关,也与病原菌假毛丛赤壳菌的适宜生长温度试验结果相吻合。
根据目前研究的结果来看,橡胶树褐斑病将来有可能成为云南橡胶树的主要茎干病害。感病严重的橡胶树后期易受小蠹虫、天牛等钻柱性害虫为害,形成次生虫害,降低抗风性的同时也缩短了橡胶树的经济寿命。因此,对该病害的防治应重在预防和早期治疗。假毛丛赤壳菌对橡胶树的致病机理目前尚不清楚,还需深入研究,才能找到有效的预防和早期治疗措施。
