不同提取方法对橙皮果胶乳化特性的影响
2020-01-14胡晓波李梦圆刘咏王军辉
胡晓波,李梦圆,刘咏*,王军辉,2
1(合肥工业大学 食品与生物工程学院,安徽 合肥,230009) 2(功能性复合调味品安徽省重点实验室,安徽 界首,236500)
我国是柑橘类的主要原产地,其中橙子是重要品种之一[1]。橙皮是橙类罐头生产的主要副产物,富含果胶,很多商业果胶是从橙皮中提取出来的。食品加工常需要使用适合的乳化剂或表面稳定剂来稳定油-水和/或空气-水界面[2]。有研究证明柑橘果胶和甜菜果胶可以降低乳液中油相和水相之间的界面张力[3]。天然果胶代替乳化剂用于食品加工,是人们对健康的追求。果胶的乳化性能由其内在性质(甲基化程度、乙酰基和分子量)和外在因素(果胶浓度、pH和离子强度)决定,而内在性质往往取决于果胶的提取方法。
为了获得乳化性好的果胶,很多学者做了大量的研究。刘佳等[4]采用热水提取法获得了5种橙皮果胶,发现橙皮果胶属于高酯果胶,其果胶溶液表现出很好的黏度特性和蛋白质稳定性。CHEN等[5]利用盐酸提取橙皮,获得了酸性和碱性果胶,研究表明,酸性果胶含有较高浓度的半乳糖醛酸,具有很高的黏度,而碱性果胶呈高度支链化,可用作增稠剂和乳化剂。工业中常使用无机酸对原料进行加热从而提取商业果胶,虽然生产成本较低,但会破坏果胶的中性糖链,并且会对生产器皿内壁造成腐蚀。为了获得乳化稳定性高的橙皮果胶,本文拟利用顺序提取法从橙皮中提取果胶,并与酸提法、酶提法进行比较,研究各果胶片段的乳化特性,同时考虑外在条件如橙皮果胶浓度、pH、温度、Ca2+浓度对其溶液行为的影响,为橙皮果胶在食品工业的应用提供研究基础。
1 材料与方法
1.1 材料与试剂
新鲜的橙子购于当地超市。手剥橙皮用水洗净后,放入温度为50 ℃的烘箱中烘干至恒重,然后置于超微粉碎机中粉碎,过40目筛。在常温下将橙皮粉末用体积分数70%乙醇浸泡1 h,将过滤后的滤渣置于V(氯仿)∶V(甲醇)=1∶1的混合溶液中,搅拌以脱色,滤渣用丙酮洗涤并干燥。将脱色脱脂的粉末样品用密封袋收集,放于干燥处储存备用。使用的化学试剂均是分析纯并购买于国药集团。
1.2 橙皮果胶的提取
采用SENGKHAMPARN等[6]顺序提取秋葵多糖的方法。称取20 g橙皮粉末,在70 ℃用0.05 mol/L NaAc溶液(pH 5.2)萃取30 min,用4层纱布过滤,收集滤渣用于下一步提取,滤液在9 000 r/min的转速下离心20 min,获得热缓冲液可溶性橙皮果胶(HBOP)。将滤渣在70 ℃用0.05 mol/L EDTA、0.05 mol/L NaAc和0.05 mol/L Na2C2O4的混合溶液(pH 5.2)中萃取30 min,4层纱布过滤后,将滤液在9 000 r/min的转速下离心20 min,获得螯合剂可溶性橙皮果胶(CHOP)。将第二步的滤渣在4 ℃用20 mmol/L NaBH4和0.05 mol/L NaOH混合溶液萃取30 min后,立即用乙酸中和,过滤并离心,得到稀碱可溶性橙皮果胶(DAOP)。第三步的滤渣在4 ℃用20 mmol/L NaBH4和6 mol/L NaOH混合溶液继续萃取30 min,乙酸中和后过滤离心,得到浓碱可溶性橙皮果胶(CAOP)。将各个组分置于8 500 Da透析袋中,用蒸馏水透析3 d,流动水透析2 d,然后真空冷冻干燥并储存。
酸法提取橙皮果胶,根据VENZON等[7]的方法并稍作修改。将2 g脱色脱脂后的橙皮粉末倒入250 mL的三角烧瓶中,加入30 mL蒸馏水后用柠檬酸缓冲液将溶液pH调至3.3,在水浴锅中提取大约57min。然后离心取悬浮液,蒸发浓缩后用8 500 Da的透析袋透析,冷冻干燥后得酸法提取的橙皮果胶(AEOP)。
酶法提取橙皮果胶,称取20 g脱色脱脂后的橙皮粉末于三角烧瓶中,加入800 mL蒸馏水和560 mg半纤维素酶,在40 ℃和自然pH下酶解,再以柠檬酸调至pH 2,在90 ℃下水浴并搅拌提取30 min,在4 000 r/min离心10 min,洗涤残渣2次,合并上清液后蒸发浓缩。最后冷冻干燥获得酶法提取的橙皮果胶(EEOP)[8]。
1.3 橙皮果胶乳化液的制备
称取橙皮果胶粉末,溶于蒸馏水配制成不同浓度的果胶溶液。取1 mL溶液,加入3倍体积的植物油。用高速均质机在10 000 r/min均质5 min,再用高压均质机于40 MPa下均质2次,制得橙皮果胶乳化液。
1.4 橙皮果胶的乳化特性
1.4.1 果胶浓度对橙皮果胶乳化液乳化特性的影响
称取6种橙皮果胶粉末,分别制备质量浓度为4、6、8、10 g/L的橙皮果胶乳化液,测定不同果胶浓度对乳化液乳化特性的影响。
1.4.2 pH对橙皮果胶乳化液乳化特性的影响
先使用Na2HPO4和NaH2PO4溶液将pH值调至4~9,然后分别用HCl和NaOH溶液调pH值至3、5、7、9,用上述4种溶液分别配制果胶质量浓度为4 g/L的橙皮果胶乳化液,并在常温下测定各乳化液的乳化性质。
1.4.3 Ca2+浓度对橙皮果胶乳化液乳化特性的影响
先制备0、0.2、0.4和0.8 mol/L的Ca2+溶液,用上述4种溶液分别配制果胶质量浓度为4 g/L的橙皮果胶乳化液,并将乳化液pH值调至3,然后在常温下测定Ca2+浓度对乳化液的乳化性质的影响。
1.4.4 温度对橙皮果胶乳化液乳化特性的影响
为了研究冷藏、常温、加热条件下橙皮果胶乳化特性,将橙皮果胶乳化液的pH调节至5,然后分别置于0、20和100 ℃,20 min后测定温度对其乳化特性的影响。
1.5 乳化特性的测量指标
1.5.1 乳化活力和乳化稳定性测定
将100 μL橙皮果胶乳化液用质量分数为0.1% SDS溶液稀释250倍。以质量分数为0.1% SDS溶液为空白对照,测定在500 nm波长下0 min时的吸光值(A0),再测定10 min后的吸光值(A10),其中乳化活力(emulsifying activity, EAI)用A0表示,乳化稳定性(emulsion stability, ESI)按照公式(1)计算[9]:
(1)
式中:A0,0 min时测得的样品吸光值;ΔT,2次测定的时间间隔,本次实验中取10 min;A10,10 min后测得样品吸光度值。
1.5.2 乳化液滴尺寸的测定
用激光粒度分析仪测定乳化液液滴尺寸,取1 mL橙皮果胶乳化液,以水为分散介质,测出乳状液油滴体积加权平均直径(D[4,3])[10]。体积加权平均直径按照公式(2)测定:
(2)
式中:di和ni分别为液滴直径和液滴数量,每次测量重复3次。
1.5.3 絮凝指数测定
参考陈益春等[11]所描述的方法测定絮凝指数。以质量分数为1% SDS溶液为分散介质,测定乳化液液滴体积加权平均直径D[4,3~1% SDS]。乳化液中油滴体积的絮凝指数(flocculation index, FI)的计算公式如公式(3)所示:
(3)
式中:D[4,3]是以水为分散介质时乳化液液滴体积加权平均直径;D[4,3~1% SDS]是以质量分数为1% SDS溶液为分散介质时乳化液液滴体积加权平均直径。
1.5.4 Zeta电位的测定
利用激光粒度仪测定乳化液的Zeta电位,将乳化液稀释10倍后,吸取1 mL于样品槽中,在20 ℃下测定Zeta电位。
2 结果与讨论
2.1 橙皮果胶不同方法的提取结果
HBOP的提取率是(2.54±0.09)%,CHOP的提取率是(10.60±1.62)%,DAOP的提取率是(12.09±1.06)%,CAOP的提取率是(2.70±0.1)%,顺序提取过程中提取液极性的增加,使得橙皮中的果胶得到了充分的提取,CAOP的提取率降低表明了在前面的提取过程中大部分橙皮果胶已被提取出来。AEOP的提取率达到了(13.84±0.39)%,EEOP的提取率高达(17.14±0.36)%。
2.2 橙皮果胶乳化液的乳化活力和乳化稳定性
2.2.1 果胶浓度对橙皮果胶乳化液乳化活力和乳化稳定性的影响
如图1-A所示,6种乳化液的乳化活力都随着多糖浓度的增加而增加,但上升的速率有所不同,这可能是由于通过不同提取方法获得的橙皮果胶的性质不同。其中,CHOP的乳化活力最大,HBOP次之。CAOP的乳化活力在前期随浓度的变化较小,当质量浓度大于6 g/L时,乳化液的乳化活力增加的较快。DAOP的乳化活力最差,乳化活力随果胶浓度的增加基本不变。
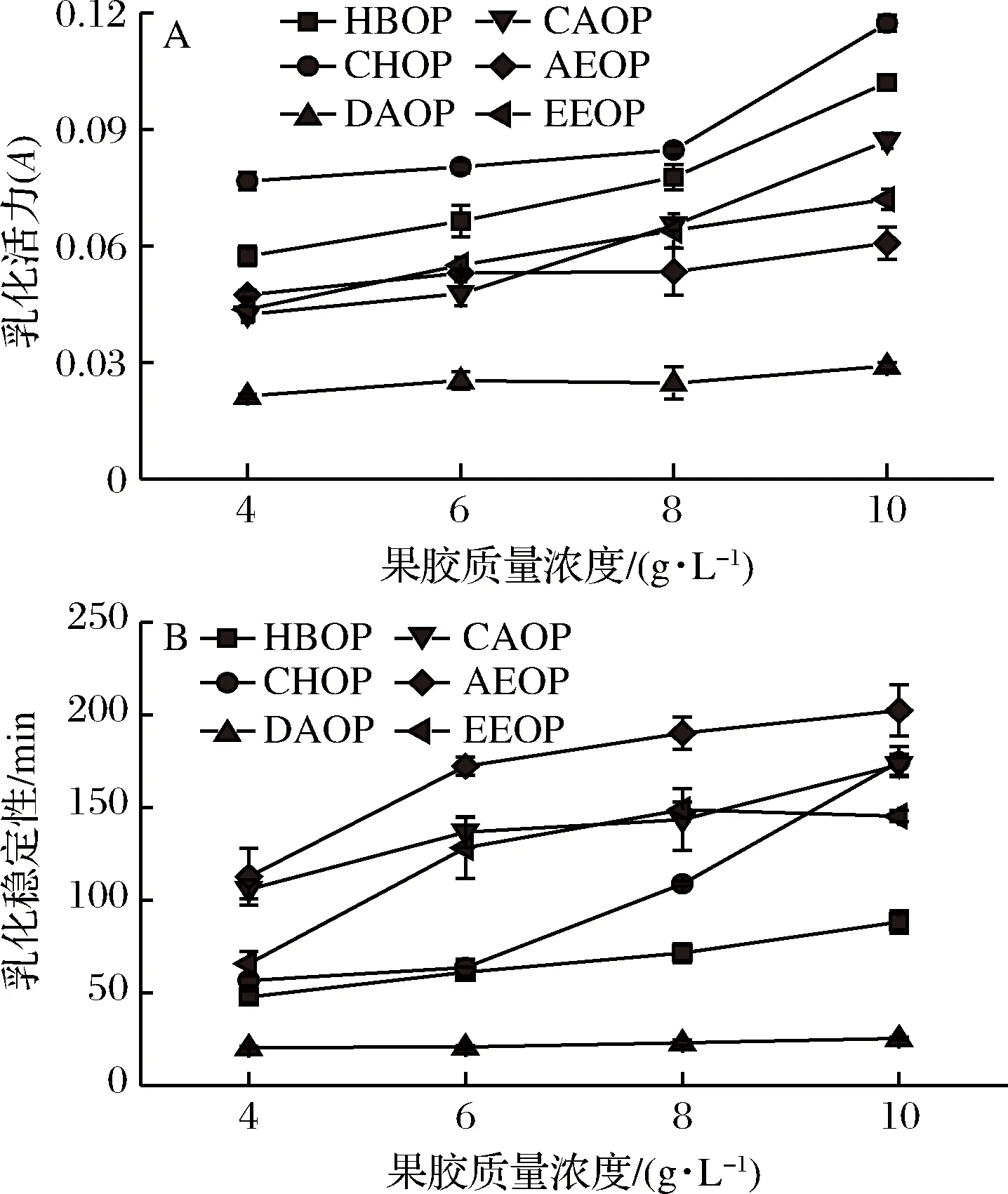
图1 果胶质量浓度对乳化活力(A)和乳化稳定性(B)的影响Fig.1 Effects of pectin concentration on emulsifyingactivity (A) and emulsion stability (B)
乳化稳定性可用来评定体系保持乳状液分散而不沉淀的能力。从图1-B中可见,除了EEOP的乳化活力在果胶质量浓度大于8 g/L时略有下降,其他组分都处于上升的趋势。AEOP的乳化稳定性最高,而DAOP的乳化稳定性几乎没有变化。黄晓德等[12]认为乳化活力与多糖分子含有的羟基数量有关,羟基使得乳化液具有分子极性,可以使多糖分子通过范德华力结合在油-水界面上,促使乳滴表面形成胶体薄膜,防止乳滴聚集。乳化特性与多糖-蛋白质复合物分子量也有关系,大分子量有利于空间结构的稳定,能有效抑制油滴的聚集。
2.2.2 pH对橙皮果胶乳化液乳化活力和乳化稳定性的影响
如图2-A所示,6种乳化液的变化趋势均有明显差别。HBOP、DAOP、AEOP、EEOP的乳化活力呈现出先上升后下降的变化。其中HBOP在pH 5时达到最大值,pH 7之后乳化活力的变化趋于平缓,与其他3组相比,变化幅度最大,可能是低pH时果胶的溶解度低,形成了较大的乳化液滴,pH的持续提高会使乳化液滴表面的电荷增加,增强表面疏水性,但是碱性过强可能会引起立体化学反应,改变乳化液的官能团和结构[13]。CHOP的乳化活力在低pH值下呈现非常高的乳化活力,并随着pH的增加而降低。这可能是因为在强酸条件下,橙皮果胶具有高溶解性和高表面电荷,从而表现出更好的乳化性能。CAOP在pH 5时乳化活力较小,此时果胶中蛋白质组分在处于等电点附近,表面所带净电荷几乎为零,亲水性降低,导致吸附在油-水界面的蛋白质含量减少,乳化活力最低。
由图2-B可以看出,除了pH 3时HBOP的乳化稳定性低于CHOP,pH在5~7范围,均大于其他橙皮果胶。DAOP的乳化稳定性在pH 5~9范围内最小。但总体上随着pH的升高,6种橙皮果胶乳化液的乳化稳定性均呈现先上升后下降的变化,并都在pH 5时达到最大值。这是因为乳化液在接近等电点时,乳化液内部不存在静电排斥力,分子在油-水界面的重排能够促进高黏弹性薄膜的形成,抑制了油滴聚集和上浮,进而提高了乳化稳定性[14]。
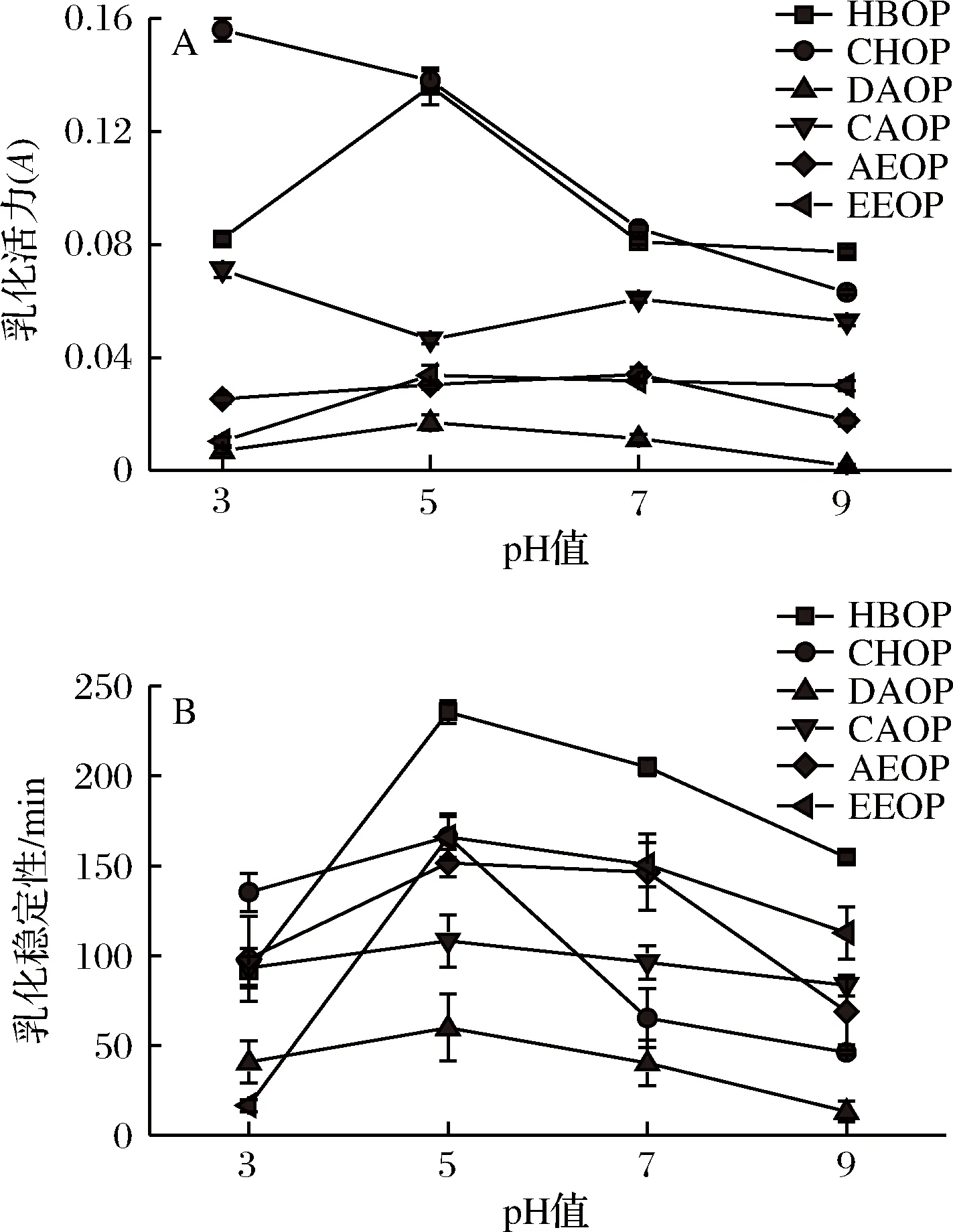
图2 pH对乳化活力(A)和乳化稳定性(B)的影响Fig.2 Effects of pH on emulsifying activity (A) andemulsion stability (B)
2.2.3 Ca2+浓度对橙皮果胶乳化液乳化活力和乳化稳定性的影响
从图3-A可见,Ca2+浓度对不同橙皮果胶乳化液乳化活性的影响有所不同。加入Ca2+后,CHOP和DAOP的乳化活力显著下降,随着Ca2+浓度的增加其乳化活力有所回升。CLARK等[15]认为由于屏蔽效应,高离子强度会降低蛋白质与所带电荷相反的聚合物之间的静电吸引作用,因此在pH 3时,高浓度Ca2+会降低乳化液中蛋白质和多糖之间相互作用的程度,有利于蛋白质在界面的吸附,因此随着Ca2+浓度的增加呈现出一定的上升趋势。但是AEOP、EEOP和CAOP的乳化活力持续上升可能是由于提取方法的差异性。由图3-B可知,6种橙皮果胶乳化液的乳化稳定性随着Ca2+浓度增加而下降,其中AEOP和EEOP的乳化稳定性下降最快。这可能归因于Ca2+的存在降低了果胶的溶解度,增加了其自由活化能,从而降低了乳化稳定性。郭庆等[16]在研究甘薯蛋白的乳化特性时发现,界面吸附的蛋白质与Ca2+可通过S—S键形成高分子聚合物,这种高聚物也会存在于乳化颗粒之间,最终降低乳化液的乳化稳定性。
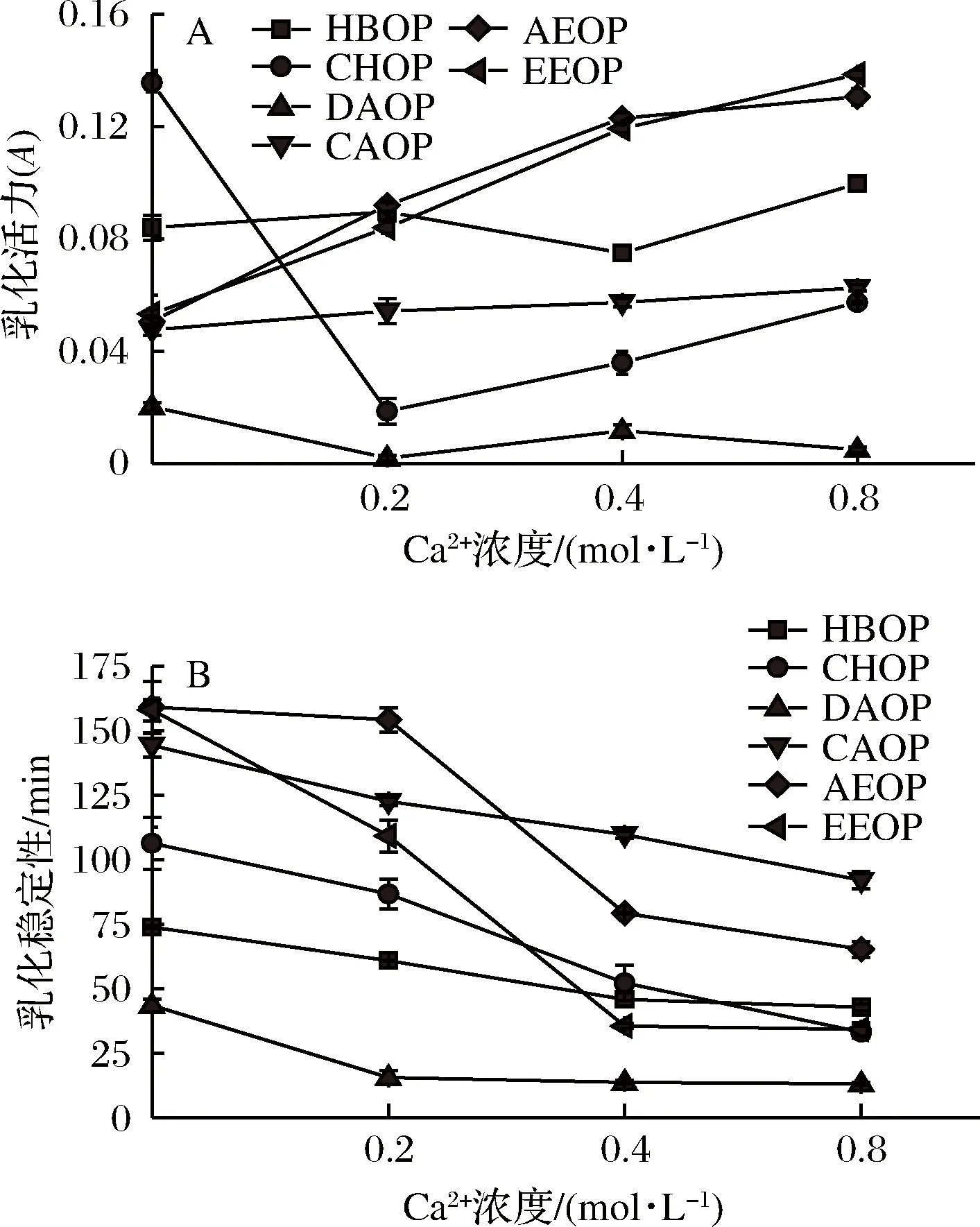
图3 Ca2+浓度对乳化活力(A)和乳化稳定性(B)的影响Fig.3 Effects of Ca2+ concentration on emulsifyingactivity (A) and emulsion stability (B)
2.2.4 温度对橙皮果胶乳化液乳化活力和乳化稳定性的影响
图4-A表明在室温条件下,6种果胶都具有较好的乳化活性,温度过高或过低都会降低乳化活力,但AEOP和EEOP在加热之后乳化活力反而增加,DAOP乳化活力仍是最小,这可能是因为提取缓冲液和方法影响了果胶的结构,导致最终乳化特性不同。从图4-B可以看到,除了HBOP、CHOP和DAOP组分外,其他橙皮乳化液乳化稳定性均呈现出先升高后降低的现象。CAOP的乳化活力和乳化稳定性都在常温时达到最大值,这是由于适当的升温可以促使果胶解离和提高结构的伸展性,使果胶更好地吸附在乳化界面上。但是温度的进一步升高会破坏果胶中蛋白质的结构,造成变性,降低蛋白质的溶解度和黏度,蛋白质的水合能力也降低,从而导致乳化活力和乳化稳定性的降低[17]。
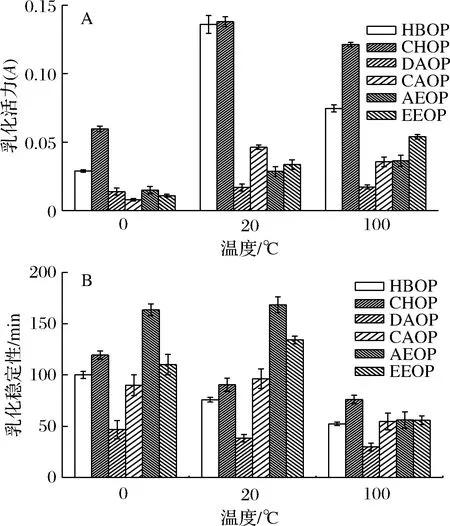
图4 温度对乳化活力(A)和乳化稳定性(B)的影响Fig.4 Effects of temperature on emulsifying activity (A)and emulsion stability (B)
2.3 絮凝指数分析
2.3.1 果胶浓度对橙皮果胶乳化液絮凝指数的影响
絮凝会影响贮存时乳状液的稳定性,絮凝指数越大,乳状液越容易发生絮凝。如图5所示,除了CHOP,其他果胶随着浓度的升高乳化液的絮凝指数均有所下降,表明较高的果胶浓度有利于抑制乳化液产生絮凝。乳化液浓度的增加会使液滴表面覆盖水胶体膜,可以提高乳化液的乳化稳定性,CHOP絮凝指数的增加可能是因为多糖分子的相互作用不够迅速,水胶体分子覆盖之前可能就已经发生絮凝。DICKINSON[18]认为在低果胶浓度时乳化液易发生絮凝,高浓度时则表现出较好的抗絮凝现象,可能是因为果胶分子从水-油界面上释放出来要消耗大量的能量,这种絮凝稳定性可归咎于果胶分子紧密地的吸附在油-水界面上。油-水界面液滴的空间位阻、乳状液与界面之间的网状结构也对抗絮凝起了一定的促进作用。
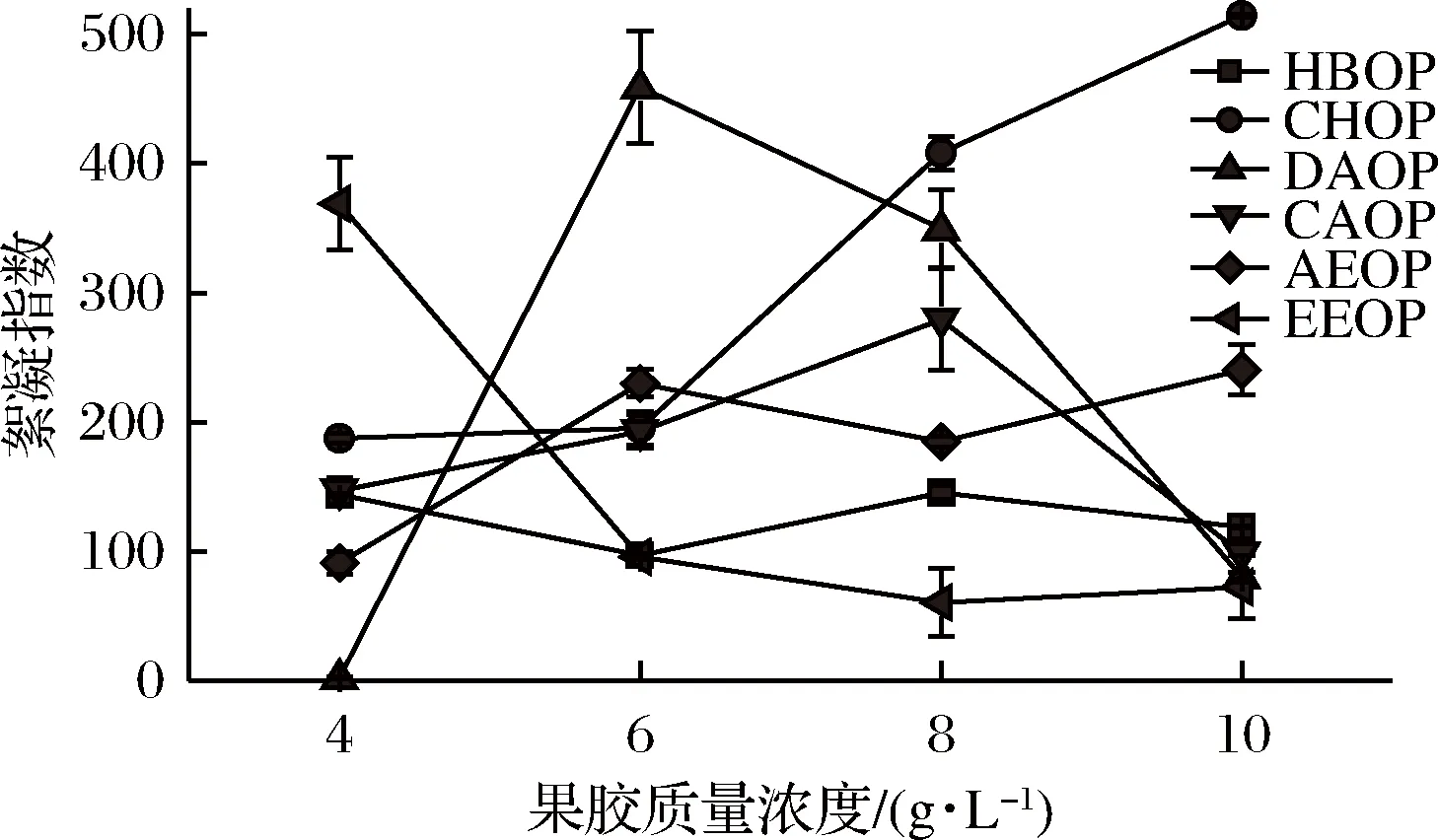
图5 果胶质量浓度对絮凝指数的影响Fig.5 Effect of pectin concentration on the flocculation index
2.3.2 pH对橙皮果胶乳化液絮凝指数的影响
从图6可以看出,在接近等电点时,橙皮果胶乳化液的絮凝指数较大,强酸或碱性条件下,都有一定程度的降低,其中以DAOP的絮凝指数变化幅度最大。因为在酸性或碱性条件下,乳化液滴表面带有电荷,液滴之间通过静电相互作用而彼此排斥,阻止了液滴相互靠近,从而抑制了聚集形成大颗粒。在中性pH时,液滴表面的净电荷几乎为零,斥力减弱,易发生聚集沉淀。HBOP、CAOP、AEOP和EEOP的絮凝指数相近且都比较低,但是这4种橙皮果胶乳化性的乳化稳定性有高有低,说明乳化液的絮凝指数和乳化稳定性有所不同,测量这2个指标有助于更全面地讨论乳化液的性质。

图6 pH对絮凝指数的影响Fig.6 Effect of pH on the flocculation index
2.3.3 Ca2+浓度对橙皮果胶乳化液絮凝指数的影响
从图7可以看出,添加Ca2+后,6种橙皮果胶乳化液的絮凝指数增加,虽然DAOP的絮凝指数在Ca2+浓度大于0.4 mg/mL时出现了大幅度降低,但仍然比不加Ca2+的絮凝指数高。HBOP的絮凝指数次之,其他提取方式得到的橙皮果胶乳化液的絮凝指数差异不大。这种现象产生的原因可能是由于Ca2+的加入使乳化液含有大量正电荷,它会中和液滴表面的负电荷液,从而产生静电屏蔽,液滴间发生聚集,导致乳化液絮凝[19]。还有乳化液滴之间存在桥连作用,Ca2+与多糖-蛋白质复合物会通过这一桥连作用,使细小的液滴絮凝形成更大的液滴,增加了絮凝指数。其他提取方式得到的橙皮果胶乳化液的絮凝指数差异不大。

图7 Ca2+摩尔浓度对絮凝指数的影响Fig.7 Effect of Ca2+ concentration on the flocculationindex
2.3.4 温度对橙皮果胶乳化液絮凝指数的影响
从图8可以看出,在常温条件下HBOP、CAOP和AEOP的絮凝指数最低,说明其在常温下较为稳定,且CAOP和AEOP的絮凝指数都比较低且受温度的影响较小。在所有温度条件下,DAOP的絮凝指数都最高,这可能是提取方法的不同引起的,弱碱提取环境中DAOP既进行了脱脂作用,也发生了β-消去反应,但降脂反应会逐渐减弱,持续的β-消去反应破坏了果胶分子结构,导致乳化液体系对外界因素较为敏感[20],温度的升高使果胶的结构发生部分改变,隐藏在内部的极性侧链和疏水性位点暴露出来,疏水作用力的增加,从而导致絮凝指数增加。
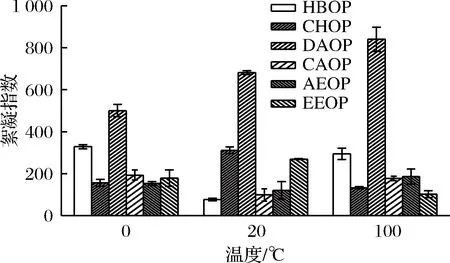
图8 温度对絮凝指数的影响Fig.8 Effect of temperature on the flocculation index
2.4 液滴尺寸和Zeta电位的测定
2.4.1 果胶浓度对橙皮果胶乳化液液滴尺寸和Zeta电位的影响
从图9-A可以看出,果胶浓度对橙皮果胶乳化液液滴尺寸的影响主要分为3种情况。第1种是随着果胶浓度增加乳化液的液滴尺寸下降,如DAOP;第2种是随着果胶浓度增加,乳化液的液滴尺寸变化较小,如HBOP、CAOP、AEOP、EEOP;第3种是随着果胶浓度增加,乳化液的液滴尺寸增加,如CHOP,这表明CHOP在低果胶浓度时已在界面吸附完全,随着浓度增加,没有吸附的CHOP会由于消耗机理从而聚凝,因此导致测得的乳化液液滴尺寸增加,在均质过程中,乳化剂可以迅速吸附到油-水界面上,有效地阻止絮凝[21]。
乳化液Zeta电位能有效反映液滴间的静电相互作用的程度,表面所带净电荷越多,液滴之间静电斥力越强,乳化液也就越稳定。如图9-B所示,所有乳化液液滴都带着负电荷,随着浓度的增加,不同提取方法得到的橙皮果胶的Zeta电位变化情况也有所不同。随着果胶浓度增加,DAOP保持着较大的Zeta电位。然而根据图1-B和图9-A可知,浓度增加DAOP乳化稳定性较差。这也说明了Zeta电位并不能决定乳化液的稳定性,也不能决定乳化液液滴尺寸大小,这是因为当Zeta电位值差异较小,还需要考虑界面张力和乳化液黏度等多个方面。

图9 果胶质量浓度对液滴尺寸(A)和Zeta电位(B)的影响Fig.9 Effects of pectin concentration on droplet size (A)and Zeta potential (B)
2.4.2 pH对橙皮果胶乳化液液滴尺寸和Zeta电位的影响
如图10-A所示,HBOP、CAOP、AEOP和EEOP的液滴尺寸随着pH增大而减小。pH增大,CHOP的液滴尺寸先增大后减小。梅新等[22]发现pH会影响甘薯果胶的电离程度,低pH抑制果胶中半乳糖醛酸的电离,乳化颗粒所带的电荷减少,因排斥作用减弱而易发生聚集,液滴粒径增大。pH缓慢增加促进了果胶电离,液滴表面的净电荷增加,静电排斥力增强,液滴尺寸减小。
乳化液是一种热力学不稳定体系,Zeta电位不仅取决于原材料,还取决于乳化体系中pH值和离子强度。图10-B显示当pH增加,6种橙皮果胶乳化液的Zeta电位绝对值出现上升,这可能是由于pH增加,OH-变多,乳化液滴表面负电荷增多,导致分子间斥力增大从而使Zeta电位绝对值上升,促进乳化液的稳定性。
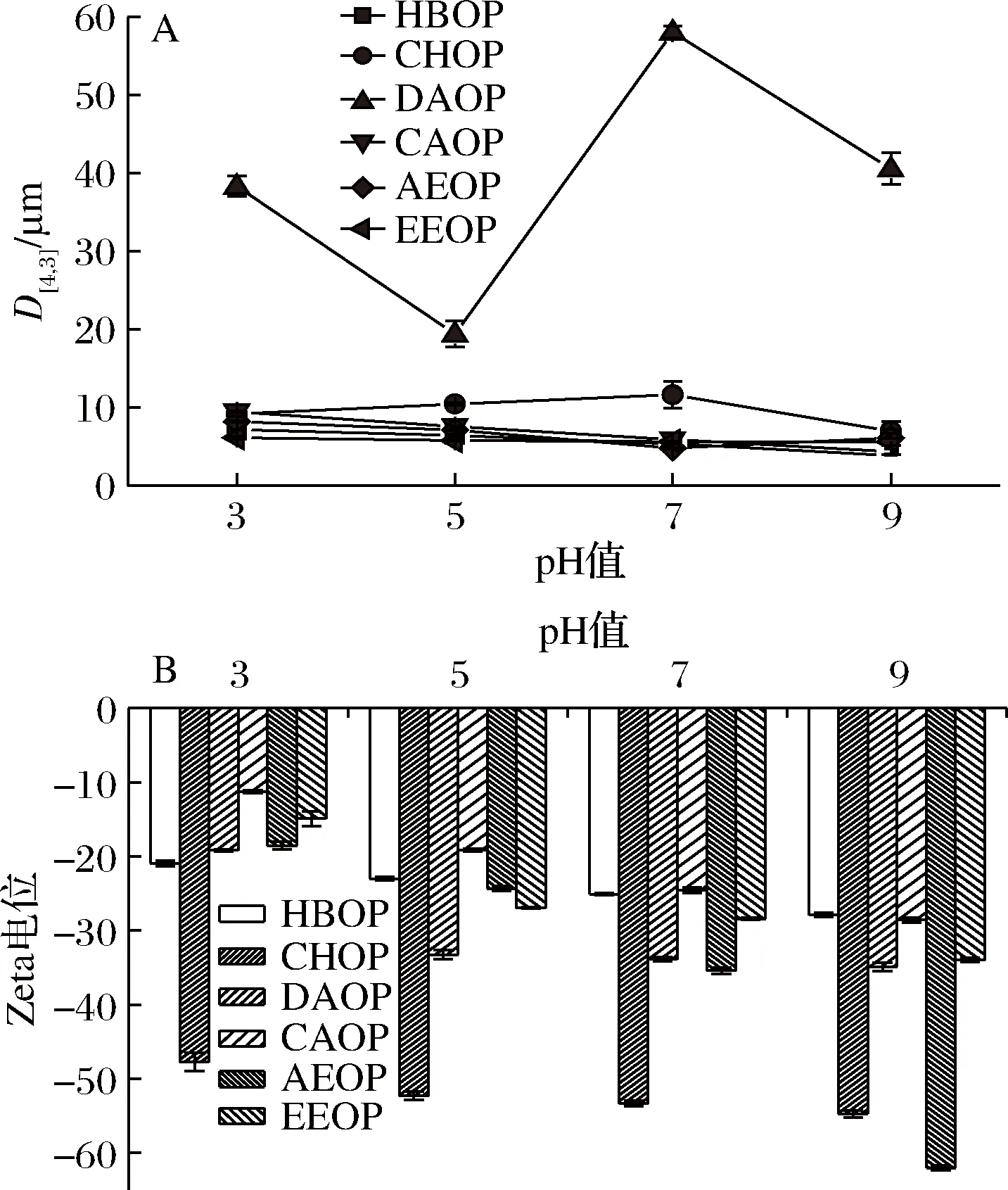
图10 pH对液滴尺寸(A)和Zeta电位(B)的影响Fig.10 Effects of pH on droplet size (A) and Zetapotential (B)
2.4.3 Ca2+浓度对橙皮果胶乳化液液滴尺寸和Zeta电位的影响
从图11-A可以看出,HBOP、CHOP和CAOP对Ca2+浓度比较敏感。钙盐对乳化液液滴尺寸的影响主要有两种形式,一种是由于Ca2+带来的静电筛选产生静电屏蔽从而使分子间静电排斥增加,因此有助于分子链扩散。另一种是随着正离子的加入分子间斥力可能会减少从而导致液滴聚集[23]。出现不同的变化趋势主要看哪一种影响占优势,第1种反应占优势则液滴尺寸下降,第2种反应占优势则液滴尺寸增加。
从图11-B看出,Ca2+浓度的增加使得Zeta电位的绝对值出现了不同程度的降低,Ca2+浓度大于0.4 mol/L后逐渐趋于平缓。这与NAKAUMA等[24]在研究盐类型对甜菜果胶乳化特性的影响时观察到的现象相同。盐的加入引起油滴之间发生絮凝作用,通过静电斥力的筛选和氢键或配位键的桥接作用,导致Zeta电位绝对值降低。此外,他们认为Ca2+可以增强配位键的桥接效果,相较于Na+更易降低乳液稳定性。
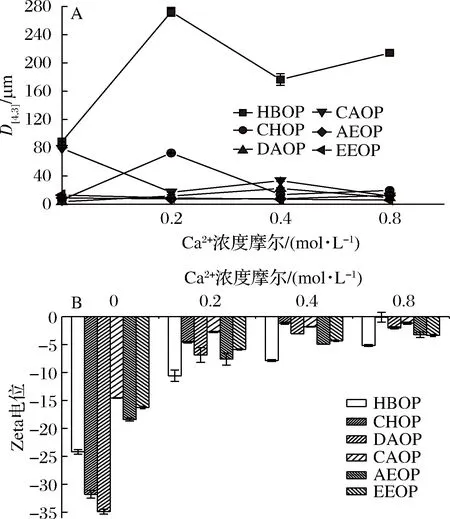
图11 Ca2+浓度对液滴尺寸(A)和Zeta电位(B)的影响Fig.11 Effects of Ca2+ concentration on dropletsize (A) and Zeta potential (B)
2.4.4 温度对橙皮果胶乳化液液滴尺寸和Zeta电位的影响
如图12-A所示,DAOP的粒径大小总是大于其他组分,倾向于沉淀。HBOP、CAOP和AEOP在室温下的液滴尺寸最小,在冷冻和加热后液滴尺寸均显著增加。这可能因为温度过高或过低对橙皮果胶的结构影响很大,其中蛋白质的机构展开,疏水性位点暴露出来,疏水相互作用增强导致液滴之间相互聚集,发生絮凝,所以粒径增大。
从图12-B可见,HBOP、CHOP和DAOP的Zeta电位受温度的影响较大,其中,CHOP的Zeta电位在6个组分中是最大的,且0 ℃时达到最高。CAOP、AEOP和EEOP的Zeta电位虽有稍微波动,但受温度的影响较小。随着提取方式的改变,获得果胶的结构和组成成分的差异性很大,所以各种乳化液Zeta电位的数值差异可能是由提取方法的不同导致。

图12 温度对液滴尺寸(A)和Zeta电位(B)的影响Fig.12 Effects of temperature on droplet size (A) andZeta potential (B)
3 结论
6种橙皮果胶的乳化活力和乳化稳定性均随果胶浓度的增加呈现上升的趋势,并在10 g/L时达到最大值。其中CAOP的乳化活力仅次于HBOP和CHOP,并且除DAOP外,其他果胶都具有较低的液滴尺寸。6种橙皮果胶在pH 5时乳化稳定性最好,但CAOP在其他pH下仍可以保持较好的乳化活力和稳定性,以及较小的液滴粒径。尽管Ca2+浓度对6种橙皮果胶的Zeta电位影响明显,但CAOP依然具有很好的乳化稳定性和最小的絮凝指数。6种橙皮果胶在常温下均呈现出较好的乳化活力和乳化稳定性,但相较于其他果胶,CAOP具有更小的絮凝指数和粒径大小。因此CAOP在不同的影响因素下都能表现出很好的乳化性质,很适合作为理想的食品乳化剂。
