分散固相萃取-HPLC-MS/MS法测定热带水果中4-氯苯氧乙酸
2020-01-13候德莉梁振纲陈文慧王玉健尹志兵
候德莉,梁振纲*,陈文慧,王玉健,尹志兵
1. 海南出入境检验检疫局检验检疫技术中心(海口 570311);2. 海南大学材料与化工学院(海口 570228)
4-氯苯氧乙酸又称防落素、促生灵、番茄灵等,是一种内吸、广谱、高效的酚类植物生长调节剂,由植物的根、茎、叶、花、果吸收进入植物体内[1],能防止作物落花落果、促进果实发育、形成无籽果实、提早成熟、增加产量、改善品质等[2-3]。随着4-氯苯氧乙酸应用范围的不断扩大,其在人体内的残留和累积可能带来健康隐患。已有研究表明,4-氯苯氧乙酸对小鼠的肝脏、肾脏以及成熟精细胞具有毒性作用[4-6]。因此,有必要建立准确、快速、高效的4-氯苯氧乙酸残留检测方法。目前,检测4-氯苯氧乙酸的方法有离子色谱法[7]、气相色谱法[8-9]、气质联用色谱法[10-11]、液相色谱法[12-14]以及液质联用色谱法[15-18]。液质联用色谱法灵敏度高、定性准确,能够有效排除杂质干扰,是目前4-氯苯氧乙酸残留分析的主要手段。但现有文献前处理多为固相萃取[19-20]、液-液萃取[21-22]等,耗时长且成本高。分散固相萃取技术利用吸附剂与基质中的杂质相互作用而达到除杂净化的目的,具有快速、简便、低成本、环境友好等优势。因此,试验采取分散固相萃取净化,高效液相色谱串联三重四级杆质谱检测,建立了以石墨化碳黑为分散萃取剂测定热带水果中4-氯苯氧乙酸的检测方法。
1 试验部分
1.1 材料与试剂
乙腈、甲酸(色谱纯,美国TEDIA公司);石墨化碳黑净化剂(美国Agilent公司);微孔滤膜(0.22 μm,有机系);4-氯苯氧乙酸标准品(纯度≥99.0%,购自天津阿尔塔科技有限公司)。
标准溶液:用乙腈配制成1 000 μg/mL标准储备液,于-20 ℃避光保存。
1.2 仪器与设备
Agilent 1200超高效液相色谱仪(美国安捷伦公司);API 4000 Q四极杆质谱仪(美国ABI公司);配有电喷雾离子源;Harvard II针泵(美国Varian公司);MS3 Basic旋涡混匀器(广州IKA公司);Centrifuge 5810 R离心机(Eppendorf公司);G-285电子天平(Mettler公司)。
1.3 前处理方法
准确称取5 g(精确至0.01 g)粉碎均质后的水果样品至50 mL具塞离心管中,加入10 mL乙腈,涡旋振荡3 min,加入5 g无水硫酸钠,涡旋混合1 min,以4 000 r/min离心10 min,分取1 mL至玻璃试管中,加入100 mg GCB吸附剂,涡旋混合30 s后,以4 000 r/min离心3 min,取上清液,待测。
1.4 色谱条件
色谱柱:Thermo Accucore RP-MS(3 mm×150 mm,2.6 μm)。流速:0.6 mL/min。柱温:40 ℃。进样量:10 μL。流动相:乙腈-0.1%甲酸水溶液。梯度洗脱程序见表1。
1.5 质谱条件
电喷雾离子源(ESI);负离子扫描;多反应监测(MRM)模式;离子源温度600 ℃;离子源电压5 500 V;雾化气、气帘气、辅助气和碰撞气均为高纯氮气。将4-氯苯氧乙酸标准品溶液采用流动注射直接进样,通过全扫描确定化合物母离子,再对母离子进行二级质谱扫描,得到碎片离子;通过优化条件,得到二级质谱图。根据二级质谱图,推断4-氯苯氧乙酸可能的断裂方式,如图1所示。

图1 4-氯苯氧乙酸可能的断裂方式
通过MRM选择相对丰度较高的离子对,确定为定性定量离子对,并优化去簇电压(DP)、碰撞电压(CE)等参数。优化后的质谱条件见表2。
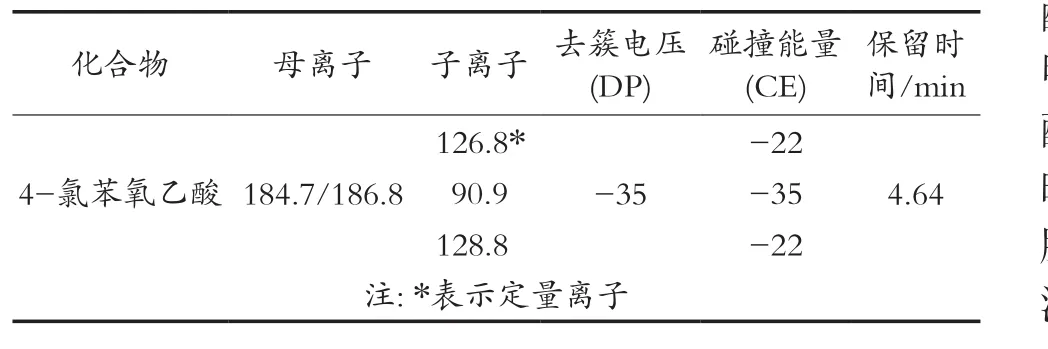
表2 MRM模式下4-氯苯氧乙酸的扫描参数
2 结果与讨论
2.1 提取溶剂的选择
4-氯苯氧乙酸为酚酸化合物,易溶于甲醇、乙腈、丙酮和苯。乙腈作为一种通用的提取溶剂,以其对蛋白质、糖类和脂肪难提取,能有效消除基质效应影响的优势,在残留检测中得到广泛应用[23-24]。由于4-氯苯氧乙酸为羧酸化合物,提取体系的pH会影响其在水相和乙腈相之间的分配平衡[25],试验对比了乙腈和1%乙酸-乙腈两种提取溶剂,结果表明,选用含有1%乙酸-乙腈作为提取溶剂,其平均回收率显著提高。因此选择1%乙酸-乙腈作为提取溶剂。
2.2 净化条件的选择
热带水果样品基质复杂,含有大量的糖分和有机酸类化合物,在未净化处理时有基质增强效应。试验比较了PSA、Florisil、中性氧化铝(AL-N)、C18、C8和GCB等净化方式。其中,加入PSA、Florisil和AL-N后回收率低,原因可能是PSA、Florisil对极性化合物有吸附作用,尤其是PSA对有机酸、酚类的吸附作用强,在净化过程中同时吸附目标化合物,而中性氧化铝(AL-N)的表面是电中性的,容易保留芳香族等富电化合物,也是造成回收率低的原因之一;C18、C8在不同程度上对样品中的色素有吸附作用,加入提取液后溶液明显澄清,但是结果表明,加入后基质增强效应没有减弱,回收率偏高。GCB常用于蔬菜、水果、茶叶中农药残留分析中的样品净化,能有效去除平面分子。试验表明,采用GCB作为净化剂,回收率稳定且符合残留分析要求。不同净化方式在添加水平为10.0 μg/kg时的回收情况见图2。
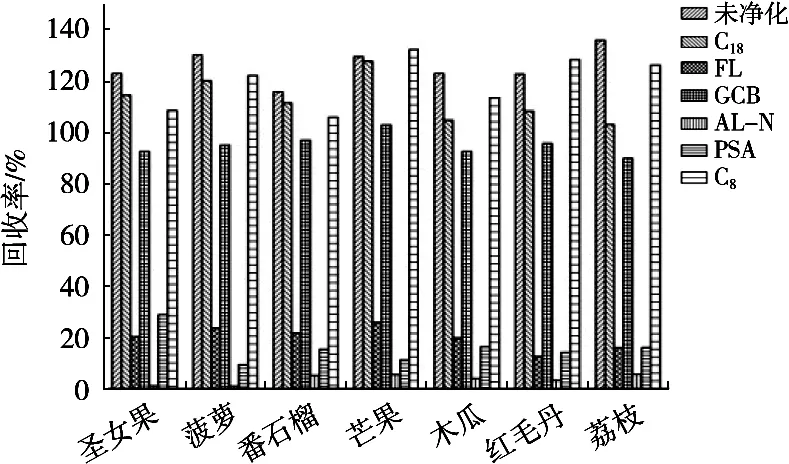
图2 不同净化方式在添加水平为10.0 μg/kg时的回收率范围
2.3 流动相选择
分别考察了甲酸-水体系、乙酸铵-水体系、甲酸-乙酸铵-水体系对峰形、响应值等影响。结果表明,乙酸铵对待测组分有抑制作用,流动相加入乙酸铵后,响应值降低;使用甲醇-甲酸水作为流动相时,色谱柱压力较大,洗脱能力弱,响应值仅为乙腈-甲酸水体系的50%。所以选用乙腈-0.1%甲酸水溶液为流动相。4-氯苯氧乙酸标样MRM色谱图见图3。
2.4 基质效应、线性关系及检出限
基质效应是指在提取基质中的目标化合物时,样品基质中的某些共提取物组分影响目标化合物的离子化,对待测物浓度或质量的测定准确度产生影响,使得目标化合物在仪器上的响应发生增强或者抑制的现象。试验采用相对响应值法[26]考察4-氯苯氧乙酸在7种热带水果中的基质效应。结果显示,进行6平行测试,4-氯苯氧乙酸的基质效应值均在8%~100%之间,基质效应可忽略不计。
配制质量浓度为0.5,1.0,5.0,10.0,25.0和50.0 ng/mL一系列标准曲线,并依次进样,以目标化合物的浓度X为横坐标、相应的峰面积Y为纵坐标,作标准曲线。结果表明,4-氯苯氧乙酸在0.5~50.0 ng/mL范围内有良好的线性关系,线性方程及相关系数见表3。以实际检测时的信噪比(RSN)为3作为检出限,信噪比(RSN)为10作为定量限,该方法的检出限(LOD)为0.3 μg/kg,定量限(LOQ)为1.0 μ g/kg。
图3 多反应监测模式下4-氯苯氧乙酸的标准色谱图

表3 4-氯苯氧乙酸的线性方程和相关系数
2.5 回收率与精密度试验
以荔枝、红毛丹、番石榴、圣女果、菠萝、木瓜、芒果样品作为基质,分别对其添加低、中、高三个水平的4-氯苯氧乙酸,每个添加浓度做6个平行试验,用于考察该方法的回收率和精密度,方法的平均回收率在81.0%~109.4%之间,RSD在2.7%~6.7%之间,结果见表4。7种基质阴性样品和标准添加样品的MRM色谱图见图4。

表4 7种热带水果中4-氯苯氧乙酸的平均回收率和相对标准偏差(n=6)
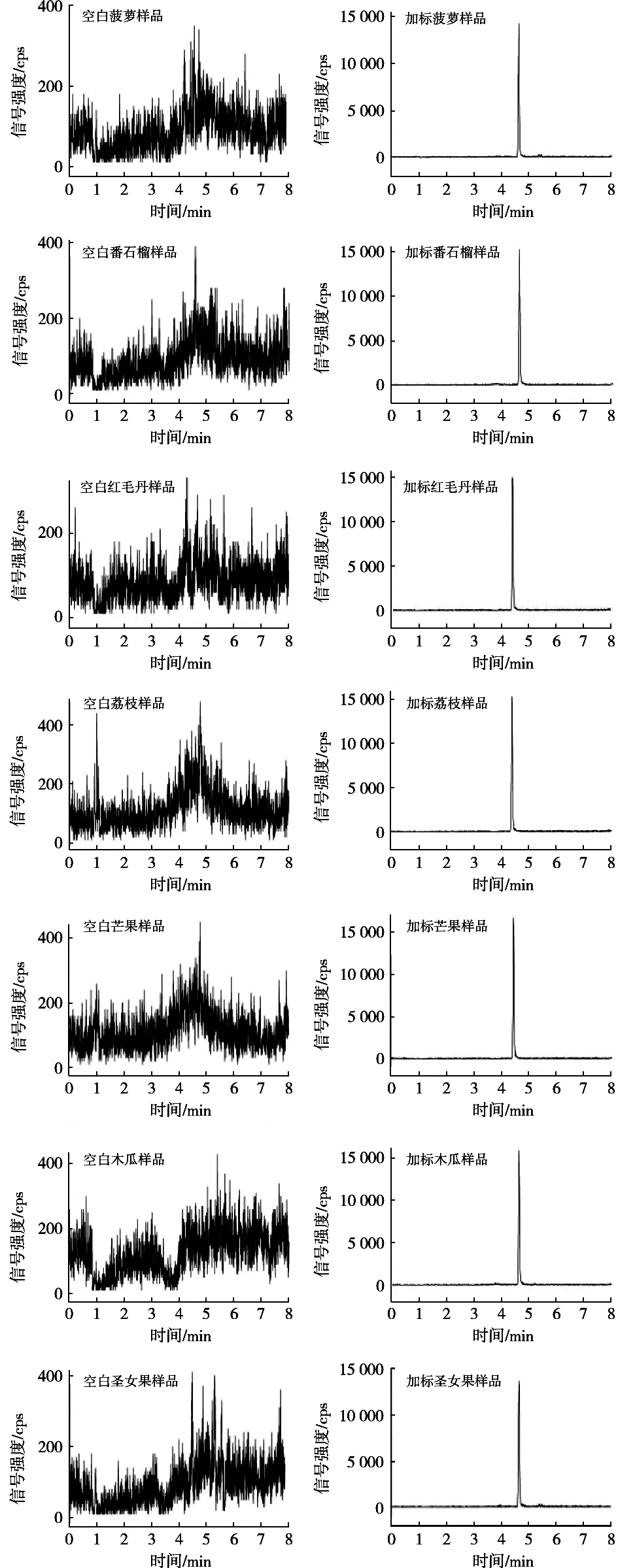
图4 多反应监测模式下7种热带水果阴性样品和标准添加样品色谱图
3 实际样品检测
对近两年海南省156批次出口水果样品进行检测,2个鲜荔枝样品、1个芒果样品检出4-氯苯氧乙酸,检出值分别为33.0,16.0和6.28 μg/kg,检出率为1.92%,其中一个荔枝样品超出日本肯定列表的规定。
4 结论
试验通过对前处理方法中的提取溶剂、净化条件、流动相以及对仪器的色谱和质谱条件进行优化,建立了热带水果中4-氯苯氧乙酸的液相色谱-质谱/质谱检测方法。结果表明,在1.0,10.0和100.0 μg/kg三个添加水平下,回收率范围为81.0%~109.4%,相对标准偏差为2.7%~6.7%,满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》要求。该方法快速简便,定量准确,检出限能达到0.3 μg/kg,能够满足日本肯定列表对热带水果中4-氯苯氧乙酸0.02 mg/kg的限量要求。
