罗汉果花提取液对鲜切苹果保鲜效果的影响
2020-01-13汪洪涛李清光薛珂
汪洪涛,李清光,薛珂
江苏经贸职业技术学院健康学院,江苏省食品安全工程技术研究开发中心(南京 211168)
罗汉果属于我国的葫芦科植物[1],因其具有多种药理作用而被称为“中国神果”,其产地主要集中在广西[2]。罗汉果花是罗汉果的干燥雄花,主要功效有清热解毒、化痰止咳、养声润肺等,经常应用于治疗口臭、口腔炎等疾病[2]。罗汉果花中含有大量的黄酮类化合物,具有抗炎抑菌、降血糖、抗氧化、抗辐射、抗癌、增强免疫能力、提高和稳定视力、保护神经等生理活性[3]。随着生活水平的提高及对自身健康的关注,人们的消费模式从传统的果蔬加工食品如果酱和罐头,开始向新鲜营养、方便无公害的鲜切果蔬转变[4]。与新鲜果蔬相比,鲜切加工引起果蔬生理代谢紊乱,导致营养物质流失,产生褐变,使得保持鲜切产品的感官品质、营养品质及延长货架期成为制约鲜切果蔬发展最大障碍[5]。因此天然保鲜剂因无毒副作用、安全、环保、卫生、营养,很快就成为食品保鲜领域的“新宠”[6],并成为近年来的研究热点。
近年来对罗汉果的研究报道较多但对罗汉果花的开发研究较少,主要在黄酮[1]和皂苷[7]等方面,但对其提取液在果蔬保鲜方面的研究还未见报道,从而造成了罗汉果花资源的极大浪费。为了更好地开发利用罗汉果花资源,拟采用超声波辅助提取罗汉果花中活性物质,通过单因素试验和响应面试验对提取工艺进行优化,并利用提取液对鲜切苹果进行保鲜效果研究,以进一步拓宽罗汉果花的应用领域。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 主要材料与试剂
罗汉果花,市售,试验前于65 ℃恒温烘箱中烘干至恒质量后粉碎,装于密封袋中备用;“红富士”苹果,市售。
无水乙醇、草酸、氢氧化钠、氯化钡、酚酞指示剂,均为分析纯,百灵威化学试剂公司;总抗氧化能力测定试剂盒,南京森贝咖生物科技有限公司。
1.1.2 主要仪器与设备
YP 6001N电子天平,上海元析仪器有限公司;DL-120 B超声波清洗器,合肥攀升超声波科技有限公司;841型电热恒温干燥箱,上海耐美特烘干集团;UV-6100 S型紫外分光光度计,上海佑科仪器仪表有限公司;HWS-26数显恒温水浴锅,上海皓庄仪器有限公司;SHB-3 S型循环水式多用真空泵,郑州长城科工贸有限公司;PAL-1型手持式折光仪,东京AWARO科技公司。
1.2 方法
1.2.1 超声波辅助提取罗汉果花活性物质的基本工艺
在参考大量文献资料的基础上,最终确定乙醇为罗汉果花的最佳提取溶剂。基本提取工艺:准确称取2 g罗汉果花样品,在料液比为1︰15(g/mL)、乙醇体积分数为50%、温度为50 ℃的条件下进行超声波辅助提取,提取时间为1 h。提取后用真空泵进行抽滤,得到的提取液密封保存,待用。
1.2.2 提取液总抗氧化能力的测定
参照总抗氧化能力测定试剂 盒的说明书进行测定。总抗氧化能力的定义:在37 ℃的温度下每分钟每毫升罗汉果花提取液使反应体系的吸光度 每增加0.01时为一个总抗氧化能力单位[8],按式(1)计算。
式中:反应液总量为4 mL;取样量为0.1 mL;样品质量为2 g。
1.2.3 单因素试验
在基本提取工艺的基础 上以罗汉果花提取液总抗氧化能力为评价指标,取罗汉果花样品2 g,其他条件不变,分别改变提取温度(30,40,50,60和70 ℃)、乙醇体积分数(0,20%,40%,60%,80%和95%)、提取时间(30,60,90,120,150和180 min)和料液比(1︰5,1︰10,1︰15,1︰20,1︰25和1︰30 g/mL)进行试验,从而确定每个因素的最佳水平。
1.2.4 响应面优化试验
基于单因素试验,利用软件Design Expert 8.0中的Box-Benhnken中心组合试验设计原理[9],以罗汉果花提取液总抗氧化能力作为响应值进行提取工艺优化。
1.2.5 提取液对鲜切苹果保鲜效果的研究
1.2.5.1 苹果样品处理
用无菌蒸馏水稀释罗汉果花提取液至1 mg/mL的供试原液,在4 ℃条件下避光保存备用。新鲜苹果洗净,用苹果切分器将苹果切成小块,再将1 mg/mL的供试原液用无菌蒸馏水稀释成0.25,0.5和0.75 mg/mL的应用液,将切好的苹果分别放入不同质量浓度罗汉果花提取液中,浸泡3 min,以无菌蒸馏水为对照,取出后晾干水分,装入PE保鲜袋中,在4 ℃条件下贮藏,分别在第0,第2,第4,第6,第8和第10天测定指标,所有指标重复3次,取平均值[10]。
1.2.5.2 可溶性固形物的测定
使用手持式折光仪进行测定。
1.2.5.3 质量损失率的测定
采用称量法,以最初苹果质量与每次测定苹果质量之差占最初苹果质量的百分比表示。
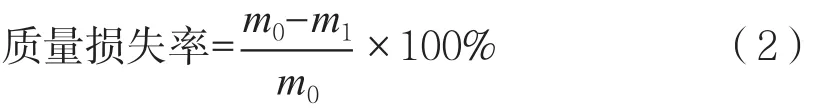
式中:m0表示最初苹果质量,g;m1表示每次测定苹果质量,g。
1.2.5.4 呼吸强度测定
将装有0.4 mol/L氢氧化钠的培养皿置于玻璃干燥器底部,放置隔板,放入处理后的苹果,封盖,静置1 h后,取出培养皿,把氢氧化钠溶液移入试剂瓶中(冲洗3~5次),每组吸取10 mL至锥形瓶中,加2.5 mL饱和氯化钡溶液,滴入一滴酚酞指示剂,用0.3 mol/L草酸滴定,记录消耗的草酸体积,每组2瓶。另吸取10 mL 0.4 mol/L氢氧化钠溶液至锥形瓶中,加2.5 mL饱和氯化钡溶液,滴入一滴酚酞指示剂,做空白滴定,记录消耗的草酸体积,每组一瓶。呼吸强度按式(3)计算:式中:V0表示空白滴定消耗草酸的体积,mL;V1表示测定管消耗草酸体积均值,mL;C表示草酸溶液摩尔浓度,mol/L;M表示样品质量,kg;h表示测定时间,h;44表示CO2摩尔质量,g。

1.2.5.5 感官评定
按照感官评定的要求,随机抽取10人,独立评分,采用多层次综合评判法对鲜切苹果的感官质量进行分析[5]。重复3次,取平均值,评定指标见表1。
2 结果与分析
2.1 单因素试验
依照1.2.3方法进行试验,提取温度、乙醇体积分数、提取时间和料液比对提取液总抗氧化能力的影响结果见图1。
由图1(a)可知,总抗氧化能力到40 ℃时最强,为1 345.79 U/g,故40 ℃为最佳提取温度;由图1(b)可知,随着时间的不断增加,提取液总抗氧化能力也在不断增加,到120 min时达到最强(1 017.42 U/g)。所以确定120 min为最佳提取时间;由图1(c)可知,提取液总抗氧化能力随着料液比逐渐升高而升高,直到料液比为1︰20(g/mL)后趋于平缓,考虑到增大料液比会带来后续浓缩工艺的成本,所以确定1︰20(g/mL)为最佳提取料液比;由图1(d)可知,总抗氧化能力随着乙醇体积分数的增加而增加,到80%时达到最高(1 157.46 U/g),随后立即下降。所以最佳提取乙醇体积分数为80%。
2.2 响应面优化试验
2.2.1 响应面试验设计及结果分析
在单因素试验的基础上,以提取液总抗氧化能力为指标,在提取时间确定为120 min的基础上,选择提取温度、乙醇体积分数、料液比三个因素进行响应面试验,最终得出罗汉果花提取液的最佳提取条件。试验因素水平及编码见表2,响应面试验结果见表3。
通过Design Expert 8.0对表2进行回归数据分析,拟合得到乙醇体积分数(A)、料液比(B)、温度(C)的二次多项回归模型:
总抗氧化能力=1 320.47+52.43A-3.63B+98.88C+102.49AB+32.65AC-20.05BC-140.35A2-232.35B2-112.56C2
对上述回归模型进行了方差分析,结果见表4。模型项p<0.001,非常显著,失拟项p=0.845 1>0.05,不显著,模型的相关系数R2=0.970 6,表明该模型拟合程度好。一次项的F值大小反映因素对响应值的影响程度,F值与各因素对响应值的影响程度成正比[5]。因此,各因素对总抗氧化能力的影响程度次序为提取温度>乙醇体积分数>料液比。软件分析得出变异系数(C.V)4.46%较小,即模型的可靠性高;预测相关系数R2Pred=0.962 7,调整相关系数R2Adj=0.932 8,两者相差较小,表明试验预测值拟合度较好。回归模型中的一次项料液比不显著,二次项乙醇体积分数非常显著、料液比极显著,交互项乙醇体积分数和温度、料液比和温度不显著,数据表明各因素对罗汉果花提取液总抗氧化能力具有显著的效果,并且不是一般的线性关系[11]。
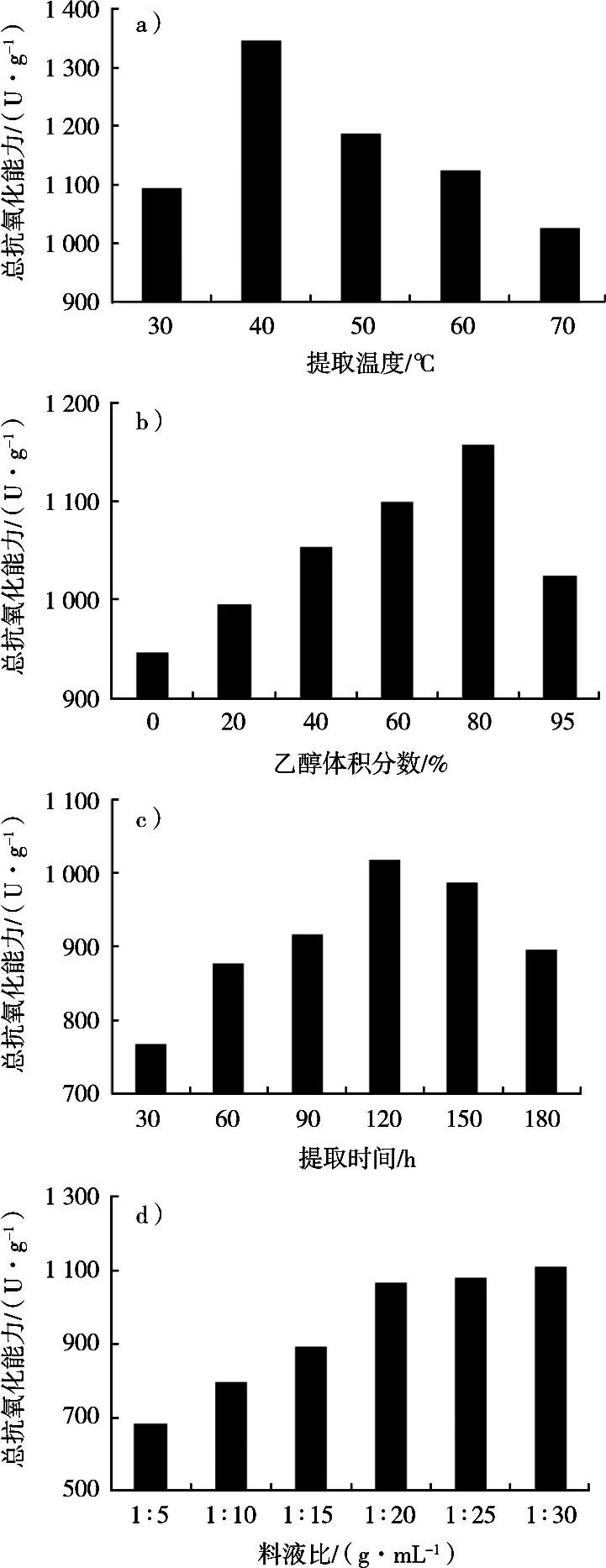
图1 单因素试验结果
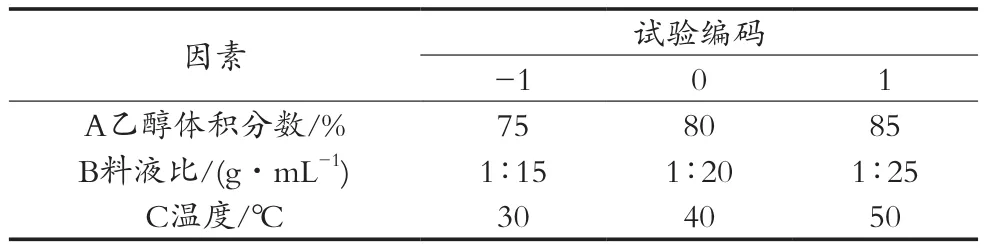
表2 试验因素水平及编码
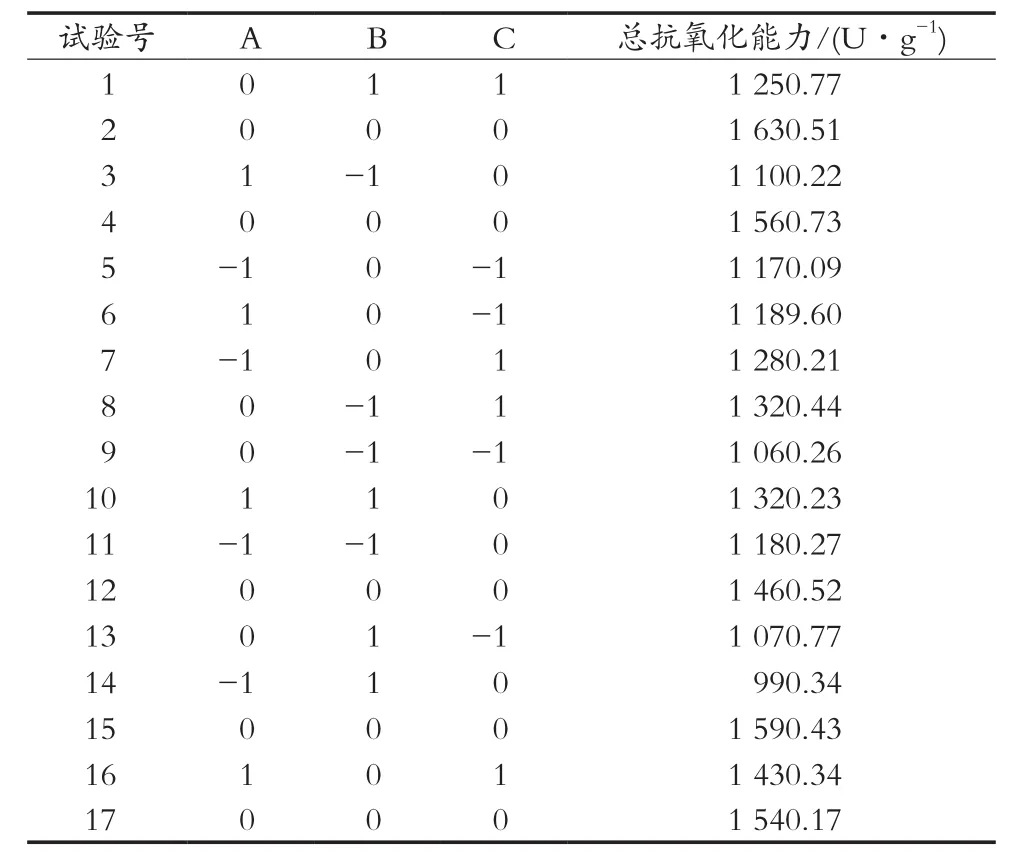
表3 响应面优化试验方案及结果
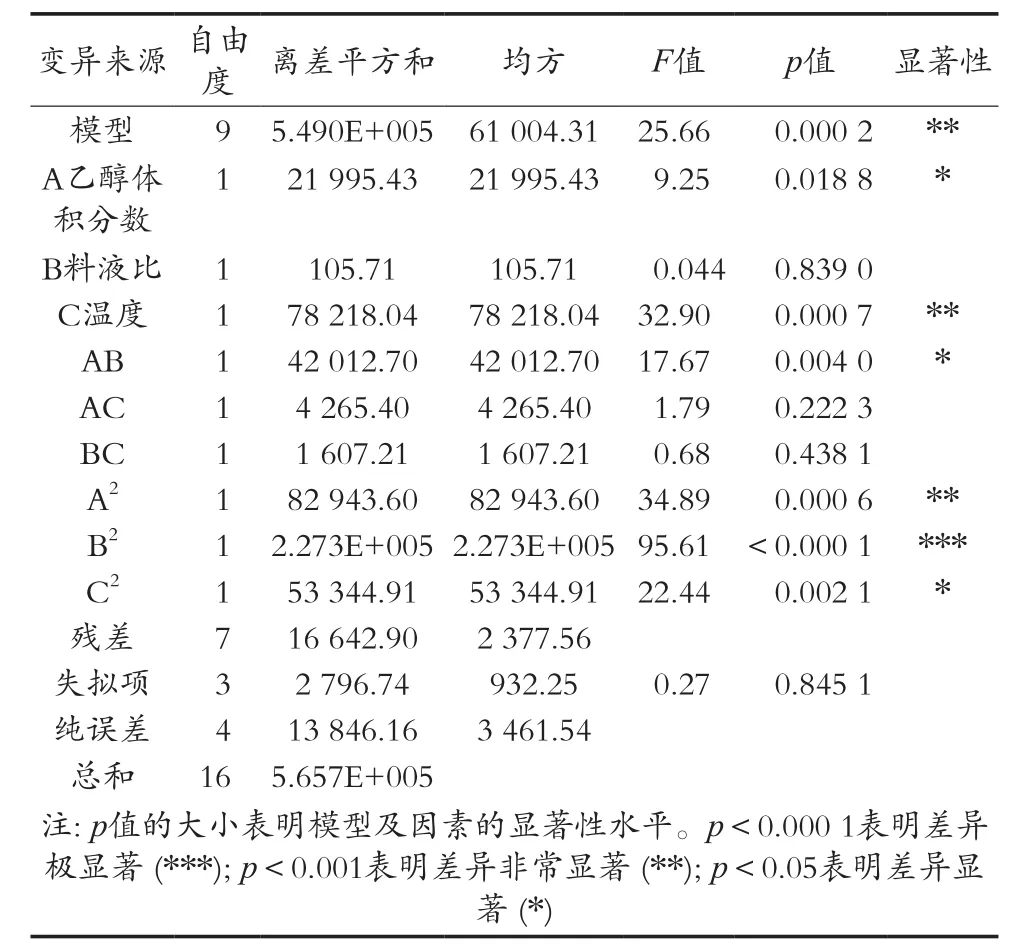
表4 总抗氧化能力方差分析表
2.2.2 各因素之间的交互作用
为进一步考察三个因素中交互作用对罗汉果花提取液总抗氧化能力的影响,用Design Expert 8.0.6软件绘制的三维曲线图表示不同因素对于响应值影响,其中AB之间的交互作用对罗汉果花提取液总抗氧化能力影响非常显著,具体见图2。响应面图是每个试验因素响应值的三维空间曲线图,表面的幅度越大,则表明对试验结果的影响越大[11]。等高线图的形状则可以反映出各因素效应强弱的大小,椭圆形则这两个因素之间的相互作用显著,而圆形则相反[11]。

图2 料液比和乙醇体积分数对总抗氧化能力的影响
2.2.3 验证试验
利用Design Expert 8.0.6软件分析并根据Box-Behnken试验所得到的结果和二次多项式回归方程,得到罗汉果花活性物质的最佳提取条件:乙醇体积分数81.42%、料液比1︰20.18(g/mL)、提取温度43.85℃。在此条件下罗汉果花提取液的总抗氧化能力为1 634.16 U/g。为检验响应面优化结果的可靠性,进行了验证试验。考虑到实际情况,将工艺条件修整为乙醇体积分数81%、料液比1︰20(g/mL)、温度44℃,在此条件下进行5次平行验证试验,得到罗汉果花提取液总抗氧化能力为1 649.34 U/g,具有0.93%的相对偏差的理论预测。实践证明采用响应面法所得到的工艺参数是更可靠的,并具有一定的应用价值。
2.3 提取液对鲜切苹果的保鲜试验
2.3.1 不同浓度罗汉果花提取液对鲜切苹果可溶性固形物含量的影响
按1.2.5的方法进行试验,可溶性固形物含量的变化见图3。鲜切苹果可溶性固形物含量在贮藏期间均呈下降趋势,到第4天时下降较多,尤其是空白对照组。用不同浓度罗汉果花提取液处理的鲜切苹果和对照组相比在试验期间内可溶性固形物的损失均低于空白对照组,且提取液浓度的增大越大,可溶性固形物的损失越小。
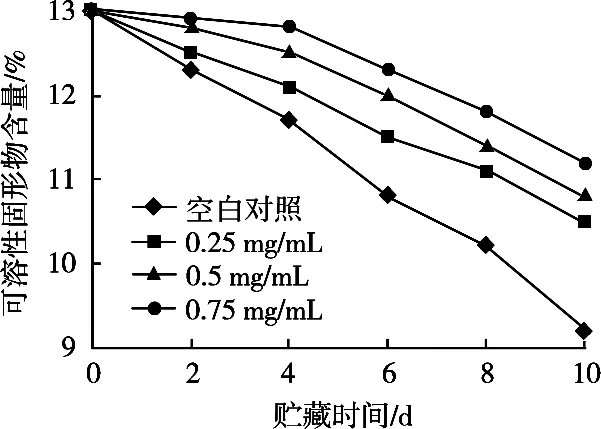
图3 贮藏期间鲜切苹果可溶性固形物含量的变化
2.3.2 不同浓度罗汉果花提取液对鲜切苹果质量损失率的影响
按1.2.5的方法进行试验,鲜切苹果质量损失率的变化见图4。鲜切苹果贮藏期间质量损失率逐渐增加,对照组比3个处理组质量损失率上升明显。4 d前,3个处理组之间质量损失率差异不明显;4 d后,3个处理组的质量损失率均低于空白对照组,且差异显著。在贮藏期内质量损失率与处理液的浓度呈负相关性。
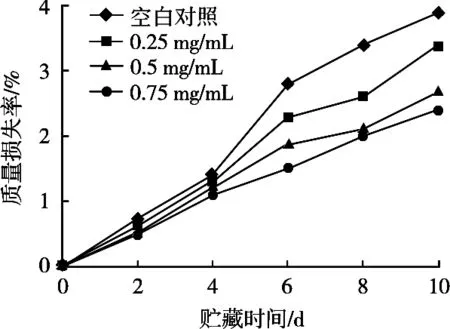
图4 贮藏期间鲜切苹果质量损失率的变化
2.3.3 不同浓度罗汉果花提取液对鲜切苹果呼吸强度的影响
按1.2.5的方法进行试验,鲜切苹果呼吸强度的变化见图5。鲜切苹果在贮藏过程中呼吸强度均呈先增大后降低的变化趋势。与空白对照组相比,罗汉果花提取液处理可推迟鲜切苹果呼吸高峰的到来,其中0.25 mg/mL提取液处理组呼吸高峰推迟了2 d,0.5 mg/mL和0.75 mg/mL提取液处理组则可在贮藏的第8天才达到呼吸高峰,这有利于鲜切苹果品质的保持,且各处理组的峰值均比对照组低,对照组于贮藏的第2天达到呼吸高峰,峰值为132.0 mg CO2/(kg·h),而0.75 mg/mL罗汉果花提取液处理组此时仅为50 mg CO2/(kg·h),显著抑制了鲜切苹果的呼吸强度。

图5 贮藏期间鲜切苹果呼吸强度的变化
2.3.4 不同浓度罗汉果花提取液对鲜切苹果感官品质的影响
随机抽选10人对不同质量浓度罗汉果花提取液处理的鲜切苹果进行感官评定,并取平均值,评定结果如表5所示。不同浓度处理的鲜切苹果其感官评价分值均随着贮藏时间的延长呈逐渐下降的变化趋势,处理组均可在不同程度上延缓鲜切苹果感官评分的下降速度。空白组苹果在贮藏的第6天出现明显褐斑,到第8天发生腐败;0.25 mg/mL处理组在第8天出现少量褐斑;而0.5 mg/mL组和0.75 mg/mL组均在第10天才产生少量褐斑且未发生腐烂,且0.75 mg/mL组与0.5 mg/mL组相比保鲜效果更好。所以0.75 mg/mL的提取液对苹果的保鲜效果最好。
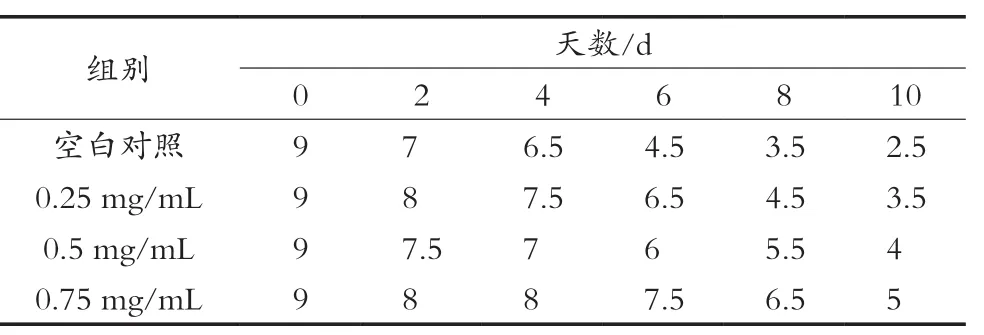
表5 鲜切苹果感官品质评定结果
3 结论
罗汉果花活性物质的最佳提取工艺条件为:提取温度44 ℃、乙醇体积分数81%、料液比1︰20(g/mL)、提取时间120 min。在此提取工艺条件下罗汉果花提取液的总抗氧化能力为1 649.34 U/g,与理论预测值的相对偏差为0.93%;不同浓度提取液均可抑制鲜切苹果的呼吸强度,降低失重率,减少可溶性固形物的损失。其中以0.75 mg/mL提取液保鲜效果较好,与对照组相比,鲜切苹果保鲜期延长了6 d左右。故响应面法获得的罗汉果花活性物质提取工艺模型可靠,在实践中具有可行性,提取液对鲜切苹果具有一定的保鲜效果。
