酵母菌和乳酸芽孢杆菌发酵佛手果酒工艺
2020-01-13吴姗姗田文妮陆思名蔡欣黎攀杜冰
吴姗姗,田文妮,陆思名,蔡欣,黎攀,杜冰*
华南农业大学(广州 510642)
佛手(Citrus medica L.,Var. Sarcodactylis)为芸香料柑桔属植物,又名佛手柑、佛手香橼、蜜罗柑等。我国佛手资源丰富,药用历史悠久,主要用于通气化痰、止痛等,此外佛手还具有抗氧化、抗衰老、抗菌、抗肿瘤、提高免疫力等功效[1]。近年来,对佛手果的开发利用研究主要有佛手精油、佛手含片、佛手果脯、佛手酸奶及佛手果酒等[2],发酵果酒因其口感独特、营养丰富,越来越受到消费者青睐,但目前佛手果酒多是以酵母菌单独发酵,而结合乳酸菌一起复合发酵制备佛手果酒鲜有报道。
乳酸菌和酿酒酵母菌混合发酵在乳制品、饮料和果酒等制品中有广泛的应用,相对于仅用单一菌的发酵制品,在营养价值和保健功能等方面都更有积极的作用,不仅具有原有材料的营养与功效成分,又赋予了发酵制品独特的口感与风味。乳酸芽孢杆菌DU-106兼具乳酸菌产酸和芽孢抗逆性强的特点,能够抵抗许多不良外界因素的影响,比一般的益生菌更具使用优势,适应多种环境[3],在发达国家,有很多以乳酸芽孢杆菌为主要成分的产品已经在市场上流通销售[4]。
试验以广西佛手为主要原料,经产乳酸芽孢杆菌和酵母混合发酵,确定佛手果发酵酒的最佳工艺条件,为佛手果的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
佛手,产自广西;酿酒酵母菌171,购于安琪酵母公司,并为实验室保存;乳酸芽孢杆菌DU-106,菌粉浓度为1×1012CFU/g,为华南农业大学食品学院106保藏;市售白砂糖;β-环状糊精、氯化钠、氢氧化钠均为分析纯。
1.2 主要设备与仪器
VD-650超净工作台,苏州净化设备有限公司;DHP-600电热恒温培养箱,北京市永光明医疗仪器厂;DHG-9070 A电热恒温鼓风干燥箱,上海精宏实验设备有限公司;PHS-3C精密pH计,上海精密科学仪器有限公司;精密电子天平,北京赛多利斯天平有限公司;高压灭菌锅,苏州净化设备有限公司;25 mL附温比重瓶,上海市信谊仪器厂有限公司;手持式折光仪,温州标诺仪器有限公司。
1.3 试验方法
1.3.1 工艺流程

1.3.2 工艺要点
1.3.2.1 佛手果脱苦处理
取新鲜佛手(去皮)100 g置于烧杯中,切成2 cm×2 cm×2 cm左右的小块,加入100 mL蒸馏水及0.78 gβ-环状糊精,44 ℃水浴锅水浴42 min[5]。
1.3.2.2 菌种活化
菌种选用产乳酸芽孢杆菌DU-106和酿酒酵母菌171。分别配制50 mL生理盐水和50 mL 5%糖水,用高压灭菌锅于121 ℃下灭菌15 min,分别加入0.1 g产乳酸芽孢杆菌菌粉和2.5 g酿酒酵母菌,30 ℃下活化30 min钟。
1.3.2.3 发酵
将脱苦后的100 g佛手果块置于2.5 L发酵罐中,倒入100 mL蒸馏水,加入适量白砂糖,接种,混合摇匀,在试验设定温度下发酵。
1.3.3 单因素试验
以接种量(0.10%,0.20%,0.30%,0.40%和0.05%)、发酵温度(20,23,26,29和32 ℃)、初始糖度(10%,15%,20%,25%和30%)和发酵时间(3,5,7,9和11 d)为单因素控制变量,测定发酵后佛手果发酵酒的pH、可溶性固形物含量、总酸及酒精度。
1.3.4 正交试验设计
在单因素试验结果的基础上,选择接种量、初始糖度及发酵温度这3个因素进行正交设计试验,每个因素选取3个水平,采用L9(34)正交表(表1),并根据感官评定表中的各项标准进行评分。

表1 正交试验设计表
1.3.5 分析检测
在设定的条件下进行试验,以发酵开始记为0 d,在发酵的第3,5,7,9和11天取样测定佛手果酒的感官指标、pH、总酸、可溶性固形物含量和酒精度,对其发酵过程的动态变化进行分析。
1.3.5.1 感官指标评定
根据佛手果酒的特性,选择澄清度、香气、滋味与色泽能反映果酒品质的指标为评价标准,每个指标为25分,总分为100分。感官评定标准见表2。
1.3.5.2 理化指标测定
pH,酸度计测定法;可溶性固形物,使用糖度计;总酸、酒精度,GB/T 15038—2006《葡萄酒、果酒通用分析方法》[6]。
2 结果与分析
2.1 单因素优化试验
2.1.1 接种量对佛手果发酵影响
接种量过少,酵母转化不完全,酒中残糖含量高;当接种量过高,酵母繁殖需消耗营养物质,影响糖分转化为酒精,也不利于发酵[7]。由图1可知,随着接种量的提高,佛手果酒总酸和酒精度逐渐上升,pH和可溶性固形物呈现下降趋势,其中接种量对佛手果发酵酒的可溶性固形物含量以及酒精度有较大影响。可以看出,当接种量为0.20%时可溶性固形物含量明显下降,说明此时菌种对佛手果发酵酒中的糖的利用率开始升高。另外,当接种量为0.30%时,酒精度为4.23%vol,当接种量为0.50%时,佛手果发酵酒的酒精度为5.14%vol,说明接种量在0.30%~0.50%范围内酒精度变化不大,因此选择接种量为0.30%。

表2 佛手果发酵酒各项感官评分标准

图1 接种量对佛手果发酵酒的影响
2.1.2 发酵温度对佛手果发酵影响
发酵温度是影响佛手果发酵酒发酵品质的一个重要因素,温度低时菌种代谢活力相对较弱,酵母转化酒精以及产乳酸芽孢杆菌产酸能力较弱,酒精度较低,酸度不足,口感不佳;温度过高会使酵母衰老加速[8]。由图2可知,随着发酵温度的升高,可溶性固形物持续下降,酒精度和总酸含量升高。由图2可以看出,在20~32 ℃,发酵温度越高,果酒发酵程度越大。由图2可以得出,当发酵温度为32 ℃时,佛手果发酵酒中白砂糖的利用率最高,说明在此温度下微生物活性相对较大,佛手果发酵酒发酵相对完全。因此确认32 ℃为佛手果发酵酒的最佳发酵温度。
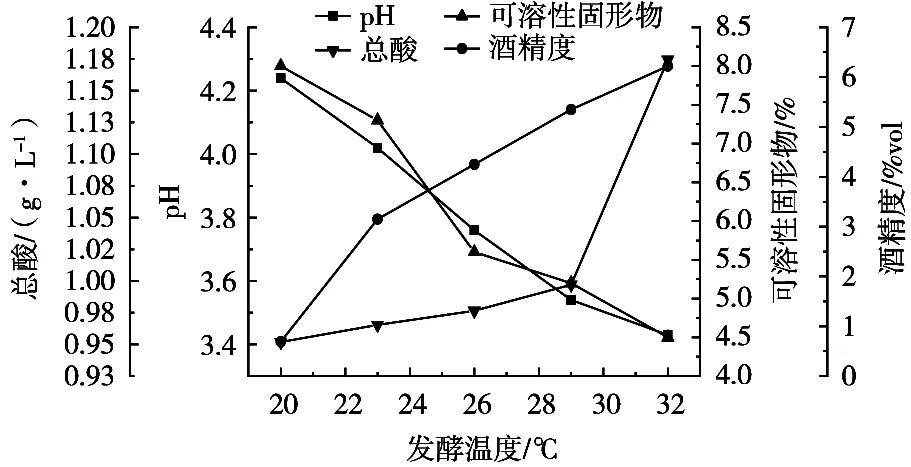
图2 发酵温度对佛手果发酵酒的影响
2.1.3 初始糖度对佛手果发酵影响
初始糖度对于佛手果酒的发酵是一个重要的影响因素,主要影响发酵后的风味以及微生物活动。高浓度糖会抑制菌种的生长繁殖,同样使发酵不彻底[9]。由图3可以看出,随着初始糖度的增加,总酸、可溶性固形物、酒精度均增加,当初始糖度达到20%时,酒精度和可溶性固形物上升速率减缓,此时酒精度达到4.32%vol,考虑到佛手果发酵酒作为果酒,酒精度不宜过高,否则佛手原有的清新的风味将会被酒精味所遮盖,因此选择初始糖度为20%作为最佳添加量。

图3 初始糖度对佛手发酵酒的影响
2.1.4 发酵时间对佛手果发酵影响
由图4可知,发酵3 d时,佛手果发酵酒的pH与固形物含量较高,总酸含量较低,说明此时佛手果发酵酒中的菌种还没有完全发挥活性,对白砂糖的利用率较低,发酵过程中所产的酸和酒精较低。在发酵5 d后,产乳酸芽孢杆菌和酵母在佛手果发酵酒中开始发挥活性,白砂糖的利用率逐渐增高,酒精度上升至1.32%vol。当发酵到第9天时,发酵速率有所下降,白砂糖的利用率与总酸产量的变化速率也有所下降。在发酵11 d后,发酵基本趋于稳定,各项指标变化幅度均有所降低。在发酵第7天时,佛手果发酵酒中pH为3.67,总酸为0.550 8 g/L,可溶性固形物含量为4.3%,酒精度4.23%vol,果酒澄清呈淡黄色,口感醇厚,感官评分较高,因此选择最佳发酵时间为7 d。
发酵时间相对于其他因素对佛手果酒的影响较小,且发酵时间为7 d时感官评分最高,因此,确定发酵时间为7 d,不再选取发酵时间作为正交试验的因素。
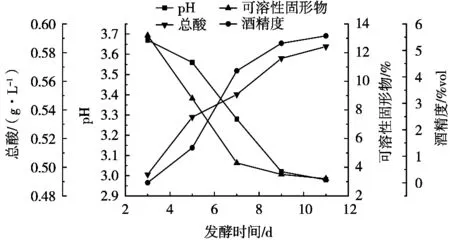
图4 发酵时间对佛手发酵酒的影响
综上,由单因素试验结果可知,接种量为0.3%,发酵温度为32 ℃,初始糖度为20%,发酵时间为7 d,在此发酵条件下可得出较为优质的佛手果发酵酒。
2.2 佛手果发酵酒正交试验
在单因素试验结果的基础上,选择接种量、发酵温度及初始糖度这3个因素进行正交设计试验,每个因素选取3个水平,采用(34)正交表。试验设计方案及结果见表3,方差分析结果见表4。
由表3和表4可知,3个因素极差分析为RA>RB>RC,即佛手发酵果酒的影响因素为菌种接种量>初始糖度>发酵温度。从直观分析表可以看出,菌种的最佳接种量是0.30%,初始糖度的最佳为20%,发酵温度最佳为25 ℃,此条件下发酵制备的佛手果酒感官评分最高,达到85.4分。

表3 果酒发酵正交试验结果与分析

表4 果酒发酵正交试验方差分析表
2.3 验证试验
为更好地验证上述试验的准确性,根据上述的试验步骤对该最佳工艺条件再进行一次验证试验,并测定佛手果发酵酒的四项理化性质及感官评分。根据上述验证试验结果,在接种量为0.30%,初始糖度为20%,发酵温度为25 ℃的最优发酵条件下制备的佛手果发酵酒的感官评分,为85.4分,系九组试验中最高。因此通过验证,可以得出佛手果发酵酒的最佳工艺为接种量为0.30%,初始糖度20%,发酵温度25 ℃。
3 结论
通过单因素和正交试验,优化并确立了佛手果发酵酒的最佳发酵工艺:接种量0.30%,发酵温度为25℃,初始糖度为20%,发酵时间为7 d。在此条件下佛手果发酵酒的pH为3.67,总酸为0.55 g/L,可溶性固形物含量为4.30%,酒精度4.23%vol,感官评定为85.4分。
