苯磺酸左氨氯地平片溶出度一致性评价
2020-01-13常丽梅朱明张辉陈瀛
常丽梅,朱明,张辉,陈瀛
(1.海南省药品审核认证管理中心,海南 海口 570216; 2.先声药业(海南)有限公司,海南 海口 570216)
苯磺酸氨氯地平是临床常用的二氢吡啶类钙通道阻滞剂,有左旋和右旋2种对映异构体。苯磺酸左氨氯地平是经拆分得到的新一代钙通道阻滞药,临床上广泛用于高血压、心绞痛的治疗,由于去除了苯磺酸氨氯地平的右旋体,从而大大降低了不良反应,并因作用稳定、持久,已广泛应用于临床,成为最常用的降压药物之一[1-2]。苯磺酸左氨氯地平为苯磺酸氨氯地平的左旋异构体,除比旋度不同之外,其他理化性质和制剂相关特性与苯磺酸氨氯地平基本保持一致。右旋氨氯地平在临床使用中基本无疗效,因此,等量的左旋氨氯地平的疗效是氨氯地平本身的2倍[3]。
苯磺酸氨氯地平片原研厂家为美国辉瑞制药公司,商品名为Norvasc,中文名为络活喜,而左旋氨氯地平制剂目前在国外尚无批准上市信息。苯磺酸左氨氯地平是国内首例通过手性拆分的光学纯药物,经查询国家药品监督管理局数据,苯磺酸左氨氯地平片国内获批15个文号,施慧达药业集团(吉林)有限公司研制的苯磺酸左氨氯地平片(2.5 mg)于1999年首家上市。目前国内外药典均未收录该品种的质量标准,其消旋体苯磺酸氨氯地平及制剂则已收载于2015年版《中国药典》。
由于药物的溶出对吸收有重要影响,因此药物体外溶出度试验可能会与体内行为具有一定关联性。在多种pH溶出介质中溶出曲线的测定是现行国家药物审评机构评价口服固体制剂内在质量的一种重要手段。本文选择已上市2个厂家的苯磺酸左氨氯地平片(规格:2.5 mg),参考苯磺酸左氨氯地平国家药品标准新药转正标准[4],采用2015年版《中国药典》四部通则0931第二法进行溶出度测定,同时参照该方法进行溶出曲线考察,并与原研药品(络活喜,规格:5 mg)的溶出曲线比较,进行体外溶出度研究。
1 仪器与试药
1.1 仪器
Agilent 1260 高效液相色谱仪(美国 Agilent公司);BS2010S型电子天平(赛多利斯);BT25S型电子天平(赛多利斯);ZRS-12G型智能溶出度仪(天津天大天发科技有限公司)。
1.2 试剂与试药
Na2HPO4、KH2PO4、HCl、NaOH、醋酸钠、冰醋酸(分析纯)、纯化水(自制);苯磺酸左氨氯地平对照品(中国食品药品检定研究院,批号:100546-201504;质量分数:93.4%);苯磺酸左氨氯地平片样品信息见表1。

表1 苯磺酸左氨氯地平片样品信息Table 1 The information of Levamlodipine besylate tablets
2 方法与结果
2.1 溶出介质
参照《普通口服固体制剂溶出度试验技术指导原则》[5]对溶出介质的要求,选择pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和水为溶出介质,考察不同厂家药品的溶出曲线。
2.2 对照品溶液的制备
精密称取苯磺酸左氨氯地平对照品适量,加甲醇适量使溶解后,用溶出介质稀释制成每1 mL中约含苯磺酸左氨氯地平5 μg的溶液,即得。
2.3 供试品溶液的制备
取上述试验用样品,每批样品12片,加入溶出介质进行试验,分别在10、15、30、45、60、90、120、180 min取溶出液,用0.45 μm微孔滤膜过滤,取续滤液检测。
2.4 色谱条件
色谱柱:Waters Novapak C18柱(3.9 mm×4.9 mm);流动相:甲醇-乙腈-0.7%三乙胺溶液(磷酸调节pH值至3.0,体积比35∶15∶50);检测波长:237 nm;流速:1.0 mL/min。
2.5 溶出度测定
取样品,照2015年版《中国药典》四部通则0931第二法的溶出度与释放度测定法,采用桨法,分别以4种溶剂(pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液、水)500 mL为溶出介质,转速为75 r/min,在(37±0.5)℃下,分别于10、15、30、45、60、90、120、180 min取溶出液适量,取续滤液,照2015年版《中国药典》四部通则0512“高效液相色谱法”测定含量,计算每片的溶出量,样品在4种溶出介质中的体外溶出度测定结果见图1。

1201008060402002040600溶出度/%1201008060402002040600溶出度/%100806040200溶出度/%100806040200溶出度/%501001502000501001502000t/minCBA1A2A3pH6.8磷酸盐缓冲液pH1.2盐酸溶液pH4.5醋酸盐缓冲液水
图1不同厂家苯磺酸左氨氯地平在4种溶出介质的溶出曲线
Figure1The dissolution curves of Levamlodipine besylate tablets in four different dissolution media
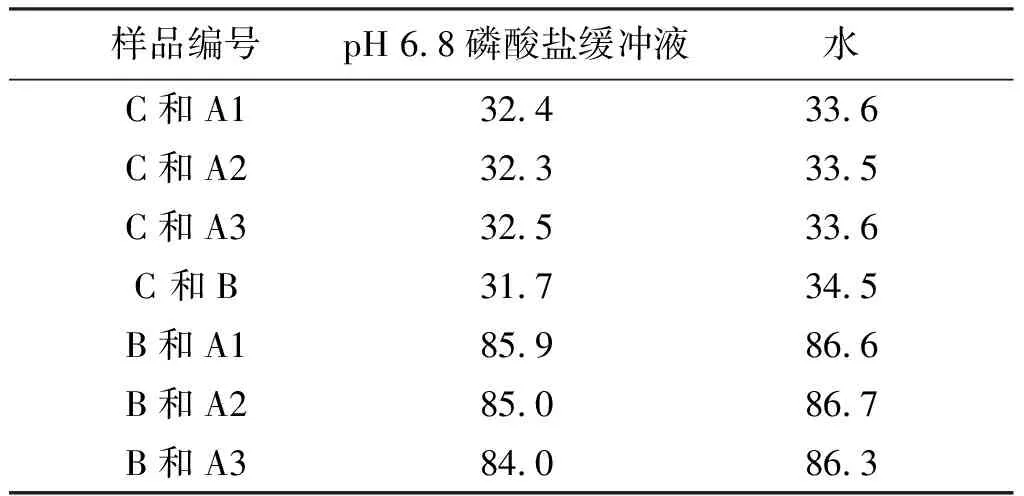
依据《国家药品标准新药转正标准》,苯磺酸左氨氯地平片的溶出度限度(Q)为80%,参考《普通口服固体制剂溶出度试验技术指导原则》:相似因子 f2值高于50,可认为2条曲线具有相似性,即溶出行为一致。本文采用f2评价国内上市苯磺酸左氨氯地平片与原研药品络活喜在pH6.8磷酸盐缓冲液和水中体外溶出的一致性,结果见表2。
以上结果可见,国内上市品与原研药品在pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液中,15 min的溶出量均达到85%以上,表明国内2家企业药品在以上2种溶出介质中的溶出行为与原研药品络活喜相似;而在pH6.8磷酸盐缓冲液和水2种溶出介质中的溶出行为却与原研药品络活喜不一致。
表2 不同厂家苯磺酸左氨氯地平在pH 6.8磷酸盐缓冲液及水中的f2值
Table2The f2similarity factor of Levamlodipine besylate tablets in pH 6.8 phosphate buffer solution and water
样品编号pH 6.8磷酸盐缓冲液水C和A132.433.6C和A232.333.5C和A332.533.6C 和B31.734.5B和A185.986.6B和A285.086.7B和A384.086.3
2.6 饱和溶解度的测定
从表3苯磺酸氨氯地平与苯磺酸左氨氯地平在不同溶出介质(37 ℃)中的饱和溶解度对比结果可知,苯磺酸左氨氯地平在各介质中溶解度较苯磺酸氨氯地平高,且两者在pH 6.8磷酸盐缓冲液中的溶解度较pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液和水中偏低。
表3 苯磺酸氨氯地平与苯磺酸左氨氯地平在不同溶出介质中的饱和溶解度
Table3Saturated solubility of amlodipine besylate and L-amlodipine besylate in different dissolution mediaρ/(mg·mL-1)

溶出介质苯磺酸氨氯地平苯磺酸左氨氯地平pH 1.2盐酸溶液3.34.4pH 4.5醋酸盐缓冲液3.39.7pH 6.8磷酸盐缓冲液1.02.1水3.53.9
3 讨论
溶出曲线可以直观反映药物的体外释放速度和程度,体外溶出度对比研究有利于指导仿制药一致性评价过程中建立更科学的溶出试验条件,对药品生产处方工艺的差异及内在质量评价研究具有一定的参考意义。
国内上市的苯磺酸左氨氯地平片和原研药品络活喜在处方辅料组成及制备工艺上都有所区别,原研药品络活喜辅料为微晶纤维素、无水磷酸氢钙、羟甲基淀粉钠、硬脂酸镁,采用粉末直接压片制得[6];而国内上市苯磺酸左氨氯地平片的辅料组成主要为微晶纤维素、乳糖、淀粉、硬脂酸镁等,其工艺为将稀释剂和崩解剂加入黏合剂后,采用湿法混合制粒、干燥、整粒、外加辅料、混合、压片。
本文选择采用pH 1.2盐酸溶液、pH 4.5醋酸盐溶液、pH 6.8磷酸盐缓冲液、水作为溶出介质,对国内不同厂家苯磺酸左氨氯地平片与原研药品溶出度进行对比研究,结果显示:苯磺酸左氨氯地平片在pH 1.2盐酸溶液、pH 4.5醋酸盐溶液中的溶出速度高于在水和pH 6.8磷酸盐缓冲液中的溶出速度,这与苯磺酸左氨氯地平在4种溶出介质中的饱和溶解度有一定相关性,如表3所示,苯磺酸左氨氯地平在以上介质中的溶解度大小为pH 4.5醋酸盐溶液>pH 1.2盐酸溶液>水>pH 6.8磷酸盐缓冲液,原因是苯磺酸左氨氯地平的pKa为8.85,相对偏碱性,其在偏酸性溶液中溶解度较大,溶出速率较快。
药物的溶出速率可以用Noyes-Whitney方程解释,药物的溶出面积、溶解速度常数以及药物本身的溶解度都对溶出度有影响,这些因素跟原料药的晶形、颗粒大小等都相关。溶解度在一定程度上可以反映溶出度的情况,但对于溶解度都较大的溶出介质,药物制剂的溶出速率都较快,这些介质并不能区分出药物因制剂的辅料或处方工艺的不同所带来的差异。如苯磺酸氨氯地平和苯磺酸左氨氯地平在酸性介质中溶解度较大,溶出速率较快,所以国内上市苯磺酸左氨氯地平片在2种酸性介质中显示与原研药品络活喜体外溶出行为一致,而pH 6.8磷酸盐缓冲液这种溶出速率较慢的介质则可以很好的区分2种制剂处方工艺的差异。
苯磺酸左氨氯地平片由于不同企业处方工艺不同,其产品的溶出行为会有一定差距。采用多条溶出曲线来指导制剂处方工艺开发是很有必要的,特别是选择具有区分性的溶出介质,乃至区分性的溶出条件,只有在区分性介质中的溶出曲线相似,才能说明体外溶出的一致性。在实际处方开发中,要结合原料药及制剂的具体情况,采用适宜的溶出方法评价,掌握适度评价原则,才能有效发挥体外溶出评价在药物生物等效性试验中的指导作用。
