百合酵素自然发酵过程中有机酸及其体外抗氧化活性的变化
2020-01-13方晟陈犇沙如意毛建卫
方晟,陈犇,沙如意,毛建卫,3*
1(绍兴文理学院 元培学院,浙江 绍兴,312000) 2(浙江省农产品化学与生物加工技术重点实验室,浙江科技学院 生物与化学工程学院,浙江 杭州,310023) 3(浙江工业职业技术学院,浙江 绍兴,312000)
食用植物酵素(edible plant Jiaosu)是以新鲜蔬菜、水果、药食两用本草类为原料,经多种有益菌通过较长时间发酵而生产的功能性发酵产品,可有效清除体内过剩的活性氧自由基,在预防和治疗因自由基诱发的疾病和抗衰老方面具有广阔的应用前景[1-2]。食用植物酵素既保持了植物自身营养成分、也含有乳酸菌等有益微生物及其代谢产生的功能性小分子物质等,其中有机酸是一项重要指标,对酵素产品的特有风味及抗氧化等功能性作用有重要影响[3-4]。目前酵素品类繁多,但品质差别大,且相关科学研究支撑不足,亟需深入开展酵素发酵过程功能组分和功效研究,进而用标准化手段规范传统工艺,保证酵素品质。
百合为百合科(Liliaceae)百合属(Lilium)植物,是国家卫计委公布的首批“药食同源”植物之一,其食用、药用部位均为卷丹(LiliumlancifoliumThunb.)、百合(L.browniiF.E.Brown var.viridulumBaker)和细叶百合(L.pumilumDC.)的肉质鳞叶,药理实验表明,其具有抗肿瘤、降血糖、抗氧化、消炎等作用[5-6]。目前百合在功能性食品和药品领域的深入开发较少,主要用于鲜食或加工成百合干、百合淀粉、百合饮料等,附加值相对较低[7]。从食用安全性和保健功效考虑,百合是开发食用酵素的优良植物资源,但目前未见关于百合酵素的研究报道。本研究以百合为主要原料制备食用植物酵素,探讨对其自然发酵过程中体外抗氧化活性、有机酸组成及含量的变化规律,以期为百合酵素产品的开发及精准制备提供科学依据。
1 材料与方法
1.1 材料与试剂
新鲜百合,兰州米家山百合有限责任公司;发酵糖液,浙江省农产品化学与生物加工技术重点实验室。
α,α-二苯基-β-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、吩嗪硫酸甲酯(phenazine methosulfate,PMS)、硝基四氮咪唑蓝(nitrotetrazolium blue chloride,NBT)、2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二氨盐(2,2′-azino-bis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、有机酸标准品,美国Sigma公司;三羟甲基氨基甲烷(Tris)、K2HPO4、H3PO4、甲醇、铁氰化钾、三氯乙酸、FeCl3、水杨酸钠、FeSO4、HCl,均为分析纯,上海展云化工有限公司。
1.2 仪器与设备
LC-20A高效液相色谱仪,日本岛津公司;TU-1810紫外可见分光光度计,上海仪电分析仪器有限公司; PHS-3C酸度计,上海佑科仪器仪表有限公司;Allegra X-12R型冷冻离心机,美国贝克曼库尔特有限公司;SW-CJ-1B超净工作台,苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 百合酵素的制备
用去离子水清洗百合表面去除杂质,自然晾干。百合和发酵糖液按质量比3∶5混匀后,加入到已灭菌的玻璃瓶中密封,室温下避光发酵。发酵过程中,分别在第5、10、15、20、25、30、40、50、60、70、80、90天取样,样品于10 000 r/min离心10 min后,保留上清液待测。
1.3.2 超氧自由基清除能力的测定
采用PMS/NADH体系还原NBT法[8],50 μL样品加入到950 μL磷酸缓冲液(0.1 mol/L,pH 7.4),然后加入1 mL 120 μmol/L的PMS(用0.1 mol/L的PBS配制,pH 7.4),1 mL 936 μmol/L的NADH(用0.1 mol/L的PBS配制,pH 7.4)和1 mL 300 μmol/L的NBT(用0.1 mol/L的PBS,pH 7.4配制)。在环境温度下反应5 min。以去离子水为参比溶液。在560 nm处测定吸光度,如公式(1)所示:
(1)
式中:A0为空白对照液吸光度;A1为样品测定管吸光度;A2为样品本底管吸光度。
1.3.3 羟自由基清除能力的测定
采用Fenton法[9],335 μL样品加入到1.4 mL 6 mmol/L的H2O2,加入0.6 mL 20 mmol/L的水杨酸钠和2 mL 1.5 mmol/L的FeSO4,37 ℃下恒温水浴1 h。以去离子水为参比溶液,在562 nm下测定吸光度,如公式(2)所示:
(2)
式中:A0为空白对照液吸光度;A1为样品测定管吸光度;A2为样品本底管吸光度。
1.3.4 DPPH自由基清除能力的测定
采用DPPH甲醇溶液显色法[10],40 μL样品加入到4 mL 0.1 mmol/L的DPPH-甲醇溶液中,再加入450 μL,50 mmol/L的Tris-HCl 缓冲液(pH 7.4),25℃下恒温水浴30 min。以去离子水为参比溶液。在517 nm处测定吸光度,如公式(3)所示:
(3)
式中:A0为空白对照液吸光度;A1为样品测定管吸光度;A2为样品本底管吸光度。
1.3.5 ABTS自由基清除能力的测定
采用ABTS过硫酸钾显色法[11],用7 mmol/L的ABTS(用5 mmol/L的PBS配制,pH 7.4),加入过硫酸钾,最终浓度为2.45 mmol/L,在室温下黑暗放置12~16 h。使用前把ABTS自由基用PBS稀释成在734 nm下吸光度为(0.7±0.02)。取10 μL样品加入到5 mL上述稀释液中,在30 ℃下反应5 min。以去离子水为参比溶液。在734 nm处测定吸光度,如公式(4)所示:
(4)
式中:A0为空白对照液吸光度;A1为样品测定管吸光度;A2为样品本底管吸光度。
1.3.6 还原力的测定
采用铁氰化钾法[12],30 μL样品加入到2.5 mL H3PO4缓冲液(0.2 mol/L,pH 6.6),然后加入2.5 mL 10 g/L铁氰化钾,50 ℃反应30 min,再加入100 g/L三氯乙酸2.5 mL,在3 000 r/min下离心10 min,立即取2.5 mL上清液,加入2.5 mL去离子水和0.5 mL 1 g/L FeCl3。以去离子水为参比溶液。在700 nm处测定吸光度。
1.3.7 有机酸含量的测定
有机酸含量的测定采用高效液相色谱法,参考SCHERER等[13]的方法进行。HPLC分离条件:色谱柱为Agilent TC-C18柱(250 mm×4.6 mm i.d.,5 μm),流动相为0.01 mol/L的KH2PO4溶液(用磷酸调pH=2.7),流速1 mL/min,柱温20 ℃,检测波长210 nm。待测样品用0.01 mol/L的KH2PO4溶液(pH 2.7)稀释5倍,0.22 μm微孔滤膜过滤后直接进样。
1.4 数据处理与分析
全部试验均平行进行3次,试验结果表示为均值±标准差(Mean±SD)形式。采用SPSS 21.0软件进行单因素方差分析、聚类分析及相关性分析,采用Origin 8.6软件绘制图表。
2 结果与分析
2.1 百合酵素发酵过程中体外抗氧化活性的变化
2.1.1 发酵过程中超氧自由基清除能力的变化
超氧自由基在活性氧物质如H2O2、单线态氧的形成中起重要作用,主要损害细胞膜,包括血管内皮细胞膜及亚微结构,并引起一系列有害的生化反应[14]。如图1所示,百合酵素的超氧自由基清除能力在发酵初期出现波动后,于发酵30 d时显著提高(P<0.05),并保持缓慢上升的趋势,在发酵70 d达到最高后保持稳定,发酵90 d时为91.83 %,相较发酵初期提升27.02 %,说明延长发酵时间有利于百合酵素对超氧自由基清除能力的提高。蒋增良等[15]研究发现,葡萄酵素自然发酵过程中对超氧自由基的清除能力呈先增加后略微降低再增加的趋势,第56天时达到最大,清除率为65.22 %,相较发酵前增加了12.8 %。

图1 发酵过程中超氧自由基清除能力的变化Fig.1 Changes in superaxide radical scavenging ability during fermentation注:不同字母表示差异显著(P<0.05)。下同。
2.1.2 发酵过程中羟自由基清除能力的变化
羟自由基是生物体内极具反应性的自由基,它几乎能与活细胞中任何生物大分子发生反应,且反应速度极快,在自由基病理学上被认为具有高度的损伤性[16]。图2表明,百合酵素的羟自由基清除能力在发酵5~30 d先升高后降低,于发酵40 d时显著上升达到最高(P<0.05),为55.72 %,相较发酵5 d时提高414.49 %,随后下降至42.50 %并趋于稳定。陈岭等[17]对石斛花发酵液发酵过程中羟自由基清除能力进行测定,发现56 d时清除能力最高,达到43.5%。羟自由基清除能力的提高可能是酵素中有机酸、多糖等物质综合作用的结果,包永春[18]通过分析发现,乳酸、苹果酸和酒石酸均具有清除羟自由基的能力;也有研究表明酵母壁上的多糖具有一定的羟自由基清除能力[16]。
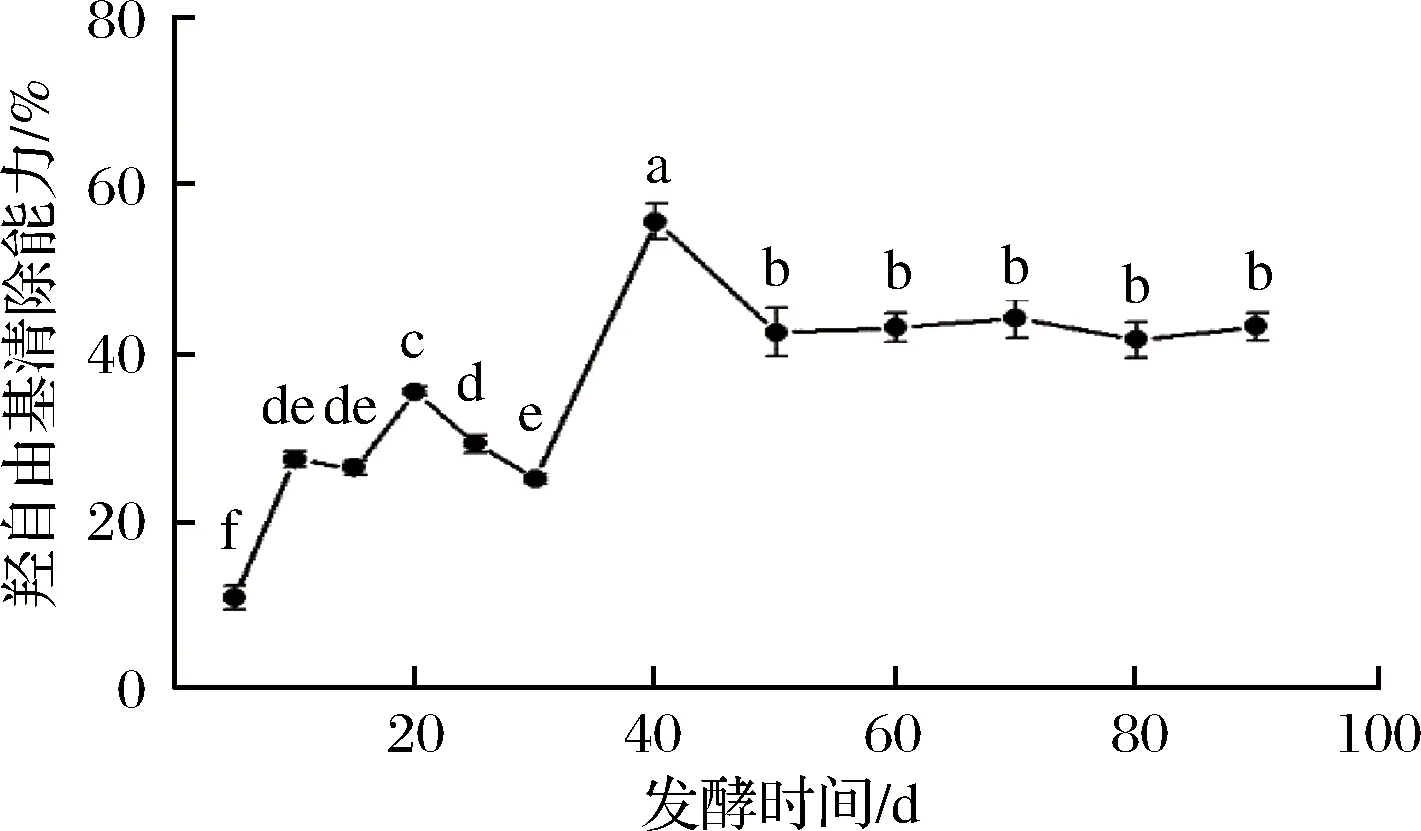
图2 发酵过程中羟自由基清除能力的变化Fig.2 Changes in hydroxyl radical scavenging ability during fermentation
2.1.3 发酵过程中DPPH自由基清除能力的变化
DPPH是一种稳定的有机氮自由基,在乙醇溶液中显深紫色,能吸收抗氧化物的电子而引起样品颜色的改变,其褪色程度与接受电子数成正比[19]。DPPH自由基清除能力是评价抗氧化性的常用方法,实验验证其具有良好的敏感性[20]。如图3所示,百合酵素的DPPH自由基清除能力在15~25 d由31.19 %迅速上升至66.21 %(P<0.05),增幅达到112.31 %,之后变化幅度减小,并呈先上升后下降的趋势(P<0.05),于发酵60 d时达到最高的78.93 %,90 d时下降至66.20 %。周偏等[21]研究表明诺丽酵素在自然发酵过程中DPPH自由基清除能力在54 d时达到峰值,为71.22 %,与本实验研究结果相似。
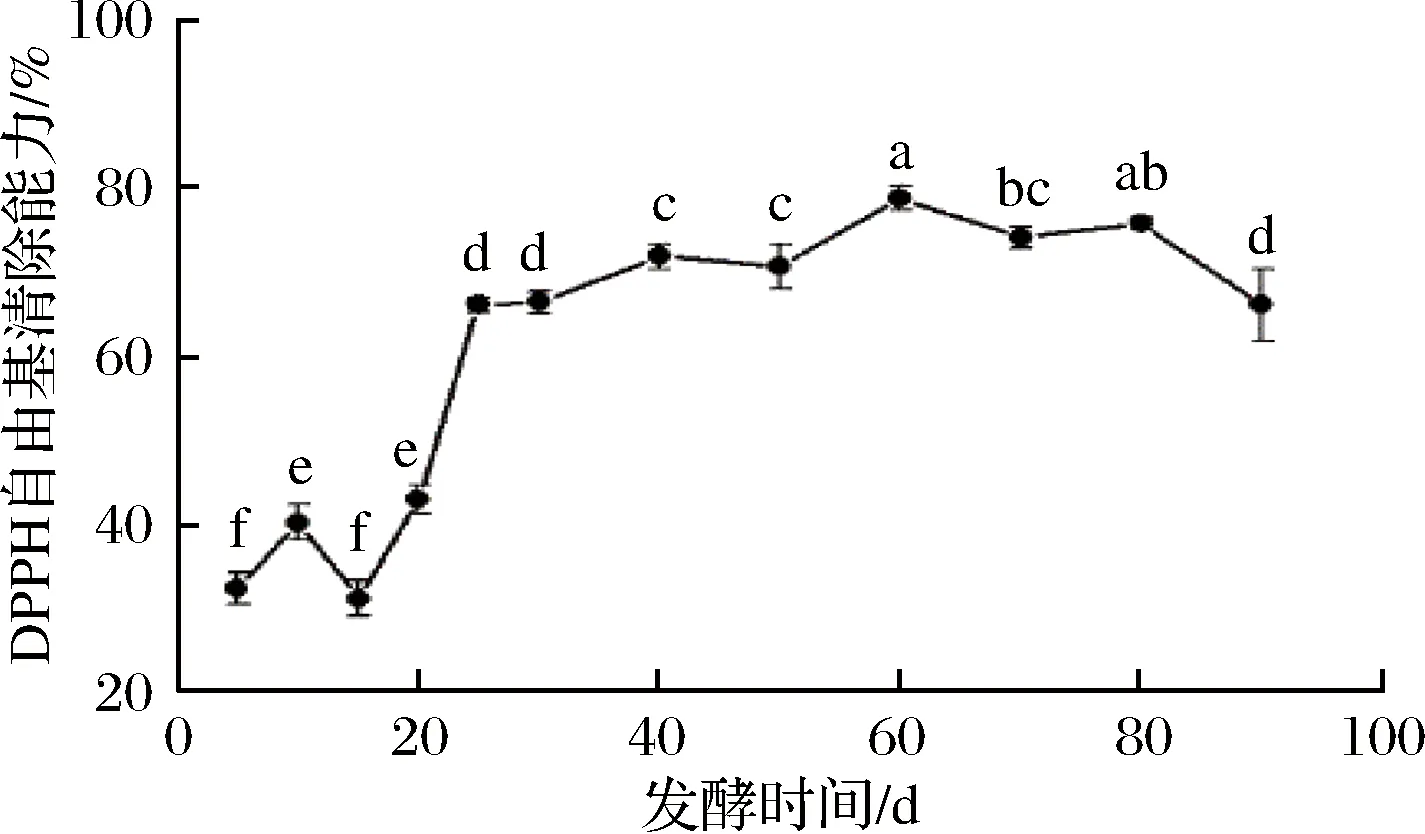
图3 发酵过程中DPPH自由基清除能力的变化Fig.3 Changes in DPPH radical scavenging ability during fermentation
2.1.4 发酵过程中ABTS自由基清除能力的变化
由图4可知,百合酵素的ABTS自由基清除能力在发酵5~50 d呈不规则变化,且变化明显;发酵50 d后呈先升高后降低的变化趋势(P<0.05),于发酵70 d时达到最高,为35.18 %,相较发酵5 d时提高了188.12 %,可见发酵时间对百合酵素的ABTS自由基清除能力有较大影响。陈小伟等[22]发现延长发酵时间有利于提高咖啡果皮酵素对ABTS自由基的清除能力,发酵第48天时达到91.74 %,与本研究结果不同。ABTS自由基是一种过氧化氢酶的底物,罗泽江等[14]研究表明,有机酸、维生素和酚类物质具有清除ABTS自由基的能力,其作用取决于分子质量、芳香环数量和羟基取代基等。

图4 发酵过程中ABTS自由基清除能力的变化Fig.4 Changes in ABTS radical scavenging ability during fermentation
2.1.5 发酵过程中还原力的变化
由图5可知,百合酵素的还原力在发酵15~30 d出现波动后,随发酵进行持续上升(P<0.05),于发酵60 d时达到最高的0.96,相较发酵5 d时增加了122.48 %,之后略有降低(P<0.05),但在发酵90 d时回升至0.94。还原力的大小不仅与自由基的清除有关,还与过氧化物降解等因素有关[23]。可见发酵时间增加有利于提升百合酵素的还原力。蒋增良等[15]试验结果与本研究相似,葡萄酵素的还原力在自然发酵过程中呈上升趋势,在56 d后达到 0.367,与未发酵之前相比,提高了17.2 %。

图5 发酵过程中还原力的变化Fig.5 Changes in reducing power during fermentation
2.2 百合酵素发酵过程中有机酸的变化
图6为有机酸标准品HPLC色谱图,图7、图8分别为发酵5 d和90 d时百合酵素样品有机酸HPLC色谱图,由图6~图8可知,百合酵素共含有8种有机酸,抗坏血酸、马来酸和没食子酸未检出。百合酵素的总有机酸含量随发酵进行持续上升(P<0.05),至发酵60 d时达到(16.642±0.58) g/L,相较发酵5 d时的(5.670±0.02) g/L增长193.50 %,90 d时下降至(15.266±0.30) g/L。草酸、L-苹果酸、莽草酸、乳酸、醋酸、琥珀酸含量在发酵过程中的变化趋势类似,均随发酵时间增加显著升高,至60~80 d达到最高后趋于稳定或略有下降,发酵90 d时其含量较5 d时分别提高194.50 %、44.58 %、31.77 %、133.46 %、207.83 %和2 938.67%;而L-酒石酸和柠檬酸含量呈不规则变化。发酵过程中,乳酸、醋酸的含量远高于其他种类有机酸(P<0.05),发酵90 d时分别为(5.347±0.21) g/L和(4.179±0.07) g/L,占总有机酸含量的62.40 %。发酵各时段不同有机酸含量平均值排序为:乳酸>醋酸>L-苹果酸>琥珀酸>草酸>柠檬酸>莽草酸>L-酒石酸。

1-草酸,2-L-酒石酸,3-L-苹果酸,4-莽草酸,5-抗坏血酸,6-乳酸,7-醋酸,8-柠檬酸,9-琥珀酸,10-马来酸,11-没食子酸图6 有机酸标准品的HPLC色谱图Fig.6 HPLC chromatograms of organic acids standard
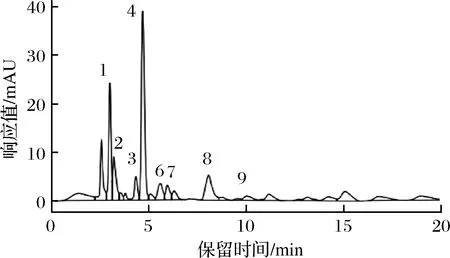
图7 发酵5 d百合酵素样品有机酸的HPLC色谱图Fig.7 Organic acids HPLC chromatogram of lilium Jiaosu after 5 d fermentation

图8 发酵90 d百合酵素样品有机酸的HPLC色谱图Fig.8 Organic acids HPLC chromatogram of lilium Jiaosu after 90 d fermentation

表1 百合酵素发酵过程中有机酸含量变化 单位:g/L
注:同列数据末尾不同小写字母表示差异显著(P<0.05);同行数据末尾不同数字表示差异显著(P<0.05)。
2.3 发酵过程中有机酸变化时间特性的聚类分析
采用类间平均链锁法(between groups linkage)对百合酵素不同发酵时间的有机酸含量进行聚类分析,结果如图9所示,在欧式平方距离15处,12个不同发酵时间的百合酵素样品可以聚为3类。第1类发酵阶段为5~10 d,其特点是百合酵素的有机酸含量处于较低水平,可能是发酵初期微生物还处于适应期,破解细胞壁的酶类物质及代谢产生的有机酸较少[22];第2类发酵阶段为15~60 d,其特点是随发酵时间延长,有机酸含量显著上升,可能是因为随着植物材料的降解,环境中的营养物质更为丰富,产酸微生物大量繁殖而生成乳酸、醋酸等次生代谢产物;第3类由70、80、90 d组成,聚集了有机酸含量较高且变化趋于平缓的阶段,可能原因是糖类物质大量消耗,使产酸菌利用有机酸等营养物质进行生长繁殖[23]。

图9 百合酵素发酵时间聚类树状图Fig.9 Dendrogram obtained from clustering analysis of fermentation time of lilium Jiaosu
2.4 发酵过程中有机酸种类特性的聚类分析
对百合酵素发酵过程不同种类有机酸进行聚类分析,结果如图10所示,在欧式平方距离15处,8种有机酸可以分为2类。第1类由L-苹果酸、醋酸、草酸、琥珀酸、莽草酸和乳酸组成,聚入此类的有机酸含量较高或中等,发酵过程中总体呈明显上升趋势;第2类由L-酒石酸和柠檬酸组成,其特点是属于低含量有机酸,且随发酵进行呈不规则变化。
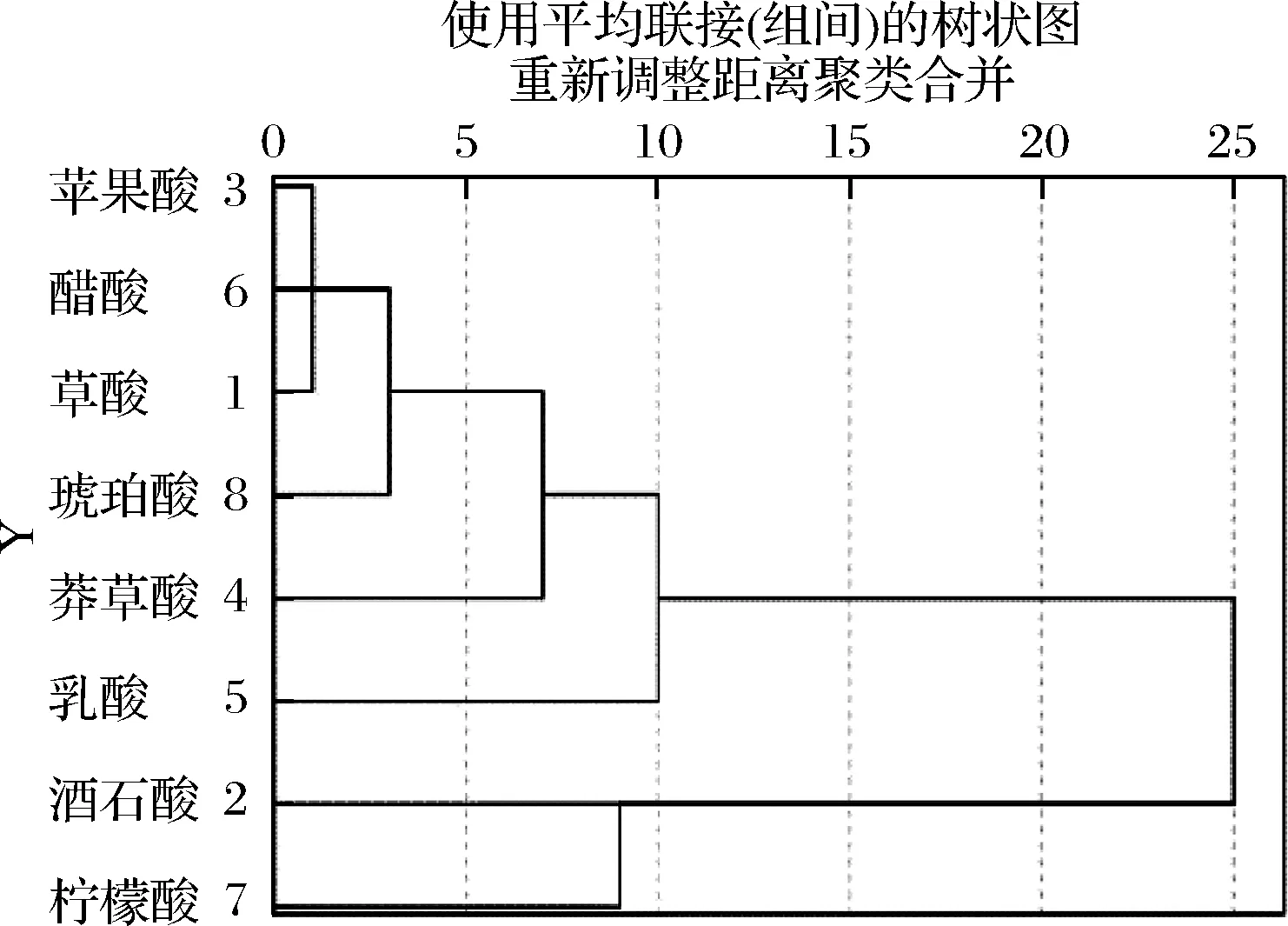
图10 百合酵素有机酸种类聚类树状图Fig.10 Dendrogram obtained from clustering analysis of organic acid species of lilium Jiaosu
2.5 有机酸含量与体外抗氧化活性的相关性
根据表2,百合酵素发酵过程中5种体外抗氧化性指标均与乳酸和L-苹果酸含量呈极显著正相关(P<0.01),其中还原力、DPPH自由基清除能力和超氧自由基清除能力与乳酸和L-苹果酸含量呈极强相关性(相关系数0.819~0.902);除ABTS自由基清除能力外,其余4种体外抗氧化性指标均与草酸、醋酸含量具有极显著的正相关(P<0.01),其中,还原力、DPPH自由基和超氧自由基清除能力与草酸和醋酸含量呈极强相关性(相关系数0.849~0.945)。说明发酵过程中乳酸、醋酸等对百合酵素体外抗氧化性有明显作用。

表2 有机酸与抗氧化活性之间的相关系数Table 2 Correlation coefficients between organic acids and antioxidant activity
注:ABTS-ABTS自由基清除能力;DPPH-DPPH自由基清除能力;HR-羟基自由基清除能力;SR-超氧自由基清除能力;RP-还原力;**表示在0.01水平上呈极显著性相关,*表示0.05水平上呈显著性相关。
3 结论
目前关于百合酵素的研究鲜有报道,本文对百合酵素发酵过程有机酸及体外抗氧化活性变化进行分析,结果表明,发酵过程中超氧自由基清除能力和还原力总体呈上升趋势,羟自由基和DPPH自由基清除能力呈先上升后下降的趋势,ABTS自由基清除能力呈不规则变化。百合酵素有机酸组成及含量丰富,以乳酸和醋酸为主,此外还含有草酸、L-酒石酸、L-苹果酸、莽草酸、柠檬酸及琥珀酸;除L-酒石酸和柠檬酸含量呈不规则变化外,其余各有机酸总体变化趋势相同,均随发酵进行上升,60~80 d达到最高后趋于稳定或降低。在类间距离15处,聚类分析将发酵过程分为3类,即适应期、增长期和平缓期;将有机酸分为2类,即呈上升趋势且含量较高的有机酸,以及呈不规则变化的有机酸;聚类分析的结果较好地反映出发酵过程各类有机酸的差异性,为百合酵素发酵阶段的调控提供了良好的理论参考。相关性分析表明,发酵过程中乳酸、醋酸等有机酸是影响百合酵素抗氧化活性的重要因素,但百合酵素中可能同时存在多糖、游离氨基酸等活性物质,因此有必要对百合酵素中有机酸与其他功能成分的联合抗氧化作用进行研究。食用植物酵素的传统制备工艺采用自然发酵,属混菌发酵过程,除以纯培养方法获取个体优势菌种外,有必要开展对发酵过程微生物整体群落结构及演替规律的研究,明确对有机酸变化起主导作用的核心微生物菌群,为百合酵素发酵阶段的理性调控提供理论基础。
