紫铆花素对PC12细胞氧化应激损伤的保护作用及对线粒体功能的影响研究
2020-01-11刘珂娣段佳林苏晶陶星茹赵石白杨卫培峰奚苗苗
刘珂娣 段佳林 苏晶 陶星茹 赵石 白杨 卫培峰 奚苗苗
摘 要 目的:研究紫铆花素对PC12细胞氧化应激损伤的保护作用及对线粒体功能的影响。方法:将大鼠PC12细胞分为正常对照组、模型组、溶剂对照组(1‰二甲基亚砜)和紫铆花素高、中、低浓度组(2、1、0.5 μmol/L)。后4组给予相应试剂/药物干预24 h后,除正常对照组外的其余组均以100 mU/mL葡萄糖氧化酶诱导氧化应激模型。培养4 h后,检测细胞存活率、凋亡率和细胞内活性氧(ROS)、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、三磷酸腺苷(ATP)、白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)水平或活性以及线粒体膜电位(MMP)变化。结果:与正常对照组比较,模型组细胞存活率和SOD、CAT、GSH-Px、ATP活性或水平均显著降低,凋亡率、ROS含量和MDA、IL-1β、TNF-α水平均显著增加(P<0.05或P<0.01),MMP明显降低。与模型组比较,溶剂对照组上述指标均无明显变化(P>0.05),紫铆花素高、中、低浓度组细胞存活率和SOD(除中、低浓度组外)、CAT、GSH-Px(除中、低浓度组外)、ATP(除低浓度组外)活性或水平均显著升高,凋亡率、ROS含量和MDA、IL-1β、TNF-α水平均顯著降低(P<0.05或P<0.01),MMP明显增加。结论:紫铆花素可通过增强抗氧化酶活性,稳定线粒体功能,抑制氧化应激和炎症反应,增加能量生成,进而抑制神经细胞凋亡,最终发挥神经保护的作用。
关键词 紫铆花素;PC12细胞;氧化应激;线粒体功能;炎症;细胞凋亡;神经保护
ABSTRACT OBJECTIVE: To study the protective effects of butein on oxidative stress injury of PC12 cell and its effects on mitochondrial function. METHODS: Rats PC12 cells were divided into normal control group, model group, solvent control group (1 ‰ dimethyl sulfoxide), butein high, medium and low concentration groups (2, 1, 0.5 μmol/L). The latter 4 groups were given relevant reagent/medicine for intervention; 24 h later, other groups were given 100 mU/mL glucose oxidase to induce oxidant stress model except for normal control group. After 4 h culture, cell survival rate, apoptosis rate, the levels or activities of ROS, MDA, SOD, CAT, GSH-Px, ATP, IL-1β and TNF-α as well as the change of MMP were detected. RESULTS:Compared with normal control group, cell survival rate, the levels or activities of SOD, CAT, GSH-Px and ATP were all decreased significantly, and apoptotic rate, the content of ROS, the levels of MDA, IL-1β and TNF-α were all increased significantly (P<0.05 or P<0.01), while the MMP was decreased significantly. Compared with model group, above indexes of solvent control group had no significant change (P>0.05), cell survival rates, the levels or activities of SOD (except for medium and low concentration groups), CAT, GSH-Px (except for medium and low concentration groups), ATP (except for low concentration group) were increased significantly in butein high, medium and low concentration groups, while apoptotic rates, the content of ROS, the levels of MDA, IL-1β and TNF-α were decreased significantly (P<0.05 or P<0.01), while the MMP were increased significantly. CONCLUSIONS:Butein can increase the antioxidant enzyme activity, stabilize mitochondrial function, inhibit oxidative stress and inflammationthus, increase energy generation inhibiting neuronal cell apoptosis ultimately exerting a neuroprotective effect.
KEYWORD Butein; PC12 cell; Oxidative stress; Mito- chondrial function; Inflammation; Apoptosis; Neuroprotection
腦卒中是威胁人类健康的重大疾病,发病率呈逐年升高趋势,具有死亡率高、致残率高、复发率高等特点[1]。该病分为缺血性卒中(Ischemic stroke,IS)和出血性卒中(Hemorrhagic stroke,HS),其中超过75%的脑卒中为IS[1]。IS是由大脑局部血流循环障碍、脑组织缺血缺氧所导致的神经功能损伤综合征,其发病机制与氧化应激、能量代谢紊乱、炎症、细胞凋亡等多种因素密切相关[2]。脑缺血时产生大量活性氧(ROS),机体氧化-抗氧化系统失衡[3-4],诱导线粒体内、外膜发生脂质过氧化反应,线粒体氧化应激加重,线粒体膜电位(MMP)下降难以维持线粒体的氧化磷酸化过程,使得三磷酸腺苷(ATP)合成显著下降,细胞呼吸与能量转换紊乱,进而导致促炎因子释放,加重炎症反应,诱导神经细胞凋亡,进一步加重神经损伤[5-7]。可见,线粒体是细胞能量代谢的主要场所,以线粒体为靶点治疗IS的研究策略受到了学者的广泛关注。目前,临床常用的IS治疗手段包括溶栓药物和神经介入技术,但由于二者的治疗时间窗狭窄,使得其治疗效果受到了严重的影响[8-9],故寻找新的治疗手段迫在眉睫。
中医称脑卒中为“中风”,始见于《黄帝内经》。清代医家王清任认为,气虚血瘀为中风病的病机,历代医家也常以活血化瘀类中药治疗中风[10]。紫铆花素(Butein)是从活血化瘀类中药降香中提取的主要活性成分,属于黄酮类化合物中的查尔酮类(结构式见图1)[11]。本课题组前期研究结果表明,紫铆花素可改善细胞氧化应激状态,抑制心肌细胞损伤,具有心肌保护作用[12]。但该化合物是否具有神经保护作用,其作用机制是否与线粒体能量代谢有关尚未见报道。基于此,本研究以葡萄糖氧化酶(GOD)诱导的氧化应激细胞模型为对象,探讨紫铆花素对PC12神经细胞氧化应激损伤的保护作用及其对线粒体功能的影响,旨在为寻找神经保护类药物提供参考依据。
1 材料
1.1 仪器
371型CO2培养箱、Multiskan Sky型酶标仪(美国Thermo Fisher Scientific公司);Accuric 6型流式细胞仪[碧迪医疗器械(上海)有限公司];A1型激光共聚焦荧光显微镜(日本Nikon公司);BSC-1100ⅡA2-X型生物安全柜(山东博科生物产业有限公司);TD4型台式离心机(湖南湘仪实验室仪器开发有限公司);BSA124S型分析天平[赛多利斯科学仪器(北京)有限公司];THZ-100型恒温摇床(上海一恒仪器有限公司);QL901型涡旋仪(海门市其林贝尔仪器有限公司)。
1.2 药品与试剂
紫铆花素标准品(上海源叶生物科技有限公司,批号:T18J6C1,纯度:≥98%);GOD(北京索莱宝科技有限公司,批号:329J021);胎牛血清(FBS,以色列BI公司,批号:1928625);青霉素-链霉素双抗溶液(批号:30002317)、胰蛋白酶消化液(批号:30119014)、杜氏磷酸盐缓冲液(D-PBS,pH=7.4,批号:21031012)、DMEM高糖培养基(批号:1001303)均购自美国Corning公司;二甲基亚砜(DMSO,美国MP公司,批号:Y181007);CCK-8试剂盒(上海翊圣生物科技有限公司,批号:C6901030);膜联蛋白Ⅴ-异硫氰酸荧光素/碘化丙啶(Annexin Ⅴ-FITC/PI)双染色法细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司,批号:20190528);ROS(批号:20190606)、丙二醛(MDA,批号:20190618)、超氧化物歧化酶(SOD,批号:20190625)、过氧化氢酶(CAT,批号:20190628)、谷胱甘肽过氧化物酶(GSH-Px,批号:20190625)、ATP(批号:20190708)检测试剂盒均购自南京建成生物工程研究所;MMP检测试剂盒(JC-1染色)(上海碧云天生物技术有限公司,批号:120919190613);白细胞介素1β(IL-1β,批号:201909)、肿瘤坏死因子α(TNF-α,批号:201909)酶联免疫吸附测定(ELISA)检测试剂盒均购自安徽巧伊生物科技有限公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 细胞
大鼠肾上腺嗜铬细胞瘤细胞系PC12神经细胞由空军军医大学预防医学系毒理学教研室赠予。
2 方法
2.1 细胞培养
PC12细胞用完全培养基(即含10%FBS、1%青霉素-链霉素双抗的DMEM高糖培养基),置于37 ℃、5%CO2恒温培养箱中培养(培养条件下同),每2天更换1次培养基,待细胞融合至90%左右时,用0.25%胰蛋白酶消化并进行传代。
2.2 细胞分组与处理
将PC12细胞分为6组,分组与处理——正常对照组:完全培养基培养;模型组:含100 mU/mL(浓度根据前期预试验结果设置)GOD的基础培养基(即无血清的DMEM高糖培养基)培养4 h;溶剂对照组:先用含1‰DMSO的基础培养基培养24 h后,再用含100 mU/mL GOD的基础培养基培养4 h;紫铆花素高、中、低浓度组:先用含2、1、0.5 μmol/L紫铆花素(溶剂为1‰DMSO,浓度根据前期预试验结果设置)的基础培养基培养24 h,再用含100 mU/mL GOD的基础培养基培养4 h。
2.3 细胞活性检测
以5×104个/孔将PC12细胞接种于96孔板中,待细胞贴壁后,按“2.2”项下方法分组、处理,同时设置不含细胞和药物的空白对照组,每组设置5个复孔。建模培养4 h后,更换含10%CCK-8的完全培养基,于37 ℃、5%CO2细胞培养箱中孵育4 h,使用酶标仪在450 nm波长处检测各孔的光密度(OD)值并计算细胞存活率:细胞存活率(%)=(OD试验组-OD空白对照组)/(OD正常对照组-OD空白对照组)×100%。试验重复3次。
2.4 细胞凋亡率检测
以5×105个/孔将PC12细胞接种于6孔板中,待细胞贴壁后,按“2.2”项下方法分组、处理,每组设置3个复孔。建模培养4 h后,用胰蛋白酶消化,收集细胞悬液,D-PBS洗1次,1 000 r/min離心5 min,弃去上清液,沉淀加入AnnexinⅤ-FITC和PI染色试剂各3 μL,吹匀,避光孵育15 min后,使用流式细胞仪检测细胞凋亡率。试验重复3次。
2.5 细胞内ROS含量检测
以5×105个/孔将PC12细胞接种于6孔板中,待细胞贴壁后,按“2.2”项下方法分组、处理,每组设置3个复孔。建模培养4 h后,吸弃旧培养基,D-PBS洗1次,用基础培养基将ROS试剂盒中的2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)染色液稀释至10 μmol/L,每孔加入上述染色液1 mL,置于37 ℃、5%CO2培养箱中孵育1 h,弃去培养基,D-PBS洗3次,用胰蛋白酶消化,收集细胞悬液,1 000 r/min离心5 min,弃去上清液,每管加入D-PBS 500 μL,吹匀,使用流式细胞仪检测细胞内ROS含量。试验重复3次。
2.6 细胞内MDA、SOD、CAT、GSH-Px、ATP、IL-1β、TNF-α水平检测
以5×105个/孔将PC12细胞接种于6孔板中,待细胞贴壁后,按“2.2”项下方法分组、处理,每组设置3个复孔。建模培养4 h后,按照试剂盒说明书处理细胞后,收集上清液,以比色法检测细胞内氧化损伤相关蛋白(MDA、SOD、CAT、GSH-Px)、ATP水平或活性,ELISA法检测细胞内炎症因子(IL-1β、TNF-α)水平。试验重复3次。
2.7 细胞MMP观察
以5×105个/孔将PC12细胞接种于放置有细胞爬片的6孔板中,待细胞贴壁后,按“2.2” 项下方法分组、处理,每组设置3个复孔。建模培养4 h后,吸弃培养基,每孔加入JC-1染色工作液1 mL,孵育20 min后,用JC-1染色缓冲液(1×)轻轻洗3遍,每孔再加入完全培养基1 mL,置于激光共聚焦荧光显微镜下观察、拍照。
2.8 统计学方法
采用SPSS 20.0软件对数据进行统计分析。结果以x±s表示,组间比较采用方差分析,两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 细胞存活率
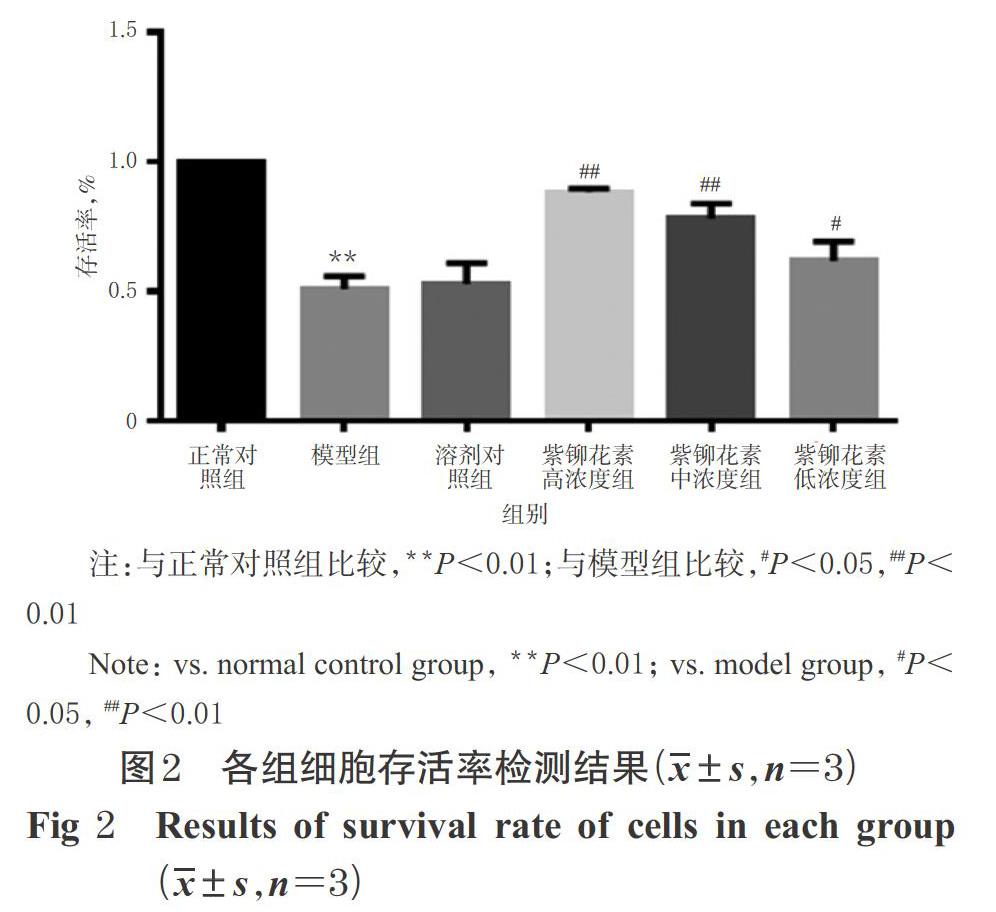
与正常对照组比较,模型组细胞存活率显著降低(P<0.01),提示GOD引起PC12细胞存活率下降。与模型组比较,溶剂对照组细胞存活率无明显变化(P>0.05),紫铆花素高、中、低浓度组细胞存活率均显著升高(P<0.05或P<0.01),提示紫铆花素可提高PC12细胞氧化应激损伤后的存活率。各组细胞存活率检测结果见图2。
3.2 细胞凋亡率
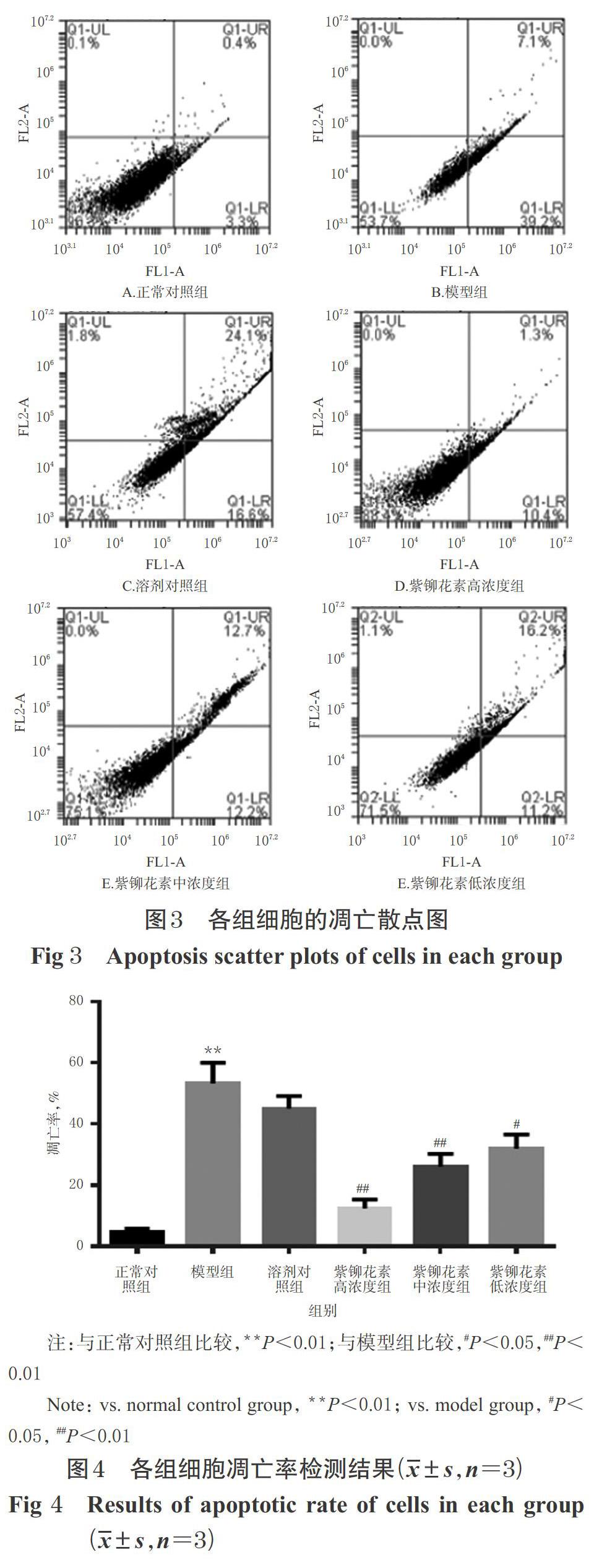
与正常对照组比较,模型组细胞凋亡率显著升高(P<0.01),提示GOD可导致PC12细胞凋亡。与模型组比较,溶剂对照组细胞凋亡率无明显变化(P>0.05),紫铆花素高、中、低浓度组细胞凋亡率均显著降低(P<0.05或P<0.01),提示紫铆花素可抑制GOD引起的PC12细胞凋亡。各组细胞的凋亡散点图见图3,凋亡率检测结果见图4。
3.3 细胞内ROS含量
与正常对照组比较,模型组细胞内ROS含量显著升高(P<0.01),提示GOD可导致PC12细胞内ROS生成增加。与模型组比较,溶剂对照组细胞内ROS含量无明显变化(P>0.05),紫铆花素高、中、低浓度组细胞内ROS含量均显著降低(P<0.05或P<0.01),提示紫铆花素可清除细胞内ROS。各组细胞内ROS含量检测结果见图5。
3.4 细胞内氧化损伤相关蛋白活性或水平
与正常对照组比较,模型组细胞内MDA水平显著升高,SOD、CAT、GSH-Px活性均显著降低(P<0.05或P<0.01),提示GOD可诱导PC12细胞发生脂质过氧化反应,导致脂质过氧化产物堆积,氧化-抗氧化体系失衡,抗氧化酶活性下降。与模型组比较,溶剂对照组上述指标均无明显变化(P>0.05),紫铆花素高、中、低浓度组细胞内MDA水平均显著降低,紫铆花素高、中、低浓度组CAT活性和高浓度组SOD、GSH-Px活性均显著升高(P<0.05或P<0.01);而紫铆花素中、低浓度组虽有增强SOD、GSH-Px活性的趋势,但与模型组比较差异均无统计学意义(P>0.05),提示紫铆花素可提高抗氧化酶活性,增强细胞抗氧化能力,减轻GOD诱导的氧化应激对PC12细胞的损伤。各组细胞内氧化损伤相关蛋白活性或水平检测结果见图6。
3.5 细胞ATP水平
与正常对照组比较,模型组细胞ATP水平显著降低(P<0.01),提示GOD可诱导PC12细胞线粒体能量代谢紊乱,使ATP合成显著下降。与模型组比较,溶剂对照组细胞ATP水平无明显变化(P>0.05),紫铆花素高、中浓度组细胞ATP水平均显著升高(P<0.05或P<0.01),而低浓度组虽有提高细胞ATP水平的趋势,但与模型组比较差异无统计学意义(P>0.05),提示紫铆花素可改善GOD诱导PC12细胞的线粒体代谢紊乱,增加ATP合成。各组细胞ATP水平检测结果见图7。
3.6 细胞内炎症因子水平
与正常对照组比较,模型组细胞内IL-1β、TNF-α水平均显著升高(P<0.01),提示GOD可诱导PC12细胞炎症发生。与模型组比较,溶剂对照组上述指标均无明显变化(P>0.05),紫铆花素高、中、 低浓度组细胞内IL-1β、TNF-α水平均显著降低(P<0.05或P<0.01),提示紫铆花素可抑制GOD诱导的PC12细胞炎症反应。各组细胞内IL-1β、TNF-α水平检测结果见图8。
3.7 细胞MMP
与正常对照组比较,模型组细胞内绿色荧光增强,红色荧光减弱,细胞MMP明显降低,提示GOD可导致PC12细胞线粒体功能受损。与模型组比较,溶剂对照组细胞内荧光均无明显变化,紫铆花素高、中、低浓度组细胞内红色荧光均增强,绿色荧光均减弱,细胞MMP明显增加,提示紫铆花素可通过稳定MMP改善线粒体功能而缓解GOD诱导的PC12细胞氧化应激损伤。各组细胞MMP的荧光显微图见图9(图中,红色荧光表示MMP较高,绿色荧光表示MMP较低)。
4 讨论
已有研究表明,IS的发病机制复杂,氧化应激是其发生、发展的重要病理因素之一。当氧化应激发生时,ROS过度积累可导致机体抗氧化系统紊乱,体内氧自由基代谢失衡诱导神经细胞线粒体氧化应激,损伤线粒体,使细胞MMP下降;同时,线粒体氧化磷酸化受限,ATP合成减少,线粒体能量代谢失调,从而引发炎症反应、诱导神经细胞凋亡,最终损伤脑组织神经元[13-17]。
本研究采用的GOD致损伤细胞模型为典型的氧化应激模型。传统的氧化应激模型诱导剂为过氧化氢(H2O2),见光易分解,性质极不稳定;而GOD是一种生物催化剂,能够模拟氧化环境,参与体内的氧化还原反应,催化氧气稳定生成H2O2,进而产生大量的羟自由基(·OH)以诱导并加剧蛋白质及脂质的氧化损伤[18]。本研究通过检测紫铆花素对GOD诱导的氧化应激模型细胞活性及凋亡的影响来评价该化合物对神经细胞氧化损伤的改善作用。结果表明,紫鉚花素不同剂量组均可促进细胞存活、抑制细胞凋亡。
紫铆花素的分子结构中含有抗氧化活性基团邻二酚羟基,提示其对氧化应激PC12细胞的改善作用可能与清除自由基、抑制脂质过氧化密切相关。Cheng ZJ等[15]的研究也证实,紫铆花素可通过清除多种自由基及螯合金属离子,抑制Fe2+诱导的大鼠脑组织脂质过氧化反应,并可通过抑制黄嘌呤氧化酶的活性,减少ROS的生成。ROS是自由基的统称,其主要成员的分子结构中都含有氧原子,具有极强的氧化能力,如超氧阴离子自由基(·O2-)、H2O2、·OH等[19]。堆积的ROS不仅能与膜磷脂的不饱和脂肪酸发生脂质过氧化反应,还可与一氧化氮形成过氧亚硝酸根离子(ONOO-)以促进脂质过氧化反应的进程;氧化产物MDA破坏细胞膜完整性,影响细胞结构,改变离子运输,导致细胞能量代谢障碍[20],其含量高低在一定程度上可直接或间接反映脂质过氧化水平和细胞脂质过氧化损伤程度[21]。本研究结果表明,不同浓度紫铆花素对氧化应激PC12细胞内ROS、MDA水平均有显著抑制作用,这可能与其脂溶性较强,可进入细胞脂质双分子层发挥作用相关;同时,这也提示紫铆花素抑制PC12细胞氧化应激的作用机制可能与抑制细胞脂质过氧化反应进程、降低脂质过氧化反应产物MDA水平、抑制细胞氧化-抗氧化系统中的氧化进程有关。
为了进一步评价紫铆花素对氧化-抗氧化系统中抗氧化屏障的影响,本研究检测了细胞内SOD、GSH-Px、CAT活性。机体内源性清除氧自由基的抗氧化酶主要是SOD、GSH-Px、CAT。其中,SOD能清除·O2-,避免细胞氧化应激,该指标活性水平能间接反应机体氧自由基反应程度和清除能力;GSH-Px主要清除细胞呼吸代谢过程中产生的·OH和过氧化物,减少细胞膜不饱和脂肪酸脂质过氧化;CAT的主要功能是清除生物体内的H2O2[22],且GSH-Px能和CAT共同催化SOD分解的氧自由基产物H2O2代谢为H2O和O2,降低体内H2O2水平,以保护细胞免受氧化应激损伤[23-24]。有研究表明,紫铆花素可以抑制谷氨酸诱导的神经元氧化损伤,维持SOD、GSH-Px、谷胱甘肽还原酶(GR)等抗氧化酶的活性不因谷氨酸损伤而降低,减少ROS的产生,从而保护小鼠海马神经元[25]。另外,姜辰等[7]认为,抗氧化物与自由基之间的动态平衡被打破,抗氧化系统失衡,线粒体膜脂质过氧化反应增强,导致线粒体功能受损,线粒体发生氧化应激,从而使IS加重。本研究发现,紫铆花素不同浓度组能显著升高抗氧化酶SOD、GSH-Px、CAT的活性,提高细胞抗氧化屏障,增加抗氧化能力,提示紫铆花素可能是通过提高抗氧化酶活性进而提高抗氧化屏障,抑制脂质过氧化反应,促进抗氧化进程,进一步抑制线粒体氧化应激,从而发挥神经保护作用。
线粒体是一种普遍存在于真核细胞中的细胞器,细胞生命活动提供所需要的能量基本都是由线粒体提供,故其被称为“能量工厂”[26]。线粒体具有双层膜结构,其内、外膜通透性的差异可以使线粒体内膜两侧形成质子梯度,这是维持线粒体膜电势的关键因素,也是推动ATP合成的先决条件[27]。正常的MMP是维持线粒体进行氧化磷酸化、产生ATP的先决条件,MMP的稳定有利于维持细胞的正常生理功能;而病理状态下,大量产生的ROS可造成线粒体膜脂质过氧化,线粒体氧化应激破坏了膜的完整性和通透性,使氧化磷酸化减少或不能进行,导致MMP降低,ATP产生迅速减少,细胞呼吸和能量转化紊乱,线粒体功能异常,诱发促炎因子释放,增加炎症反应发生,最终导致细胞凋亡或坏死[28-29]。李强等[30]发现,线粒体中脂质过氧化产物MDA水平升高时,ROS水平显著增高,MMP持续下降,ATP合成显著减少,最终导致神经元凋亡或坏死。本研究中,紫铆花素不同浓度组可能通过抑制细胞脂质过氧化反应,降低细胞内线粒体氧化应激,稳定细胞线粒体MMP,增加线粒体膜的通透性,增加ATP的合成,恢复线粒体的能量供给,增强线粒体功能,从而发挥神经保护作用。
ROS蓄积会导致线粒体膜脂质过氧化,线粒体氧化应激加重[31],进而会导致促炎因子TNF-α和IL-1β释放增加,直接或间接诱导神经毒性介质的产生,增加血脑屏障通透性,引发炎症级联反应,加重神经元损伤[32-33]。已有研究报道,紫铆花素能有效抑制炎症反应,显著降低炎症因子TNF-α和IL-1β的水平,且能抑制ROS生成,降低细胞炎症反应和氧化应激,发挥保护作用[34]。本研究进一步检测了细胞炎症因子的水平,结果表明,紫铆花素对氧化应激PC12细胞内炎症因子TNF-α和IL-1β均有显著抑制作用,提示该化合物可能通过降低线粒体氧化应激,稳定线粒体功能,进一步降低炎症反应,减轻炎症损伤,发挥神经保护作用,但具体的分子机制还需要进一步探索和验证。
综上所述,紫铆花素可通过增强抗氧化酶活性,减少ROS生成,抑制脂质过氧化反应,减轻氧化应激,稳定MMP,增加能量生成,减少炎症反应,从而发挥神经保护作用。
参考文献
[ 1 ] SEIFFGE DJ,WERRING DJ,PACIARONI M,et al. Timing of anticoagulation after recent ischemic stroke in patients with atrial fibrillation[J]. Lancet Neurol,2019,18(1):117-126.
[ 2 ] 陈孝男,杨爱琳,赵亚楠,等.缺血性脑中风的发病机制及其常用治疗中药研究进展[J].中国中药杂志,2019,44(3):422-432.
[ 3 ] HALLIWELL B,GUTTERIDGE JC. Lipid peroxidation,oxygen radicals,cell damage,and antioxidant therapy[J].Lancet,1984,323(8391):1396-1397.
[ 4 ] 戴玥,郑佳,郑黎强.抗氧化物质和自由基产物与脑卒中关系的研究进展[J].实用医学杂志,2019,35(3):489- 491.
[ 5 ] 陈红,吴俊杰,薛强,等.以線粒体为靶点抗缺血性脑卒中中药有效成分研究进展[J].中国新药杂志,2016,25(11):1236-1240.
[ 6 ] 李凤,李小刚.氧自由基在缺血性脑卒中的机制研究现状[J].西南军医,2013,15(2):182-184.
[ 7 ] 姜辰,叶建林.基于线粒体的缺血性脑卒中病理机制研究进展[J].国际神经病学神经外科学杂志,2017,44(3):323-326.
[ 8 ] 吴雅云,庞鑫,刘刚.纳米载药系统应用于缺血性脑卒中的研究进展[J].中国药房,2018,29(10):1425-1430.
[ 9 ] 中华医学会神经病学分会.中国急性缺血性脑卒中诊治指南2014[J].中华神经科杂志,2015,48(4):246-257.
[10] 孟丹.浅析中医中风病的病因病机[J].科技视界,2016(18):165.
[11] 施蛟,陈博,孙智华,等.中间锦鸡儿黄酮类成分的研究[J].药学学报,2003,38(8):599-602.
[12] 段佳林,奚苗苗,牟菲,等.紫铆花素通过调节AMPK/GSK-3β信号通路抑制心肌缺血再灌注损伤[J].现代生物医学进展,2017,17(14):2616-2621.
[13] HANKEY GJ. Anticoagulant therapy for patients with ischaemic stroke[J]. Nat Rev Neurol,2012,8(6):319- 328.
[14] YEPES M,ROUSSEL BD,ALI C,et al. Tissue-type plasminogen activator in the ischemic brain:more than a thrombolytic[J]. Trends Neurosci,2009,32(1):48-55.
[15] CHENG ZJ,KUO SC,CHAN SC,et al. Antioxidant properties of butein isolated from Dalbergia odorifera[J]. Biochim Biophys Acta,1998,1392(2/3):291-299.
[16] CHAN SC,CHANG YS,WANG JP,et al. Three new flavonoids and antiallergic,anti-inflammatory constituents from the heartwood of Dalbergia odorifera[J]. Planta Med,1998,64(2):153-158.
[17] 徐运.氧化应激与脑缺血再灌注损伤[J].中国卒中杂志,2008,3(3):195-197.
[18] 吴咏梅,陶茹莹,孟祥宝,等.缺血性脑卒中损伤机制研究进展[J].吉林中医药,2018,38(3):368-372.
[19] 赵曙光,李强,王旭霞,等.葡萄糖氧化酶诱导肝细胞氧化应激模型的建立[J].现代生物医学进展,2011,11(2):243-245.
[20] 马淇,刘垒,陈佺.活性氧、线粒体通透性转换与细胞凋亡[J].生物物理学报,2012,28(7):523-536.
[21] NIGAM S,SCHEWE T. Phospholipase A2s and lipid peroxidation[J]. Biochim Biophys Acta,2000,1488(1/2):167-181.
[22] 于德玲,王昌留.过氧化氢酶的研究进展[J].中国组织化学与细胞化学杂志,2016,25(2):189-194.
[23] 杨牧祥,于文涛,徐华洲,等.中风康对局灶性脑缺血大鼠脑组织SOD、MDA的影响[J].中医药学刊,2005,23(8):1365-1367.
[24] 孙凤云,牟英辉.大株红景天联合硫辛酸对急性缺血性脑卒中患者氧化应激的影响[J].中国药业,2015,24(20):52-54.
[25] 王春娟,薛连璧.缺血性脑卒中与NO、SOD关系研究进展[J].脑与神经疾病杂志,2007,15(5):391-394.
[26] 杨子平,包怡敏.三七总皂苷对线粒体调控作用的研究进展[J].中国中药杂志,2017,42(5):870-874.
[27] LIU Q,LI X,LI L,et al. Ginkgolide K protects SH-SY5Y cells against oxygen-glucose deprivation-induced injury by inhibiting the p38 and JNK signaling pathways[J]. Mol Med Rep,2018,18(3):3185-3192.
[28] CHO N,CHOI JH,YANG H,et al. Neuroprotective and anti-inflammatory effects of flavonoids isolated from Rhus verniciflua in neuronal HT22 and microglial BV2 cell lines[J]. Food Chem Toxicol,2012,50(6):1940- 1945.
[29] 孙丽娜,彭艳艳,金露,等.缺氧对小鼠离体脑线粒体氧化应激的影响[J].中国临床神经科学,2012,20(1):6-9.
[30] 李强,翟宇,张婷,等.脑缺血再灌注后线粒体氧化应激损伤的动态变化[J].中国临床神經科学,2014,22(3):241-247.
[31] 乔卫龙,李炜弘,史年刚,等.线粒体能量代谢与疾病关联机制的研究进展[J].云南中医中药杂志,2016,37(4):61-62.
[32] 王欢欢,薛茜,邹玉安.内源性抗氧化应激机制在缺血预处理与缺血再灌注损伤中的研究进展[J].神经药理学报,2016,6(2):46-52.
[33] 宁文华,李礼,郭扬,等.星形胶质细胞与缺血性脑卒中的关系及针刺干预研究进展[J].针刺研究,2019,44(10):777-780.
[34] 陈子卓,徐宇航,姜晓旭,等.紫铆花素抑制脂多糖诱导的骨髓源性巨噬细胞炎症反应的研究[J].癌变畸变突变,2020,32(3):171-176.
(收稿日期:2020-09-27 修回日期:2020-11-24)
(编辑:邹丽娟)
