超声心动图评价吡柔比星所致早期心脏毒性的价值
2020-01-10黄世鑫朱冬冬陈轶洁
黄世鑫 朱冬冬 陈轶洁
乳腺癌是目前我国女性最常见的恶性肿瘤,近年来其发病率和死亡率明显上升[1-2]。蒽环类化疗药物(anthracycline,ACT)主要包括表阿霉素、表阿霉素、吡柔比星、表柔比星等,被广泛应用于乳腺癌、淋巴瘤、胃癌、急性白血病等疾病的治疗,蒽环类药物具有抗瘤谱广、作用强,疗效确切等优势,在乳腺癌的临床治疗中不可或缺[3]。其主要毒副作用为心脏蓄积毒性[4],即使较低剂量也可诱发短期及长期的心脏毒性,随着剂量增加,心脏毒性往往具有不可逆性,甚至危及生命。随着新型药物的不断研发,如吡柔比星脂质体、表柔比星脂质体等,和临床研究不断深入,蒽环类药物心脏毒性发生率明显下降,但仍然存在早期心肌损伤。因此,早期发现其心脏毒性具有重要意义[5]。本研究分析接受蒽环类药物吡柔比星化疗的乳腺癌患者心功能参数变化,评价其在早期心肌损伤检测中的临床应用价值。
1 资料与方法
1.1 一般资料
2015年4月—2017年1月于福建省肿瘤医院初诊为乳腺癌患者40例,平均年龄为(45.83±8.14)岁,病理均证实为浸润性导管癌。所有患者在行乳腺癌根治术前、后均采用以蒽环类药物的吡柔比星为主的序贯化疗方案,即ACT方案(环磷酰胺+吡柔比星4个周期,多西他赛4个周期)辅助化疗,每疗程吡柔比星剂量为60 mg/m2,每次化疗间隔为21 d,于化疗前,第2次化疗结束及第4次化疗结束后进行超声心动图检查。纳入标准:均为18岁以上经病理确诊为浸润性导管癌欲行化疗的女性患者;依从性好,同意参与本研究并签署知情同意书。排除标准:存在严重心、脑、肾等器官疾病患者;精神异常患者;孕妇;既往接受蒽环类药物化疗或纵隔放疗者。本研究通过医院伦理委员会的批准,并取得研究对象本人及家属的知情同意,均签署知情同意书。
1.2 研究方法
1.2.1 仪器 采用西门子Acuson S2000彩色多普勒超声诊断仪,探头为4P1,频率为2~4mHz。
1.2.2 常规超声心动图(Echocardiography,ECG)参数测量受检者取左侧卧位,平静呼吸,Simpson四腔法测量左室射血分数(LVEF);在心尖四腔心切面,应用脉冲多普勒测得二尖瓣血流频谱,即二尖瓣口舒张早期血流速度(E峰)与舒张晚期最大血流速度(A峰);另取标准心尖四腔心切面,TDI模式下,将取样容积分别置于二尖瓣前后叶瓣环,测得二尖瓣环收缩期运动速度峰值Sm、舒张早期运动速度峰值Em与舒张晚期运动速度峰值Am。
1.3 观察指标
分析比较患者化疗前,第2次化疗后及第4次化疗后超声心动图参数LVEF,二尖瓣口舒张早期血流速度(E峰)与舒张晚期最大血流速度(A峰)、E/A比值,及组织多普勒参数Sm、Em,Em/Am比值变化规律。
1.4 统计学方法
2 结果
所有入组患者均完成4次吡柔比星序贯化疗,治疗过程中均未出现心力衰竭等严重的心脏毒性。化疗前后E/A、Sm差异无统计学意义;化疗后LVEF呈现下降趋势,且差异具有统计学意义(P<0.05)。舒张功能指标Em/Am比值较化疗前下降(P< 0.05)。
表1 两组研究对象常规超声心动图均数比较( ±s)
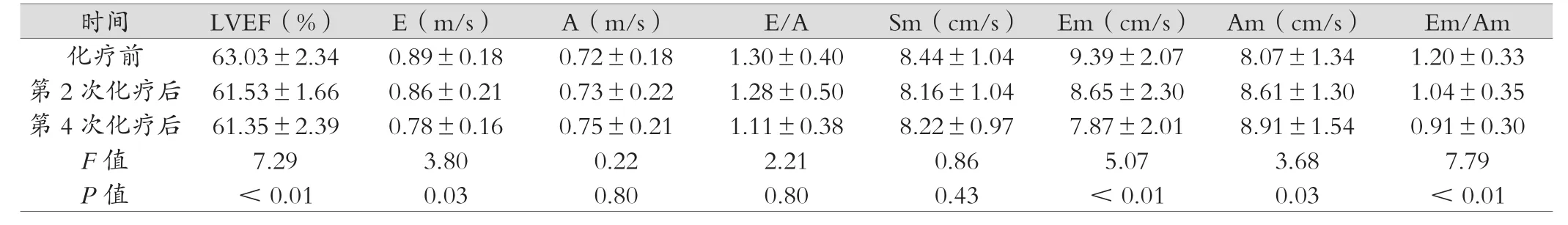
表1 两组研究对象常规超声心动图均数比较( ±s)
时间 LVEF(%) E(m/s) A(m/s) E/A Sm(cm/s) Em(cm/s) Am(cm/s) Em/Am化疗前 63.03±2.34 0.89±0.18 0.72±0.18 1.30±0.40 8.44±1.04 9.39±2.07 8.07±1.34 1.20±0.33第2次化疗后 61.53±1.66 0.86±0.21 0.73±0.22 1.28±0.50 8.16±1.04 8.65±2.30 8.61±1.30 1.04±0.35第4次化疗后 61.35±2.39 0.78±0.16 0.75±0.21 1.11±0.38 8.22±0.97 7.87±2.01 8.91±1.54 0.91±0.30 F值 7.29 3.80 0.22 2.21 0.86 5.07 3.68 7.79 P值 <0.01 0.03 0.80 0.80 0.43 <0.01 0.03 <0.01
3 讨论
蒽环类药物是乳腺癌治疗中常用的化疗药物。因其容易导致心脏毒性,且常为不可逆转性,临床应用受到一定限制。目前研究表明,氧化应激是蒽环类药物引起心脏损伤的机制之一,蒽环类药物代谢过程可产生许多活性氧类(reactive oxide synthase,ROS),蒽环类药物螯合铁离子后触发氧自由基,导致心肌细胞膜脂质过氧化和线粒体损伤[6-7]。临床观察和研究显示,蒽环类药物导致心脏损伤往往呈聚积性和不可逆性[8],大多数患者在蒽环类给药后可较快地发生心脏损坏,且随着时间的延长和药物累积剂量的增加而明显[9]。蒽环类药物的慢性和迟发性心脏毒性与其累积剂量呈正相关[10]。近年来的研究显示,低剂量蒽环类药物也可能引起心脏毒性,一些接受低剂量ADM治疗的患者在长期随访过程中发现了心功能的异常,蒽环类药物的使用并没有绝对的安全剂量。因此,早期评估并预防蒽环类药物引起的心脏毒性尤为重要[11]。
目前临床用于评估ATC药物心脏毒性的方法有常规超声心动图心电图、心肌酶标志物、心内膜活检和心肌灌注显像,心电图作为临床常规检查手段,能为ATC药物引起的心律失常提供证据,但心律失常以及ST-T改变特异性不高,不能准确反映心脏功能情况。PET/CT动态心肌灌注显像能够敏感地反映心肌血流储备功能的变化情况,提高对于早期心脏微循环变化的诊断准确度和预后预测价值[12]。心内膜活检是检测心肌损伤的金标准,且最为敏感,但是作为一项侵入性检查,反复活检不仅增加患者的痛苦,其危险性也随之增加,不宜作为早期检测心脏毒性的手段。
ECG无创、操作简便,易于掌握、重复性好,是目前评价心脏收缩功能变化和早期心肌损伤最常用的方法[13]。左室射血分数(LVEF)是评估左心室收缩功能最常用的指标[14],然而,虽然ATC药物引起心肌损伤可导致心肌收缩力的降低,由于左室整体收缩力储备较大,只有当心肌损伤严重时才会出现LVEF的异常。《2016年欧洲心脏病学会指南》指出,若蒽环类药物化疗后患者的LVEF降低10%以上并且低于50%,则表明已经发生心肌毒性。国内目前对于蒽环类药物心脏毒性的评价主要包括:LVEF较基线下降降低至5%至绝对值<55%,伴随CHF症状,或LVEF降低至少10%至绝对值<55%未伴随有CHF症状或体征。本研究结果显示随着吡柔比星累积剂量的增加,LVEF呈下降趋势,且具有统计学意义,但是二维ECG测量LVEF的方法容易发生变异,且本研究显示吡柔比星化疗后LVEF下降<3%,尚不能提示左室收缩功能减低。
组织多普勒技术(Tissue Doppler Imaging)是检测心肌运动的技术,它可以去除心腔内高速低振幅的的频移信号,提取高振幅、低速的心肌频移信号,可用来定量评估心肌局部功能。本研究显示,化疗后Em减低,Am升高,Em/Am比值较化疗前降低,而二尖瓣口血流频谱指标E/A化疗前后无显著性差异,这表明,组织多普勒参数能较早检测到二尖瓣口血流频谱所不能显示的心脏舒张功能变化,与徐艳萍等[13,15]研究结果一致。二尖瓣血流频谱容易受左室容量、左房压影响,TDI所测舒张期速度测值代表心室长轴方向上的整体舒张功能情况,相对不依赖心脏负荷状态影响,可以较早、较准确地反映左心室舒张功能。
综上所述,常规超声心动图在检测乳腺癌患者ATC药物心脏毒性方面具有重要的临床应用价值,可以无痛、准确地反映心脏功能的变化,为临床化疗方案的选择提供及时、有效的诊断依据。
