右美托咪定对肝癌根治术患者Th1、Th2、Th17、Treg细胞及相关细胞因子的影响
2020-01-09尹彩星司海超范兆阳张占琴
尹彩星, 司海超, 范兆阳, 张占琴
1南阳市中心医院麻醉科(河南南阳 473009); 2南阳市第二人民医院骨科(河南南阳 473009); 3西安交通大学第一附属医院麻醉科(陕西西安 710061)
肝癌是侵袭性较强的恶性肿瘤之一,根治性手术切除仍是临床上治疗肝癌的重要手段。通常状态下机体Th1/Th2、Th17/Treg细胞处于相对平衡状态,研究报道认为Th1/Th2及Th17/Treg细胞比例失衡与术后肿瘤细胞的转移及扩散具有显著相关性[1-2]。右美托咪定是一种高选择性作用于α2肾上腺素能受体激动剂[3],鉴于目前关于右美托咪定对肝癌根治切除术患者Th1/Th2、Th17/Treg细胞比例及其相关细胞因子的研究报道较少,本研究通过分析肝癌患者围手术期的临床资料,进一步评估右美托咪定对肝癌根治术患者免疫功能的影响,为麻醉围手术期的合理用药提供理论依据。
1 资料与方法
1.1 一般资料 纳入2017年1月至2018年12月在南阳市中心医院住院择期行肝癌根治术62例患者作为研究对象,患者纳入标准:(1)美国麻醉医师协会相关标准分为Ⅰ~Ⅱ级;(2)PET-CT或其他相关检查示肝癌无转移,肝功能正常;(3)无肝胆及腹部器官手术病史;(4)无合并其他恶性肿瘤病史。排除标准:右美托咪定过敏者。按照随机数字表将62例患者随机分为右美托咪定组(D组)和对照组(C组),每组31例,两组患者的年龄、性别、原发病、手术类型均差异无统计学意义(P>0.05),具有可比性,见表1。本研究方案经过我院伦理委员会批准,所有患者及其家属均知情同意且签署知情同意协议书。

表1 两组患者一般资料的比较 例
1.2 给药方式 所有患者均术前禁食12 h,禁水6 h,肌内注射溴米那普鲁卡因注射液2 mL(2 mL/支,哈药集团三精制药有限公司),硫酸阿托品注射液0.5 mg(2 mL∶1 mg,湖北科伦药业有限公司);开放右上肢静脉,监测术中血压、二氧化碳分压、血氧饱和度及心电图;于局麻下左侧桡动脉穿刺置管监测动脉压力,观察组患者给予盐酸右美托咪定注射液0.7 μg/kg(2 mL∶0.2 mg,江苏恒瑞医药股份有限公司),10 min内输注完成后再次按照0.4 μg/(kg·h)维持到手术结束,C组按照等量生理盐水代替。麻醉诱导:咪达唑仑注射液0.05~0.1 mg/kg(3 mL∶15 mg,江苏九旭药业有限公司),注射用盐酸瑞芬太尼2 mg(1 mg,国药集团工业有限公司廊坊分公司),丙泊酚乳状注射液1~2 mg/kg(20 mL:200 mg,西安力邦制药有限公司),注射用苯磺酸顺阿曲库铵0.15 mg/kg(10 mg,江苏恒瑞医药股份有限公司)。当患者双侧眼睑反射消失及下颌放松较好时行气管插管。连接麻醉机行机械通气,呼吸频率10~12次/min,吸呼比1∶2,潮气量8~10 mL/kg,术中保持呼气末二氧化碳分压35~40 mmHg(1 mmHg=0.133 kPa)。
1.3 观察指标 肝癌患者手术前后于空腹抽取外周静脉血3 mL于抗凝管中,采用Ficoll淋巴细胞分离液梯度离心获得外周血单个核细胞(PBMC),采用FACSCalibur流式细胞仪(美国,BD公司)进行Th1、Th2、Th17、Treg细胞的检测,血清细胞因子γ干扰素(IFN-γ)、白细胞介素(IL)-4、IL-17α、转化生长因子-β(TGF-β)水平检测采用ELISA检测试剂盒(美国,R&D公司),生化指标通过我院检验科自动生化检测仪检测。分析并比较两组患者术前(T0)及术后4、24、48和72 h丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、肌酐、Th1、Th2、Th17、Treg、Th1/Th2、Th17/Treg细胞比例及其Th1(IFN-γ)、Th2(IL-4)、Th17(IL-17α)、Treg(TGF-β)细胞的代表性细胞因子表达水平的差异。
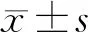
2 结果
2.1 肝癌患者手术特征的比较 两组患者在手术时间、肝脏切除比例及肝门阻断时间上比较差异均无统计学意义(P<0.05),见表2。


项目C组(n=31)D组(n=31)t值P值手术时间(min)130.25±24.17125.69±21.070.7920.432肝脏切除比(%)36.97±7.2534.52±8.691.2050.233肝门阻断时间(min)13.85±3.4114.74±5.230.7940.431
2.2 肝癌患者术前及术后生化指标差异的比较 两组患者术前ALT、AST和肌酐水平差异均无统计学意义,术后两组患者ALT和AST水平均逐渐升高,在术后4 h达到顶峰,之后逐渐下降,各个时间ALT 和AST水平均显著高于同组术前(P<0.05),且D组患者术后不同时间点ALT和AST水平均显著低于C组(P<0.05),而两组患者术后不同时间点肌酐水平差异均无统计学意义(P>0.05)。见表3。


项目D组(n=31)C组(n=31)t值P值ALT(U/L) 术前46.32±12.5445.89±8.63 0.124 0.901 术后4 h351.27±45.74*511.46±56.32*-12.293<0.000 术后24 h200.14±30.89*365.43±11.49*-27.924<0.000 术后48 h145.63±10.26*234.98±20.37*-21.812<0.000 术后72 h85.88±14.83*145.67±31.46*-9.571<0.000AST(U/L) 术前56.69±14.5654.71±10.690.6100.544 术后4 h300.52±16.73*500.39±20.13*-42.516<0.000 术后24 h234.56±24.86*350.76±20.47*-20.090<0.000 术后48 h164.85±18.67*248.75±19.94*-17.101<0.000 术后72 h100.44±20.46*156.39±20.67*-10.711<0.000肌酐(μmol/L) 术前78.69±14.8580.36±20.22-0.3710.712 术后4 h103.56±16.31110.57±20.76-1.5020.138 术后24 h156.34±20.76*160.59±14.58*-0.9330.355 术后48 h73.15±13.2678.49±12.30-1.6440.105 术后72 h76.13±20.0780.32±16.39-0.9000.372
*与术前比较P<0.05
2.3 两组患者术前及术后Th1、Th2、Th17、Treg、Th1/Th2、Th17/Treg细胞数值的比较 C组患者各个时间点Th1、Treg和Th1/Th2百分比均显著低于术前(P<0.05),而Th2、Th17、Th17/Treg百分比均显著高于术前(P<0.05);D组患者各个时间点Th2、Th17和Th17/Treg百分比均显著低于术前(P<0.05),而Th1、Treg、Th1/Th2百分比均显著高于术前(P<0.05);两组患者术前Th1、Th2、Th17、Treg、Th1/Th2、Th17/Treg细胞百分比差异均无统计学意义,C组患者术后各个时间点Th1、Treg和Th1/Th2百分比均显著低于D组(P<0.05),而Th2、Th17和Th17/Treg细胞百分比均显著高于D组(P<0.05)。见表4。
2.4 两组患者术前及术后细胞因子水平的比较 两组患者术前血清IFN-γ、IL-4、IL-17α和 TGF-β水平比较差异均无统计学意义(P>0.05),C组患者术后4、24、48和72 h血清IFN-γ、IL-4、IL-17α较术前相比显著升高(P<0.05),但TGF-β水平较术前显著降低(P<0.05);D组患者术后4、24、48和72 h血清IFN-γ、IL-4、IL-17α和TGF-β均较术前显著升高(P<0.05);D组患者术后4、24、48和72 h血清IFN-γ和TGF-β均显著高于同期C组患者(P<0.05),而IL-4和 IL-17α水平在术后均显著低于同期C组患者(P<0.05)。见表5。
2.5 两组患者发生不良反应的比较 两组患者发生的不良反应均以呕吐、头痛及食欲不振为主,两组不良反应发生率相比差异无统计学意义(P>0.05)。见表6。
3 讨论
机体细胞免疫状态主要由T淋巴细胞水平决定,而T淋巴细胞可分为Th1、Th2、Th17及Treg等细胞亚群,四类T淋巴细胞分泌的主要细胞因子分别为IFN-γ、IL-4、IL-17α和TGF-β[4-5]。不同T淋巴细胞及其分泌的细胞因子与机体免疫监视系统有关,尤其是机体免疫监视系统对肿瘤细胞识别能力的改变[6-7]。正常状态下,Th1/Th2、Th17/Treg细胞比例处于相对平衡状态,而Th1/Th2及Th17/Treg细胞比例失衡与肿瘤的发生发展及远处转移有关[8-9]。杨志刚等[8]报道发现,急性白血病患者存在Th2细胞优势应答现象,Th2细胞数值及其分泌的主要细胞因子IL-4水平同健康对照组显著升高,而Th1细胞分泌的IFN-γ水平显著下降,急性白血病与Th1/Th2细胞比例失衡具有一定关系;郝斌[9]通过检测食管鳞癌患者外周血Th17和Treg细胞比例及细胞因子后发现,食管鳞癌患者外周血中的Th17/Treg比值显著高于健康对照组[(0.35±0.13)%vs(0.19±0.04)%],差异有统计学意义(P<0.05),同时发现存在淋巴结转移患者外周血中的Th17/Treg比值显著高于非淋巴结转移患者,但Th17/Treg比值与肿瘤大小、浸润深度、临床分期无显著相关性。因此,多数肿瘤患者均会出现Th1向Th2及Treg向Th17细胞漂移,机体出现以Th2和Th17细胞因子占主要优势现象,Th1和Treg细胞介导的免疫反应受到抑制,使得机体免疫监视系统对肿瘤细胞的识别调控能力显著下降,最终导致机体的抗肿瘤效应减弱及其肿瘤的生长复发及远处转移。
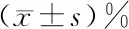

项目D组(n=31)C组(n=31)t值P值Th1 术前0.86±0.320.79±0.171.0760.286 术后4 h0.93±0.14*0.67±0.26*4.902<0.000 术后24 h1.22±0.21*0.62±0.16*12.654<0.000 术后48 h1.42±0.32*0.57±0.25*11.023<0.000 术后72 h1.52±0.17*0.52±0.13*26.017<0.000Th2 术前2.11±0.122.05±0.460.7030.485 术后4 h2.06±0.06*2.76±0.13*27.221<0.000 术后24 h1.96±0.09*3.12±0.41*15.386<0.000 术后48 h1.52±0.11*3.19±0.16*47.888<0.000 术后72 h1.23±0.34*3.45±0.18*32.130<0.000Th17 术前7.43±1.247.73±0.341.6890.09 术后4 h7.29±0.44*8.24±0.13*11.529<0.000 术后24 h6.28±0.43*9.67±1.15*15.373<0.000 术后48 h5.08±0.43*10.14±2.03*13.577<0.000 术后72 h4.28±0.42*12.34±1.78*24.538<0.000Treg 术前13.11±0.5912.98±0.680.8040.425 术后4 h14.24±0.46*9.63±0.18*51.962<0.000 术后24 h15.43±0.28*8.64±0.27*97.182<0.000 术后48 h18.63±0.47*7.56±0.27*113.711<0.000 术后72 h20.46±0.62*6.49±0.24*116.995<0.000Th1/Th2 术前0.41±0.160.42±0.120.8350.407 术后4 h0.45±0.14*0.25±0.04*6.118<0.000 术后24 h0.59±0.17*0.23±0.07*10.902<0.000 术后48 h0.64±0.15*0.18±0.09*14.644<0.000 术后72 h0.69±0.21*0.13±0.04*14.585<0.000Th17/Treg 术前0.56±0.110.49±0.201.7070.089 术后4 h0.51±0.22*0.88±0.16*7.573<0.000 术后24 h0.41±0.05*1.12±0.25*15.505<0.000 术后48 h0.29±0.12*1.56±0.27*23.932<0.000 术后72 h0.20±0.16*1.95±0.36*24.733<0.000
*与术前比较P<0.05
肝癌具体发病机制不清,研究认为Th1/Th2、Th17/Treg细胞比值与肝癌的进展有关。芦峰等[10]发现,肝癌小鼠模型肿瘤组织中IL-4表达水平升高,而IFN-γ的表达水平显著下降,当机体由Th2类细胞向Th1类细胞逆转后,细胞的免疫应答能力增强,同时肿瘤组织的体积也进一步降低,提示肿瘤组织的体积与Th1/Th2平衡可能有关;刘勇等[11]发现,肝癌患者外周血Th17、Treg细胞比例显著高于对照组患者,当沉默IL-17表达后,肝癌细胞的侵袭力也显著下降,这也进一步说明Th17型细胞主导的优势应答可能与肝癌的转移有关。目前,临床上治疗未转移性肝癌仍是以手术切除为主,而手术创伤应激、不同的麻醉药物等会影响机体的免疫功能而导致Th2/Th2、Th17/Treg细胞比例的失衡,最终导致肿瘤的复发与转移[12]。鉴于目前关于右美托咪定对肝癌根治术患者Th1/Th2、Th17/Treg细胞及相关细胞因子水平的影响尚不清楚,本研究通过对肝癌患者围术期临床资料进行调查后发现,与对照组比较,使用右美托咪定后肝癌患者Th1、Treg类细胞比值升高,而Th2和Th17细胞比值降低,Th1/Th2比值显著升高而Th17/Treg比值显著下降,同时在分析4种细胞因子表达水平中也得到类似结果,以上均说明右美托咪定可逆转Th1/Th2和Th17/Treg漂移现象,国内姜慧芳等[13]报道也发现右美托咪定可逆转乳腺癌患者Th1/Th2细胞因子的漂移,与我们结果基本类似。Th1细胞分泌的IFN-γ可激活自然杀伤细胞、巨噬细胞等而介导细胞免疫应答,研究发现当IFN-γ表达上调后,可显著增强肺癌细胞模型的免疫应答[14],我们研究发现,相对于对照组而言,使用右美托咪定后IFN-γ水平在不同时间点均显著升高,而参与多种肿瘤的发生的IL-4也显著升高;同时参与肝癌的发病中的IL-17α术后均显著升高,但均低于同期对照组患者。右美托咪定为一种新型的高选择性肾上腺素α2受体激动剂,其镇静催眠、抗焦虑和镇痛作用与作用于脑干蓝斑区和脊髓的α2受体有关[3],同时右美托咪定能激活巨噬细胞介导细胞免疫反应,提高细胞免疫功能[15];另一方面,手术创伤及麻醉应激均可引起交感神经兴奋产生去甲肾上腺素,可激活或抑制不同类型T淋巴细胞而导致Th1/Th2、Th17/Treg发生漂移[12],而右美托咪定能激活中枢神经系统的α2肾上腺素受体,抑制去甲肾上腺素的分泌而逆转Th1/Th2、Th17/Treg漂移现象[13, 16]。


项目D组(n=31)C组(n=31)t值P值IFN-γ 术前310.59±19.26305.41±25.420.904 0.369 术后4 h452.13±20.44*420.67±16.34*6.693<0.000 术后24 h480.25±18.52*411.51±18.33*14.688<0.000 术后48 h503.54±14.28*389.12±30.48*18.927<0.000 术后72 h562.68±18.49*369.56±31.59*29.376<0.000IL-4 术前235.62±20.46243.48±15.631.7000.091 术后4 h240.69±19.68*295.37±30.46*8.395<0.000 术后24 h256.36±30.55*346.86±33.33*11.145<0.000 术后48 h270.63±25.63*368.97±28.45*14.299<0.000 术后72 h268.69±18.26*350.08±20.02*16.273<0.000IL-17α 术前150.27±14.27145.63±15.231.2380.220 术后4 h163.41±17.77*189.65±17.28*5.894<0.000 术后24 h175.26±16.29*246.38±17.03*16.803<0.000 术后48 h182.13±20.82*279.46±12.65*22.244<0.000 术后72 h176.31±16.88*293.14±22.01*23.451<0.000TGF-β 术前204.26±20.11210.62±17.281.3350.186 术后4 h239.49±27.37*193.17±26.39*6.783<0.000 术后24 h278.36±21.46*184.46±20.40*17.657<0.000 术后48 h300.96±24.67*150.56±35.26*19.459<0.000 术后72 h354.13±25.39*98.79±25.68*39.368<0.000
*与术前比较P<0.05

表6 两组患者不良反应发生率的比较 例(%)
在安全性上,肝癌根治术后不同时间点两组患者ALT和AST水平较术前均显著升高,但使用右美托咪定后ALT和AST与对照组相比显著下降,说明右美托咪定还具有保护肝功能的作用[17],分析肌酐水平两组患者差异均无统计学意义,笔者进一步分析术后两组患者发生的不良反应主要以呕吐、头痛及食欲不振为主,但两组相比差异无统计学意义,说明右美托咪定安全性较高。
综上所述,右美托咪定可改善Th1/Th2、Th17/Treg平衡,提高机体细胞免疫功能,临床安全性尚可,但是仍然需要大样本量的临床研究证实我们的结果。
