三唑醇杀菌剂对雄性丽斑麻蜥性腺系统的对映选择性影响
2020-01-09胡晓李济彤常静郭宝元王会利
胡晓,李济彤,常静,郭宝元,王会利,*
1. 中国科学院生态环境研究中心,北京 100085 2. 中国科学院大学,北京 100049
三唑类杀菌剂广泛应用于农业和人类真菌病防治领域,它们主要通过抑制羊毛甾醇-14-去甲基化酶(CYP51)来阻碍真菌细胞壁的生成,进而产生抑菌效果[1]。三唑类杀菌剂是世界上使用量最多,应用最广泛的杀菌剂之一,然而经过农药喷洒、雨水冲刷和植物根系转移等作用后,三唑类杀菌剂会进入水、土壤和农作物等多种环境介质中,对环境中的大量非靶标生物造成威胁[2]。
许多三唑类杀菌剂属于手性农药,它们通常含有一个或多个手性中心,从而拥有多个对映体。在非手性环境中,手性农药的不同对映体具有相同的物理和化学性质,然而,在生物体内,不同对映体的生物活性往往具有很大差异,导致不同对映体在生物体内的代谢、分布和毒性表现出对映选择性[3-4]。三唑醇(triadimenol, TN)是一种典型的手性三唑类杀菌剂,它含有2个手性中心,包括2对异构体,对映体A和对映体B,其中,对映体A包括A1(R,S)和A2(S,R),对映体B包括B1(R,R)和B2(S,S)。研究发现,三唑醇是一种潜在的内分泌干扰物质,它能够干扰多种生物体性腺系统的稳定。例如,三唑醇暴露后的斑马鱼体内性激素水平失衡,子代数量显著减少,三唑醇表现出明显的生殖毒性[5]。此外,体内和体外实验结果均表明,三唑醇能够抑制人体内芳香化酶(CYP19)的活性,由于芳香化酶主要负责雄激素向雌激素的转化,因此,三唑醇暴露会导致体内雌激素水平出现异常[6-7]。目前,关于三唑醇对性腺系统的影响主要针对外消旋体,缺乏对映体层面的研究。然而,已有的研究表明,三唑醇的4种对映体在土壤、作物、微生物和鱼中的吸收、转化和降解具有明显的对映选择性,并且A2对映体的杀菌活性是其他对映体的1 000倍以上,说明三唑醇对映体在生物体内的活性具有明显差异[8-9]。因此,有必要从对映体层面研究三唑醇对性腺系统的干扰效应,考察其外消旋体与不同对映体之间的差异。
近年来,爬行动物的数量在全世界范围内出现了下降,其原因主要包括全球气候变化、栖息地减少和环境污染等[10]。农药作为陆地生态系统中使用量最大、使用时间最长的化学品,被认为是导致爬行动物数量下降的一个重要原因[11]。目前,针对爬行动物的毒理学研究仍然较少,在大部分风险评估中往往由鸟类数据代替。蜥蜴是爬行动物中种群数量最大的物种,占据了爬行动物种群数量的60%,它们终生生活在陆地环境中,栖息地广泛,暴露于环境污染物的可能性很高,被认为是评价环境污染物的良好模型[12-13]。丽斑麻蜥是中国的本土物种,主要分布于扬子江北部地区。由于其体型小,在实验室中易于饲养,在许多研究中已经被选为实验动物来进行爬行动物的生态毒理学研究[14-15]。
为了探究三唑醇及其对映体对丽斑麻蜥性腺系统的影响,本研究中将成年雄性丽斑麻蜥分别暴露于三唑醇外消旋体和4种对映体。暴露28 d后测定了性腺中雌雄激素合成相关基因的转录水平和血液中雌雄激素的含量,并记录了实验过程中蜥蜴体重的变化和性腺体细胞指数,从对映体层面揭示了三唑醇对蜥蜴性腺系统的内分泌干扰效应,为评价手性三唑类杀菌剂对爬行动物的生态毒理学效应提供了重要依据。
1 材料与方法(Materials and methods)
1.1 化学品与试剂
三唑醇外消旋体(纯度>98.9%)购自Dr. Ehrenstorfer公司(奥格斯堡,德国),三唑醇外消旋体及4种对映体保存在甲醇(分析纯)中,4 ℃避光储存。所有的化学试剂,包括甲醇、乙醇、异丙醇、三氯甲烷和正己烷(分析纯),购自迪玛科技有限公司(北京)。
1.2 三唑醇对映体的分离和制备
采用菲罗门Lux Cellulose-1手性柱(250 mm×4.6 mm,粒径5 μm)在安捷伦1260高效液相色谱上(HPLC)分离三唑醇对映体。紫外检测波长为225 nm,流动相组成为甲醇和水(70∶30,V/V),进样量为20 μL,流速为1.5 mL·min-1,根据紫外信号手动收集4种对映体。依据已有的研究,4种对映体的流出顺序为A2、A1、B2和B1[16]。经检验,分离后4种对映体的纯度均大于96%。将分离后的4种对映体保存在甲醇中,4 ℃避光保存。
1.3 丽斑麻蜥的饲养
实验室蜥蜴生活在5 m×1.2 m×0.4 m的玻璃培养箱中,底部覆有10 cm厚的细沙土。每个玻璃培养箱配有6个紫外灯,玻璃箱的温度控制在25~30 ℃,湿度控制在30%~40%。蜥蜴每天喂食活的黄粉虫(Tenebriomolitor),每2天洒一次水,清理玻璃箱中的排泄物。选择健康、性成熟的成年(3~4 g,2~3岁)雄性丽斑麻蜥,实验开始前将所选蜥蜴转移至50 cm×50 cm×40 cm的塑料培养箱中,在相同条件下培养适应2周。
1.4 暴露实验
目前缺乏三唑醇对爬行动物的毒理学数据,而鸟类一般作为爬行动物风险评估的替代物种,Hao等[17]在腈菌唑的毒性研究中认为,鸟类LD50的5%可作为慢性暴露浓度,也是丽斑麻蜥的敏感浓度,能够引起其明显的生理反应。此外,Wang等[18]通过亚慢性暴露实验(14 d)得出三唑酮对丽斑麻蜥的最高非致死剂量为200 mg·kg-1bw;Li等[19]将丽斑麻蜥暴露于100 mg·kg-1bw三唑酮21 d,未发现丽斑麻蜥出现明显的致病和致死效应。由于三唑醇是三唑酮在生物体内的代谢物,其毒性与三唑酮相近,因此,选择三唑醇对鸟类LD50的5%,即100 mg·kg-1bw作为三唑醇暴露浓度。
将所有蜥蜴(18只)随机分为6个组(每组3只),包括一个对照组和5个暴露组。5个暴露组中,蜥蜴每天分别经口暴露100 mg·kg-1bw外消旋体和4种对映体。暴露28 d后将蜥蜴于二氧化碳培养箱中安乐死,立即从颈部收集蜥蜴的血液,迅速离心(1 000 g、5 min、4 ℃)后取上清液,于-80 ℃避光保存。提取实验蜥蜴的睾丸,用生理盐水冲洗干净后擦干,称重后冻存于-80 ℃冰箱。
1.5 总RNA提取和cDNA合成
使用TRNzol A+试剂(北京天根生化科技有限公司)遵照操作规程提取性腺组织中的总RNA,利用Nano-drop-2000分光光度计(Thermo Fisher Scientific, USA)测定所得RNA的浓度和纯度。使用Fastking RT试剂盒(含gDNase)(北京天根生化科技有限公司),对2 μg RNA进行反转录,反应体系为20 μL。首先将RNA在冰上解冻,依次加入5g DNA buffer(2 μL)、FQ-RT Primer Mix(2 μL)、FastKing RT Enzyme Mix(1 μL),加入RNase-Free ddH2O(5 μL)得到10 μL的反转录反应体系混合液,然后将混合液加入到gDNA去除反应体系(10 μL)中,充分混匀。依次在42 ℃条件下孵育15 min,95 ℃条件下孵育3 min,得到的cDNA保存在-20 ℃冰箱中。
1.6 实时定量PCR
使用Talent qPCR PreMix(SYBR Green)(北京天根生化科技有限公司)试剂盒和MX3005P型荧光定量PCR仪(Stratagene, USA)对性腺中性激素合成相关基因进行实时定量PCR,相关基因的引物序列均来源于美国国家生物技术信息中心(NCBI)数据库。采用两步法PCR反应程序进行反应,首先在95 ℃下预变性3 min,PCR反应阶段首先在95 ℃、5 s条件下变性,最后于60 ℃、15 s条件下退火和延伸,反应经历40个循环后终止。对每个基因的扩增进行熔解曲线分析,保证基因的特异性扩增(熔解曲线仅出现单一峰)。
1.7 性激素含量和性腺体细胞指数测定
将离心后的血清在常温下解冻后搅拌混匀,使用酶联免疫(ELISA)试剂盒(武汉伊莱瑞特生物科技有限公司)测定血清中的雌二醇(E2)和睾酮(T)含量。试剂盒测定雌二醇和睾酮的灵敏度分别为25 pg·mL-1和0.1 ng·mL-1,组内和组间变异系数均小于15%。
蜥蜴性腺体细胞指数(GSI)的计算公式为:GSI(%)=性腺重量(g)/蜥蜴体重(g)×100%
1.8 数据分析
采用Origin Pro 9.1软件进行数据分析,所有数据均以平均值±标准差的形式表示。采用独立样本T检验(Independent T-test)方法分析暴露组和对照组之间的差异,*P<0.05表示具有统计学差异。
2 结果(Results)
2.1 蜥蜴体重及性腺体细胞指数
对照组和暴露组的体重变化和28 d时性腺体细胞指数(GSI)如表1所示。所有蜥蜴的体重均维持在3~4 g之间,暴露期间无个体死亡,每个组的体重都没有出现明显变化。与对照组相比,外消旋体和A1暴露组的GSI明显降低,而A2、B1和B2暴露组的GSI相比于对照组无明显差异。
2.2 性激素合成相关基因的表达
三唑醇外消旋体和4种对映体暴露28 d后,通过实时定量PCR测定了丽斑麻蜥性腺中性激素合成相关基因的相对mRNA表达量(图1)。对映体A1和A2暴露后,性腺中cyp19a、cyp17、cyp11a和hsd-17β的表达都受到明显抑制(0.25~0.64倍)。A1暴露组中hsd-3β基因的表达量也明显降低(0.55倍),而A2暴露组中hsd-3β的表达量无明显变化。B1对映体暴露后,cyp19a和hsd-3β的表达量显著上升(分别为1.7倍和3.1倍),而cyp17、cyp11a和hsd-17β的表达没有明显变化。B2对映体能够显著抑制cyp19a、cyp11和hsd-17β的表达(0.52~0.77倍),同时会导致hsd-3β基因的表达量增加(3.5倍)。外消旋体对cyp19a、cyp17、cyp11a、hsd-3β和hsd-17β基因都有不同程度的抑制作用(0.17倍~0.78倍)。此外,外消旋体和对映体A1、A2和B2都抑制了性腺中erα基因的表达,对映体A1、A2和B2还抑制了ar基因的表达,而B1暴露后性腺中的erα和ar基因表达都没有显著变化。通过外消旋体与4种对映体对性腺系统基因表达谱的相关性分析发现,外消旋体对性腺系统相关基因的影响仅与A1具有较强的相关性(P<0.05)(表2)。

表1 三唑醇28 d暴露期间丽斑麻蜥体重变化及性腺体细胞指数(GSI)Table 1 The change of body weight and gonad somatic index (GSI) of Eremias argus during the 28 d exposure to triadimenol racemate and its four enantiomers
注:A1、A2、B1和B2分别表示(R,S)、(S,R)、(R,R)和(S,S);数据均以平均值±标准差的形式表示(n=3),*表示与对照组具有显著性差异(P<0.05)。
Note: A1, A2, B1 and B2 represent (R,S), (S,R), (R,R) and (S,S) respectively; the data was expressed as mean±S.D. (n=3); *indicates significant difference compared with the control (P<0.05).
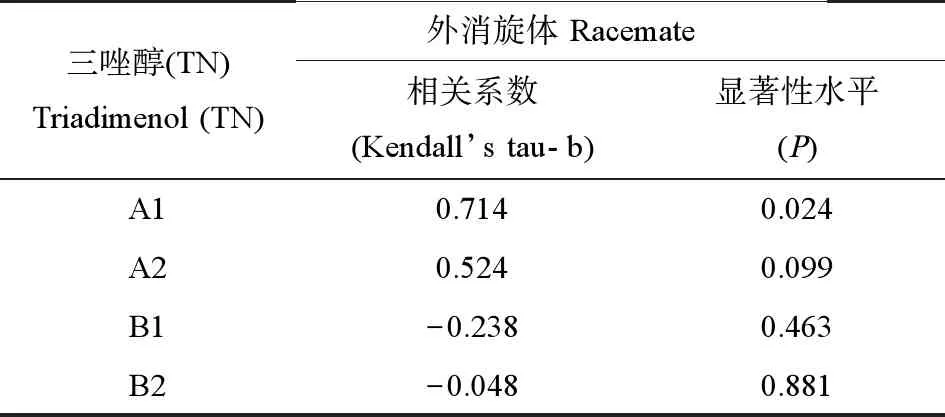
表2 外消旋体与4种对映体对性腺中激素合成相关基因表达量的相关性分析Table 2 The correlation analysis of steroidogenic-related gene expression profile between racemate and each enantiomer
2.3 血液中性激素水平
三唑醇外消旋体和4种对映体暴露28 d后,对照组和暴露组丽斑麻蜥血液中的雌雄激素含量如图2所示。与对照组相比,A1、A2和B2暴露后血液中雌雄激素水平都出现明显下降,但是相比于A1和A2,B2暴露对雌雄激素水平的影响更小。B1对映体暴露后蜥蜴体内雌雄激素的含量都没有出现显著变化。外消旋体暴露后,蜥蜴体内雄激素的含量出现明显下降而雌激素水平没有变化。
3 讨论(Discussion)
体重和组织体细胞指数(TSI)是从个体和组织水平预测机体毒性的有效指标[20]。三唑醇外消旋体和4种对映体(100 mg·kg-1bw)暴露后,各个组中蜥蜴的体重都没有出现显著变化,说明在本实验条件下三唑醇对丽斑麻蜥的生长没有造成明显的影响。外消旋体和A1对映体暴露后,蜥蜴性腺体细胞指数(GSI)明显低于对照组,而A2、B1和B2暴露后的GSI没有显著变化,说明外消旋体和A1对性腺组织的毒性可能高于其他对映体。

图1 三唑醇外消旋体及对映体(100 mg·kg-1 bw)分别暴露28 d后丽斑麻蜥性腺中激素合成相关基因的相对mRNA表达量注:*表示与对照组相比具有显著性差异(P<0.05)。Fig. 1 Relative mRNA expression of steroidogenic-related genes in gonads after exposure to the racemate and its four enantiomers (100 mg·kg-1 bw) for 28 d in male lizardsNote: *indicates significant difference compared with the control (P<0.05).
一般来说,干扰性腺中性激素合成相关酶的活性或者竞争性结合体内雌雄激素受体是外源性物质干扰性腺系统稳定的最主要的2种方式[21-22]。性腺中性激素合成路线如图3所示,CYP11A酶首先将胆固醇(cholesterol)转化为孕烯醇酮(pregnenolone),这是体内所有固醇类激素合成的第一步和限速步骤[23]。随后在HSD-3β和CYP17的催化下孕烯醇酮被转化为雄烯二酮[24]。没有活性的类固醇经HSD-17β羟基化后被激活,CYP19A酶催化性腺中的T转化为E2[25-26]。雌激素受体(ER-α)和雄激素受体(AR)都属于配体激活型核受体超家族,它们与雌/雄激素结合后进入细胞核,与目标基因的雌/雄激素响应元件(ERE/ARE)结合,调节它们的转录和表达。雌/雄受体介导的信号通路对性腺系统的生长和功能具有重要作用[27]。本实验中,A1和A2对映体暴露后,性腺中性激素合成基因(cyp11a、cyp17、cyp19a、hsd-3β和hsd-17β)的表达量都出现显著下降,性腺中雌雄激素的响应(erα和ar)明显降低,同时蜥蜴血液中的睾酮(T)和雌二醇(E2)水平也显著低于对照组,这说明A1和A2对映体能够阻碍蜥蜴体内性激素的合成。B2对映体同样能够抑制性腺中主要的性激素合成基因(cyp11、cyp19a和hsd-17β)的表达,并且血液中雌雄激素含量也明显低于对照组。但是与A1和A2暴露组相比,B2对蜥蜴性激素合成相关基因的抑制作用更弱,对性腺系统的毒性更低。T和E2是生物体内固醇激素的主要存在形式,它们主要由性腺中的间质细胞产生,并通过血液循环运送至各个组织器官。研究表明,T和E2不仅影响性腺组织的发育和功能,还对肝、心脏、肌肉和大脑等具有重要的调节作用[24]。因此,血液中T和E2的含量通常被作为衡量性腺系统稳定的重要指标。有报道指出,三唑类物质(l,l-di(4-fluorophenyl)-2-(1,2,4-triazol-1-yl)-ethanol)染毒小鼠后,小鼠体内的固醇类激素合成酶被抑制,E2水平下降,小鼠出现性腺发育迟缓症状[28]。此外,丙环唑(propiconazole)暴露后的成年黑头呆鱼体内cyp19a、cyp11和cyp17的表达量也明显下降,并出现产卵量减少、性腺重量增加等现象[29]。因此,本实验中三唑醇A1、A2和B2对映体对蜥蜴性腺的影响也可能会导致机体出现生殖和发育毒性,但是由于实验周期较短(28 d),实验过程中没有观察到蜥蜴出现明显的生理学异常。B1对映体暴露后,性腺中hsd-3β和cyp19a的表达量显著增加,这种变化会增加雄激素的合成以及雄激素向雌激素的转化,这可能是导致性腺中雌激素响应(erα)上升的原因。但B1暴露后蜥蜴体内的雌雄激素水平与对照组无明显差异,这可能是因为在正反馈机制的调节下,激素的降解速率增加,体内激素水平保持相对稳定。相似的调节机制在其他三唑类物质的研究中也出现过。酮康唑暴露后黑头呆鱼血液中E2水平出现短时间下降(8 d),并在暴露后21 d恢复至正常水平[30]。与B1相比,A1、A2和B2对映体对性腺系统的毒性超出了机体的补偿机制,体内的激素含量低于正常浓度,这说明在100 mg·kg-1bw浓度下,A1、A2和B2长期暴露(28 d)后能够对蜥蜴的性腺系统造成不可逆转的伤害。已有的研究指出,A2对映体的杀菌活性是其他对映体的1 000倍以上,这说明三唑醇对映体对蜥蜴性腺的毒性和杀菌活性具有不一致性,而Li等[31]将三唑醇染毒大型溞后发现A2对映体的毒性高于A1,即杀菌活性和水生毒性具有一致性,这表明,三唑醇在不同物种中的代谢模式不同,导致不同对映体的生物毒性有差异。从上述结果可以看出,三唑醇4种对映体对丽斑麻蜥性腺系统的影响具有明显的对映选择性,类似的对映选择性也存在于其他手性物质中。Song等[32]比较了9种手性农药与ER和甲状腺激素受体(TR)结合力的大小,发现其中7种手性农药与ER的结合具有对映选择性,2种手性农药与TR的结合具有对映选择性。Wang等[33]将联苯菊酯(bifenthrin)的不同对映体染毒斑马鱼后发现,S-bifenthrin具有比R-bifenthrin更高的雌激素活性。Zhao等[34]通过分子模拟实验进一步揭示了联苯菊酯不同对映体与ER在氢键和盐桥形成位点上的差异,这导致它们与ER结合力的不同。因此,三唑醇不同对映体之间结构的差异可能导致它们与体内相关酶和受体的亲和力不同,从而具有不同的生物活性和毒性。

图2 三唑醇外消旋体及4种对映体暴露28 d后丽斑麻蜥体内睾酮(T)和雌二醇(E2)水平注:*表示与对照组相比具有显著性差异(P<0.05)。Fig. 2 The plasma concentration of testosterone (T) and estradiol (E2) after exposure to triadimenol racemate and its four enantiomers for 28 dNote: *indicates significant difference compared with the control (P<0.05).

图3 性腺中睾酮和雌二醇合成路线图Fig. 3 The synthesis of testosterone and estradiol in lizard gonads
外消旋体暴露后蜥蜴GSI显著降低,性腺中性激素合成相关基因的表达受到明显的抑制作用,而相关性分析发现,外消旋体与A1对映体对性腺中基因的影响具有较强的相关关系(0.714,P<0.05),这说明A1可能是外消旋体中产生生物毒性的主要成分。综上,三唑醇外消旋体及其对映体对丽斑麻蜥性腺系统的影响具有明显的对映选择性,因此,从手性层面研究手性农药的生态毒理学效应具有十分重要的意义。
