碱蓬内生真菌GMF19次级代谢产物的研究
2020-01-09牛赡光张淑静马一茗李晓梦桑志旻杜丰玉
牛赡光,张淑静,马一茗,李晓梦,桑志旻,杜丰玉*
1山东省林业科学研究院森林保护与生物药物研究所,济南 250014;2青岛农业大学化学与药学院,青岛 266109
碱蓬(Suaedaglauce)为藜科(Chenopodiaceae)碱蓬属(Suaeda),属于典型的盐生植物。碱蓬既可生长在海水经常浸没的潮间带,也能生长在内陆盐碱地区。潮间带地区生长的植株在整个生长期,地上部分一般为紫红色,而盐碱地区则呈绿色。前者受海洋高盐、低温等生态环境影响,而后者受盐碱及干旱的影响[1]。碱蓬内生真菌指那些在其生活史中的全部或某段时期生活在宿主体内,但不引起宿主明显病害症状的真菌。因为碱蓬特殊的生存环境,其内生真菌往往具有独特的次生代谢途径与遗传背景,代谢产物化学及生物活性多样性也因此较为丰富[2- 4]。本文报道从采自黄河入海口潮间带湿地的碱蓬根茎中分离得到一株内生真菌TalaromycespinophilusGMF19,并从其发酵产物中分离鉴定了11个化合物。除化合物2之外,其余10个化合物均为首次从该属真菌中分离得到。
1 材料与方法
1.1 仪器与试剂
Bruker Avance III 500 MHz 核磁共振波谱仪(布鲁克公司,德国);Agilent 1290 Infinity /6460 UHPLC/MS/MS质谱仪(安捷伦公司,美国);Dionex Ultimate 3000 高效液相色谱仪(戴安公司,美国);Sinochrom ODS- BP,10 mm×250 mm,5 μm半制备柱(大连依利特分析仪器有限公司,中国);真菌基因组DNA抽提试剂盒(Ezup柱式,100 Preps,上海生工生物工程股份有限公司);所用有机溶剂为重蒸的工业级溶剂。
1.2 菌株发酵
1.2.1 菌株
菌株GMF19从采自黄河入海口潮间带湿地的碱蓬根茎中分离得到,保存于青岛农业大学化学与药学院新农药创制研究所,以琼脂-麦芽膏培养基4 ℃保存。应用真菌基因组抽提试剂盒提取菌株GMF19的DNA,PCR扩增其r DNA ITS序列并测序,测序结果通过BLAST程序在NCBI上进行相似性序列分析。菌株GMF19与Talaromycespinophilus(GenBank accession number:KJ207414.1)的相似度为99%,因此初步鉴定该菌株为TalaromycespinophilusGMF19。
1.2.2 发酵培养
菌株采用大米培养基(大米70 g、玉米浆0.15 g、蛋白胨0.45 g、人工海水150 mL,置于1 L三角烧瓶中)发酵,共接种50瓶。28 ℃静止发酵30天。
1.3 提取与分离
培养基以乙酸乙酯超声提取3次,合并提取液,减压蒸干得到乙酸乙酯提取物25.1 g。将其应用减压硅胶柱层析分离,以石油醚- 乙酸乙酯及二氯甲烷- 甲醇体系进行梯度洗脱,经薄层层析色谱检测,合并为10个组分(Fr.1~10)。Fr.3组分经Sephadex LH- 20(二氯甲烷∶甲醇=1∶1)凝胶柱色谱分离得到化合物2(5.2 mg)。Fr.4组分经反相硅胶柱色谱梯度洗脱(甲醇- 水体系)得到4个组分(Fr.4- 1~4),其中Fr.4- 4组分经Sephadex LH- 20(甲醇)凝胶柱色谱得到化合物7(10.3 mg)。Fr.5及Fr.6组分同样经反相硅胶柱色谱梯度洗脱(甲醇- 水体系),分别得到5个组分(Fr.5- 1~5及Fr.6- 1~5),其中Fr.5- 1组分经半制备高效液相色谱法(15%乙腈- 水,3 mL/min,230 nm)得到化合物4(30.2 mg,tR=6.4 min)、5(43.8 mg,tR=13.2 min)及6(3.1 mg,tR=10.6 min);Fr.5- 2组分经制备薄层层析色谱法(三氯甲烷- 甲醇- 甲酸=30∶1∶0.05)得到化合物8(12.3 mg)及9(6.4 mg)。而Fr.6- 1组分经半制备高效液相色谱法(15%甲醇- 水,3 mL/min,230 nm)得到化合物10(32.5 mg,tR=6.1 min)与11(17.2 mg,tR=12.9 min),组分Fr.6- 2及6- 3分别经Sephadex LH- 20(甲醇)凝胶柱色谱及制备薄层层析色谱法(三氯甲烷∶甲醇=20∶1)得到化合物3(14.2 mg)及1(4.5 mg)。
1.4 活性测定
1.4.1 抑制植物病原真菌活性
采用96孔板微量稀释法测定化合物对苹果腐烂病菌(Valsamali)、苹果轮纹病菌(Physalosporapiricola)、苹果炭疽病菌(Colletotrichumgloeosporioides)及小麦纹枯病菌(Rhizoctoniacerealis)等4种植物病原真菌的抑制活性[5]。化合物以50% DMSO水溶液溶解得到浓度为10 mg/mL的母液,并依次二倍稀释至不同浓度的溶液备用。供试植物病原真菌接种于PDA培养基表面,28 ℃培养5~7天;无菌0.85% NaCl溶液洗涤并刮下菌丝,调至0.5麦氏浊度(相当于1.5×108CFU/mL),进一步以无菌PDB培养基稀释备用。分别吸取5 μL化合物溶液及95 μL菌悬液至96孔板,震荡混匀,28 ℃培养5天,观察孔内菌丝生长情况,能够在小孔内完全抑制指示菌生长的样品溶液即具有抗菌活性,并记录最小抑制浓度。
1.4.2 卤虫致死活性
卤虫致死活性以卤虫(brine shrimp)为试虫,具有操作简便、消耗样品量少等特点,可用于农用杀虫活性快速初筛[6]。化合物以DMSO溶解得到浓度为4 mg/mL的母液,并依次二倍稀释至不同浓度的溶液备用。分别吸取5 μL化合物溶液及195 μL人工海水(约含卤虫20只左右)至96孔板,28 ℃恒温生化培养箱中培养24 h,在双目解剖镜下观察卤虫的存活状况并计算致死率与半数致死浓度LD50值。卤虫致死活性用校正死亡率表示,计算公式如下:
校正死亡率=(对照组存活率-处理组存活
率)/对照组存活率×100%
2 实验结果
2.1 结构鉴定
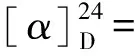
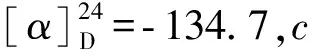
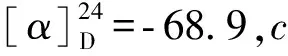
化合物4白色粉末(甲醇);1H NMR (MeOD)δH:8.03 (1H,s,H- 1);6.35 (1H,s,H- 4);4.30 (2H,s, H- 6);13C NMR (MeOD)δC:139.7 (C- 1,CH);146.2 (C- 2,C);174.4 (C- 3,C);110.3 (C- 4,CH);168.5 (C- 5,C);60.0 (C- 6,CH2);ESI- MS:m/z143.0 [M + H]+。其波谱数据与文献[8]报道基本一致,鉴定其为kojic acid。
化合物5白色粉末(三氯甲烷);1H NMR (CDCl3)δH:7.87 (1H,s,H- 1);6.52 (1H,s,H- 4);4.93 (2H,s, H- 7);2.17 (3H,s, H- 8);13C NMR (CDCl3)δC:138.4 (C- 1,CH);146.0 (C- 2,C);174.1 (C- 3,C);111.4 (C- 4,CH);169.9 (C- 5,C);162.8 (C- 6,C);61.4 (C- 7,CH2);20.6 (C- 8,CH3);ESI- MS:m/z185.3 [M + H]+。其波谱数据与文献[10]报道基本一致,鉴定其为5- hydroxy- 4- oxo- 4H- pyran- 2- ethyl formate。
化合物6白色粉末(甲醇);1H NMR (MeOD)δH:8.02 (1H,s,H- 1);6.50 (1H,s,H- 4);4.43 (2H,s, H- 6);3.76 (3H,s, H- 7);13C NMR (MeOD)δC:139.1 (C- 1,CH);148.3 (C- 2,C);175.3 (C- 3,C);110.1 (C- 4,CH);169.4 (C- 5,C);59.7 (C- 6,CH2);55.7 (C- 7,CH3);ESI- MS:m/z157.1 [M + H]+。其波谱数据与文献[11]报道基本一致,鉴定其为kojic acid monomethyl ether。
化合物7白色粉末(甲醇);1H NMR (MeOD)δH:6.12 (1H,s,H- 2);6.12 (1H,s,H- 4);6.07 (1H,s, H- 6);2.43 (2H,t,J=7.7 Hz, H- 7);1.55 (2H,m, H- 8);1.28 (18×2H,m, H- 9~H- 26);0.89 (3H,t,J=6.8 Hz, H- 27);13C NMR (MeOD)δC:158.4 (C- 1,C);106.8 (C- 2,CH);144.9 (C- 3,C);106.8 (C- 4,CH);158.4 (C- 5,C);100.0 (C- 6,CH);35.7 (C- 7,CH2);31.2 (C- 8,CH2);29.2 (C- 9,CH2);29.6 (C- 10~23,CH2);29.2 (C- 24,CH2);31.8 (C- 25,CH2);22.5 (C- 26,CH2);13.5 (C- 27,CH3);ESI- MS:m/z405.1 [M + H]+。其波谱数据与文献[12]报道基本一致,鉴定其为5- n- heneicosylresorcinol。
化合物8白色粉末(甲醇);1H NMR (MeOD)δH:7.11 (1H,d,J=1.9 Hz, H- 2);6.97 (1H,dd,J=8.2,2.0 Hz, H- 5);6.78 (1H,d,J=8.1 Hz, H- 6);7.33 (1H,d,J=15.9 Hz, H- 7);6.34 (1H,d,J=15.9 Hz, H- 8);3.88 (3H,s, COCH3);13C NMR (MeOD)δC:127.9 (C- 1,C);114.9 (C- 2,CH);147.7 (C- 3,C);147.8 (C- 4,C);122.1 (C- 5,CH);121.3 (C- 6,CH);139.9 (C- 7,CH);109.8 (C- 8,CH);174.9 (C- 9,CO);55.0 (C- 10,COCH3);ESI- MS:m/z217.1 [M + Na]+。H- 7与H- 8的耦合常数为15.9 Hz,表明C7- C8双键为E构型;此外,其波谱数据与文献[13]报道基本一致,鉴定其为caffeic acid methyl ester。
化合物9白色粉末(甲醇);1H NMR (MeOD)δH:7.11 (1H,d,J=1.9 Hz, H- 2);6.97 (1H,dd,J=8.2,1.9 Hz, H- 5);6.77 (1H,d,J=8.1 Hz, H- 6);7.32 (1H,d,J=15.9 Hz, H- 7);6.34 (1H,d,J=15.9 Hz, H- 8);13C NMR (MeOD)δC:127.9 (C- 1,C);114.9 (C- 2,CH);147.6 (C- 3,C);147.8 (C- 4,C);122.2 (C- 5,CH);121.3 (C- 6,CH);139.9 (C- 7,CH);109.8 (C- 8,CH);174.9 (C- 9,CO);ESI- MS:m/z180.0 [M + H]+。H- 7与H- 8的耦合常数为15.9 Hz,表明C7- C8双键为E构型;此外,其波谱数据与文献[14]报道基本一致,鉴定其为(E)- caffeamide。
化合物10白色粉末(甲醇);1H NMR (MeOD)δH:4.88 (2H,s,H- 7);4.84 (2H,s,H- 8);1.92 (3H,s,H- 9);13C NMR (MeOD)δC:108.8 (C- 1,C);144.5 (C- 2,C);133.1 (C- 3,C);138.2 (C- 4,C);116.2 (C- 5,C);129.0 (C- 6,C);73.1 (C- 7,CH2);72.3 (C- 8,CH2);12.7 (C- 9,CH3);ESI- MS:m/z201.3 [M + H]+。其波谱数据与文献报道[15]基本一致,鉴定其为2,3,4- trihydroxy- 6- (hydroxymethyl)- 5- methylbenzylalcohol。
化合物11白色粉末(甲醇);1H NMR (MeOD)δH:7.07 (1H,s, H- 2);7.07 (1H,d,J=7.9 Hz, H- 4);6.99 (1H,ddd,J=7.9,6.9,1.0 Hz, H- 5);7.54 (1H,m, H- 6);7.33 (1H,d,J=8.1 Hz, H- 7);2.93 (3H,t,J=7.4 Hz, H- 8);3.46 (3H,t,J=7.4 Hz, H- 9);1.92 (3H,s, H- 11);13C NMR (MeOD)δC:122.0 (C- 2,CH);110.8 (C- 3,C);127.4 (C- 3a,C);117.8 (C- 4,CH);118.1 (C- 5,CH);120.9 (C- 6,CH);111.9 (C- 7,CH);136.8 (C- 7a,C);24.8 (C- 8,CH2);40.2 (C- 9,CH2);171.9 (C- 10,C);21.2 (C- 11,CH3);ESI- MS:m/z225.1 [M + Na]+。其波谱数据与文献[16]报道基本一致,鉴定其为Nb- acetyltryptamine。
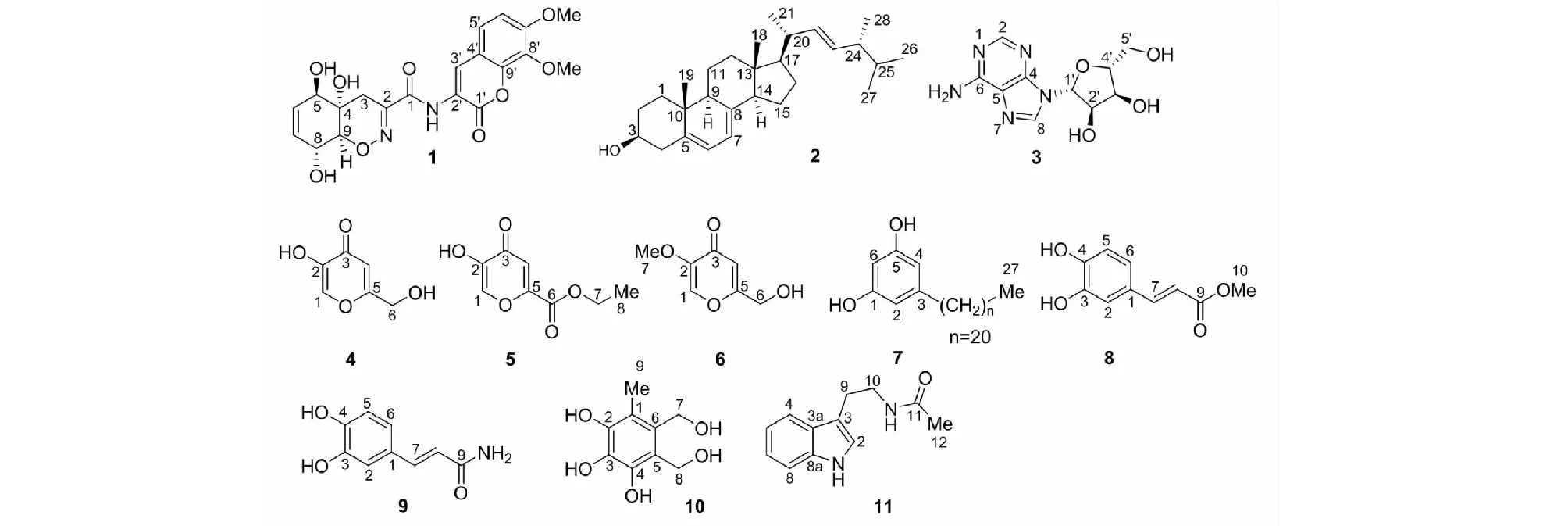
图1 化合物1~11的化学结构Fig.1 Chemical structures of compounds 1- 11
2.2 活性测定
化合物1~11的抑制植物病原真菌及卤虫致死活性测定结果见表1。可见,化合物2对四种供试植物病原真菌都具有抑制活性,尤其对苹果炭疽病菌的MIC为32 μg/mL,略高于阳性对照多菌灵;化合物7对苹果腐烂病菌和小麦纹枯病菌病菌的MIC为32和64 μg/mL;此外,化合物3及5也对两种供试菌表现出抑制活性。γ- 吡喃酮类化合物4~6具有不同程度的卤虫致死活性,尤其化合物4的LD50值仅为7.4 μg/mL,略强于阳性对照秋水仙碱(LD50值为8.5 μg/mL);初步的构效关系分析表明,γ- 吡喃酮类化合物的卤虫致死活性可能与其2- OH及5- CH2OH取代基有关。此外,化合物1也表现中等程度的卤虫致死活性。

表1 化合物1~11的活性测定结果
3 结论
因为碱蓬高盐碱的独特生存环境,其内生真菌具有丰富的化学及生物活性多样性。本论文从碱蓬内生真菌TalaromycespinophilusGMF19发酵产物中分离鉴定了11个化合物,结构类型包括修饰二肽类(1)、甾醇类(2)、腺苷类(3)、γ- 吡喃酮类(4~6)及芳香族衍生物(7~11);化合物2、3、5与7对至少2种供试植物病原真菌具有抑制活性,而化合物1及4~6具有卤虫致死活性,其中4的LD50值仅为7.4 μg/mL。本研究丰富了碱蓬内生真菌的代谢产物化学多样性,并为其在农业领域的进一步开发利用奠定了基础。
