11种食药同源植物提取物对果蔬常见腐败菌的抑菌活性研究
2020-01-09郭俊花张增帅成少宁
郭俊花,张增帅,马 欣,成少宁
运城职业技术学院健康学院,运城 044000
果蔬采摘后易受到微生物侵染而腐败,造成巨大的资源浪费和经济损失。目前主要使用化学防腐剂(如仲丁胺、扑海因、特克多、抗菌灵等)来控制果蔬腐败,但化学防腐剂对人体具有一定危害性,且残留期较长[1]。因此,绿色、安全、有效的天然果蔬防腐剂的开发已成为果蔬保鲜领域的研究热点。
我国药用植物资源丰富。许多药用植物中的功能成分,如黄酮、生物碱、挥发油、酚类、皂素类等具有较好的抑菌和杀菌作用[2]。研究证明,利用药用植物提取液对果蔬具有良好的防腐保鲜作用。Li等[3]以芒果致腐菌为抑菌对象,研究了30种植物提取物的抑菌效果,结果表明丁香、金银花等对褐色蒂腐菌和胶孢炭疽菌均有抑菌作用。Zhang等[4]研究了甘草、肉桂、高良姜等7种药食两种植物对李果实常见致腐真菌的抑菌效果,发现甘草、肉桂提取液联合使用对褐腐病菌抑菌效果最强。She等[5]对60种食药两用中药进行了抗菌防腐作用研究,结果表明丁香、花椒、高良姜表现出强的抗真菌作用,且高良姜具有较广的抗菌菌谱。本研究以天麻、莱菔子、桔梗、葛根、覆盆子、金银花、山茱萸、白芷、荷叶、高良姜、花椒共11种食药同源植物为供试材料,从中筛选出对果蔬常见腐败菌抑菌效果较好的植物,并以樱桃番茄为例对抑菌效果进行了实物验证。本研究提高了食药同源植物的开发利用价值,并可为天然果蔬防腐剂的研究和开发提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
天麻、莱菔子、桔梗、葛根、覆盆子、金银花、山茱萸、白芷、荷叶、高良姜购于山西临猗百草堂医药有限公司;花椒购于运城美特好超市。樱桃番茄购于水果市场,大小均一,无烂果。11种供试植物所属科目及部位见表1。

表1 供试食药同源植物
1.1.2 供试菌种
扩展青霉(Penicilliumexpansum)、链格孢(Alternariaalternata)、灰葡萄孢(Botrytiscinerea)购于中国普通微生物菌种保藏管理中心。金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)保存于运城职业技术学院微生物实验室。
1.1.3 试剂
霉菌培养采用PDA培养基(马铃薯葡萄糖琼脂培养基),细菌培养采用LB培养基。酵母提取物、胰蛋白胨、琼脂购于北京奥博星生物技术有限公司;葡萄糖、氯化钠购于广东光华化学试剂厂。
1.2 仪器与设备
BS- 224型电子天平:德国赛多利斯有限公司;高速万能粉碎机:天津市泰斯特仪器有限公司;旋转蒸发仪:上海亚荣生化仪器厂;超净工作台:苏州净化设备有限公司;超声波清洗仪:昆山市超声仪器有限公司。
1.3 方法
1.3.1 提取液制备
将食药同源植物用粉碎机粉碎,过80目筛后备用。称取各植物粉末100 g,按料液比1∶6(m∶V),用75%乙醇浸泡24 h后,放入超声仪中,60 ℃超声提取2 h,减压抽滤。滤液于旋转蒸发仪浓缩后用50%乙醇定容至100 mL,制成1 g/mL提取液,置于4 ℃冰箱中备用[6]。
1.3.2 提取液对霉菌抑菌效果检测
用PDA培养基将各提取液稀释至浓度为3.13 mg/mL的含药平板,以加有50%乙醇的PDA培养基为对照,在各平板中央放置直径为6 mm霉菌菌饼,于28 ℃恒温培养箱培养96 h,采用十字交叉法对菌落直径进行测量,计算各物质对三种霉菌的抑菌率[7],公式如下:
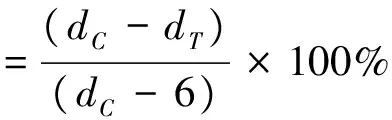
式中:dC为对照菌落直径(mm);dT为处理菌落直径(mm);6是接种菌块的直径(mm)。
1.3.3 提取液对霉菌最小抑菌浓度及最小杀菌浓度的测定
将不同浓度提取液添加到PDA培养基中,摇匀,制成提取液终浓度为100.00、50.00、25.00、12.50、6.25、3.13、1.56 mg/mL的含药培养基,以不含药的PDA培养基为空白对照。将培养基倒入培养皿中,冷凝后加入浓度为106~108的孢子菌悬液20 μL,涂布。置于28 ℃恒温培养箱培养72 h后观察,以无菌生长的培养皿的最低浓度为最小抑菌浓度(MIC)[8]。将无菌生长的培养皿继续培养72 h后观察,以无菌生长的培养皿的最低浓度为最小杀菌浓度(MBC)。
1.3.4 提取液对霉菌孢子萌发的抑制作用试验
采用稀释平板计数法[9]测定各提取液对三种霉菌孢子萌发的抑制作用。采用二倍稀释法制备5个提取液浓度梯度的含药培养基,最高浓度为试验得出的该提取液对试验菌的MIC,以不含药的PDA培养基为空白对照。制备1×106CFU/mL的孢子菌悬液,并稀释至约100 CFU/mL。吸取20 μL 菌悬液于含药固体培养基平板中,涂布。于28 ℃恒温培养箱中培养96 h,每个处理重复3次。培养完成后进行菌落计数,含药平板菌落数记为C,对照组菌落数记为C0,计算抑制率。

1.3.5 提取液对细菌抑菌效果检测
采用滤纸片扩散法[10]测定各提取液对大肠杆菌、金黄色葡萄球菌的抑菌效果。制备浓度为106~108的细菌菌悬液,取100 μL涂布LB培养基。将滤纸片(6 mm)于各提取液浸泡30 s后取出,置于培养基上,以浸泡50%乙醇的滤纸片作为对照。于37 ℃培养24 h后测量抑菌圈直径,每组做3个平行。
1.3.6 提取液对金黄色葡萄球菌最小抑菌浓度及最小杀菌浓度的测定
采用二倍稀释法[11],将不同浓度提取液添加到LB培养基中,摇匀,制成提取液终浓度为60.00、30.00、15.00、7.50、3.75 mg/mL的含药培养基,以不含药的LB培养基为空白对照。取浓度为106~107的菌悬液200 μL,涂布后置于37 ℃恒温培养箱培养24 h,以无菌生长的培养皿的最低浓度为最小抑菌浓度(MIC)。将无菌生长的培养皿继续培养48 h后观察,以无菌生长的培养皿的最低浓度为最小杀菌浓度(MBC)。
1.3.7 提取液对金黄色葡萄球菌生长状况的影响
将培养至对数期的金黄色葡萄球菌接种至LB液体培养基,添加不同量提取液到培养基中,使提取液浓度为MIC和1/2 MIC,以不加提取液的培养基为空白对照。置于37 ℃培养24 h,每隔2 h于600 nm测定培养基OD值,重复三次。以时间为横坐标,OD值平均值为纵坐标绘制金黄色葡萄球菌生长曲线。
1.3.8 提取液对果实发病率影响
挑选颜色大小均一、无机械损伤和病虫斑的樱桃番茄进行发病率测定[12]。樱桃番茄经0.1%次氯酸钠溶液浸泡2 min、自来水冲洗、蒸馏水冲洗后,阴干,备用。在樱桃番茄赤道位置打2~3 mm深小孔,在提取液浓度为MIC的溶液中浸泡2 min后取出,以浸泡于无菌水的樱桃番茄为空白对照。于小孔中注入20 μL霉菌孢子菌悬液(106~108CFU /mL),晾干水分后用保鲜袋包裹,在20 ℃培养,分别于1、3、5、7天记录发病个数,计算发病率。每30个作为一个处理,每个处理三个平行。

1.4 数据分析
采用WPS软件进行数据计算及图表制作。表2、表4和表5中的数据利用SPSS软件中单因素ANOVA方法进行方差分析,并用Duncan,s法比较数据之间的差异显著性。表7中的数据采用t检验,P<0.05为有显著性差异。
2 结果与分析
2.1 提取液对霉菌抑菌效果
不同食药同源植物提取液对三种霉菌的抑菌效果差别较大。由表2可知,花椒对三种霉菌抑菌效果突出,抑菌率均在90%以上。提取液对扩展青霉抑菌效果较好,除天麻、桔梗、金银花外,其他提取液抑菌效果均在50%以上,尤其是高良姜、莱菔子对青霉抑菌率较高。除花椒外,其他提取液灰葡萄孢抑菌作用较差。高良姜、莱菔子对链格孢也有一定抑菌作用。选择抑菌效果较好的花椒、高良姜、莱菔子进行最小抑菌浓度及最小杀菌浓度测定。
表2 提取液对三种霉菌的抑菌效果
注:同列不同字母表示差异显著(P< 0.05),下同。
Note:Different letters in the same column indicate significant differences (P< 0.05),the same below.
2.2 提取液对霉菌最小抑菌浓度及最小杀菌浓度的测定
由表3可知,花椒对扩展青霉和灰葡萄孢的MIC均为25.00 mg/mL,MBC分别为50.00和100.00 mg/mL。花椒对链格孢的MIC和MBC分别为50.00和100.00 mg/mL。高良姜对扩展青霉和链格孢的MIC均为100.00 mg/mL。莱菔子对扩展青霉的MIC和MBC分别为50.00和100.00 mg/mL,对链格孢的MIC为100.00 mg/mL。可以看出,花椒对三种菌的MIC和MBC最低,与抑菌效果测定一致。高良姜和莱菔子的MIC和MBC与表2抑菌效果略有不同,这可能与抑菌方式不同有关。
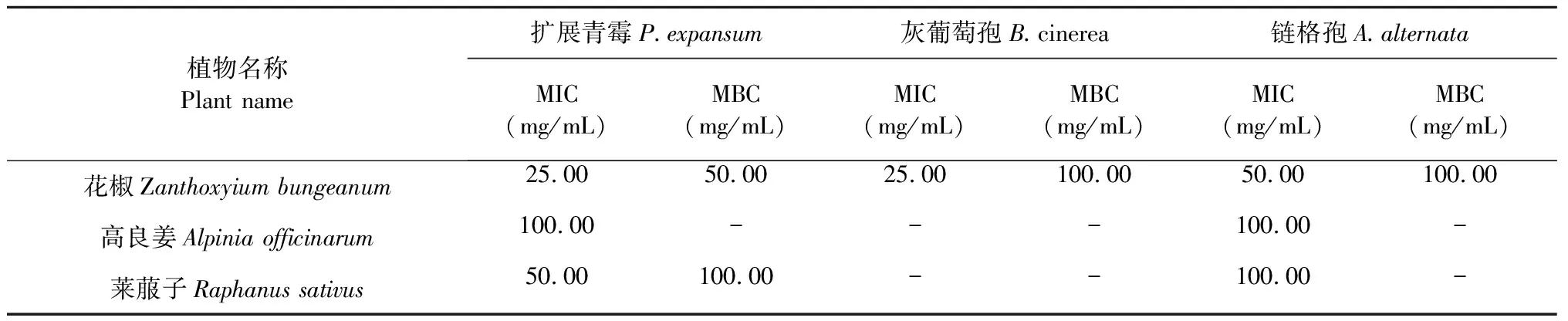
表3 提取液对三种霉菌的MIC和MBC
注:“-”表示无最低效力。
Note:“-” means no minimum effect.
2.3 提取液对霉菌孢子萌发的抑制作用
由以上试验可知,花椒对三种霉菌有较好的抑制作用,因此深入考察花椒对三种霉菌孢子萌发的抑制作用。由表4可知,不同浓度的花椒对三种霉菌的孢子萌发均有一定抑制作用。提取物浓度为最小抑菌浓度时,对三种霉菌孢子萌发达到100%抑制。浓度降低,花椒对三种霉菌孢子的萌发抑制率也显著降低。
2.4 提取液对2种细菌的抑菌效果
由表5可知,葛根和山茱萸对大肠杆菌、金黄色葡萄球菌均无抑菌效果,其他提取物对金黄色葡萄球菌的抑菌效果均优于对大肠杆菌的抑菌效果。高良姜、天麻对金黄色葡萄球菌的抑菌圈直径均在30 mm以上,抑菌效果最佳;其次为莱菔子、金银花、荷叶。莱菔子、金银花、天麻、花椒、白芷对大肠杆菌有一定抑菌效果。
表4 花椒对三种霉菌的孢子萌发的抑制效果

表5 提取物对2种细菌的抑菌效果
注:“-”表示未出现抑菌圈。
Note:“-” means that no inhibition zone appeared.
2.5 提取物对金黄色葡萄球菌的MIC和MBC
由于提取液对金黄色葡萄球菌抑菌效果更佳,因此选择金黄色葡萄球菌为供试菌。选择对金黄色葡萄球菌抑菌效果最好的高良姜、天麻进行MIC和MBC测定。由表6可知,高良姜的最小抑菌浓度和杀菌浓度分别为7.50和15.00 mg/mL,天麻的最小抑菌浓度和杀菌浓度分别为30.00和60.00 mg/mL。由此可知,高良姜和天麻对金黄色葡萄球菌的抑菌效果不同,金黄色葡萄球菌对高良姜更敏感。
2.6 提取液对金黄色葡萄球菌生长状况的影响
由图1、图2可知,未添加高良姜和天麻的对照组金黄色葡萄球菌生长状况良好。添加高良姜和天麻后,生长曲线变化明显,OD600值显著降低,且添加量为MIC时OD600值小于添加量为1/2 MIC时OD600值。由此说明高良姜和天麻对金黄色葡萄球菌的生长均有较显著的抑制作用,且其抑制作用与添加量呈正相关。

表6 提取物对金黄色葡萄球菌的MIC和MBC
2.7 提取液对果实发病率影响
为考查花椒对扩展青霉、灰葡萄孢、链格孢在樱桃番茄体内的抑制效果,用MIC浓度的花椒提取液处理樱桃番茄后,分别接种三种霉菌孢子,记录果实发病率,结果见表7。三种霉菌对照组果实发病率迅速升高,第3天时果实发病率均超50%,第7天时达100%。用MIC浓度花椒提取液处理之后,果实发病率明显降低,在第3天时发病率分别比对照组降低33.33%、40%、37.78%,在第7天时发病率分别比对照组降低43.33%、27.78%、31.11%,说明花椒提取液在樱桃番茄体内对扩展青霉、灰葡萄孢、链格孢仍有较强的抑制作用,对樱桃番茄有较好的防腐保鲜作用。
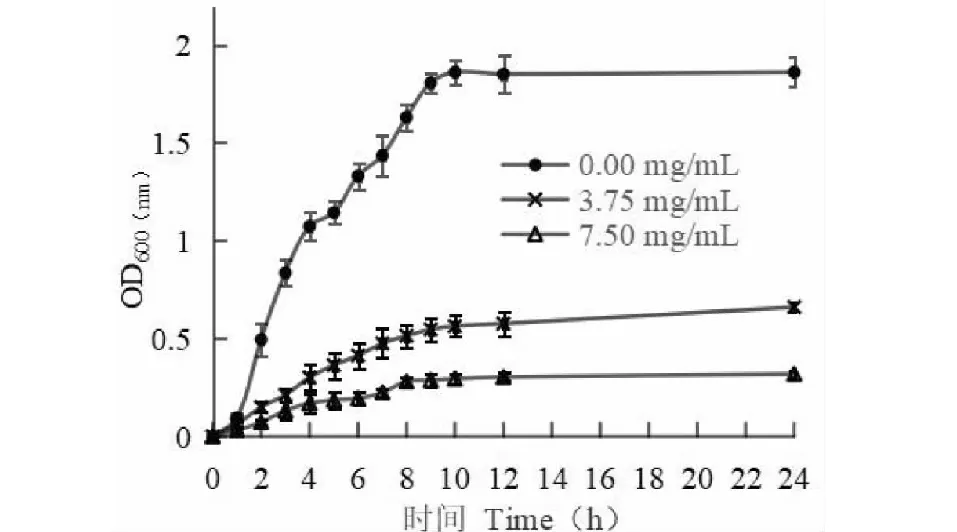
图1 不同浓度高良姜提取液对金黄色葡萄球菌生长状况的影响Fig.1 Effects of different concentrations of Alpinia officinarum extracts on the growth of S.aureus
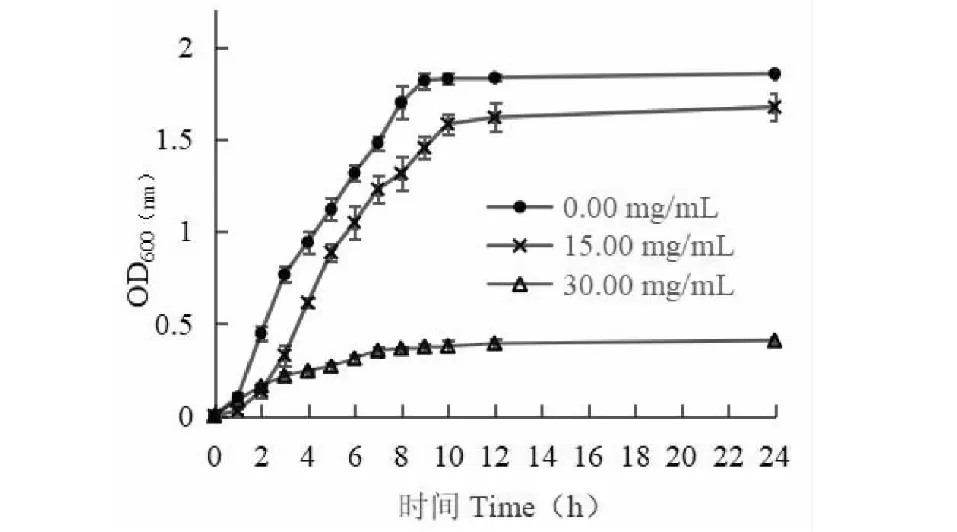
图2 不同浓度高良姜提取液对金黄色葡萄球菌生长状况的影响Fig.2 Effects of different concentrations of Gastrodia elata extracts on the growth of S.aureus

表7 花椒对樱桃番茄发病率的影响
注:*表示处理样品与对照样品在0.05水平有显著性差异。
Note:*indicates that there is a significant difference between the treated sample and the control sample at the 0.05 level.
3 结论
扩展青霉、灰葡萄孢、链格孢、大肠杆菌、金黄色葡萄球菌为果蔬中常见腐败菌,可侵染多种水果,造成大量经济损失。本研究以以上五种菌为供试菌,研究了11种食药同源植物提取液的抑菌效果。
花椒对扩展青霉、灰葡萄孢、链格孢抑菌效果突出,抑菌率均在90%以上。花椒提取物浓度为最小抑菌浓度时,对三种霉菌孢子萌发达到100%抑制。以樱桃番茄为例进行体内抑菌验证试验表明,花椒提取液处理后的樱桃番茄体与对照组相比果实发病率显著降低,防腐效果明显。花椒为芸香科花椒属植物花椒树的成熟果皮,有温热止痛、杀菌止痒功效[13]。研究表明,花椒中含有挥发油、生物碱、酰胺类、香豆素等成分,这些成分对食品腐败菌及致病菌有显著抑菌作用,具有较宽抑菌谱[14,15]。花椒已成为一种具有开发前景的防腐保鲜剂。本试验中花椒对金黄色葡萄球菌和大肠杆菌抑菌效果不显著,可能与花椒提取方法有关,不能将有效抑菌成分充分提取。
根据本试验结果,高良姜提取物对扩展青霉和链格孢的抑菌率分别为94.56%和66.00%,莱菔子提取物对扩展青霉和链格孢的抑菌率分别为78.20%和58.86%。高良姜、天麻提取物对金黄色葡萄球菌的抑菌效果最好,抑菌圈可达34.83和31.33 mm。高良姜属姜科植物,现代药理学表明,高良姜具有抗氧化、抗病毒、降血糖、抗肿瘤、防癌、抗菌、防治心脑血管疾病等功效[16]。已有研究表明,高良姜提取物抑菌作用广泛,其含有的二苯基庚烷、黄酮、挥发油等成分均有抑菌作用[17]。硫苷类化合物是莱菔子的特征性成分,主要指硫代葡萄糖苷及其降解产物。Zhou等[18]研究发现,硫苷降解产物提取液对大肠杆菌、欧氏杆菌、枯草芽孢杆菌、蜡样芽胞杆菌有抑菌效果。有研究表明,天麻中天麻多糖和天麻蛋白对大肠杆菌和金黄色葡萄球菌均有抑制作用[19,20]。但目前对天麻的研究主要为天麻活性成分提取和药理功能研究,天麻的抑菌作用研究仍较少。
本试验结果说明,食药同源植物在果蔬抑菌防腐方面具有广泛的应用前景,今后应对提取方式、抑菌机理、联合抑菌以及果蔬保鲜的实际应用等方面进行深入研究,以切实提高食药同源植物的开发利用价值。
