杂粮早餐粉对砷致小鼠雄性生殖毒性的缓解作用
2020-01-08高俊宇仪慧兰
高俊宇,仪慧兰
(山西大学生命科学学院,山西 太原 030006)
砷是自然界广泛存在的类金属元素。自然或人为因素造成的土壤和水体中砷含量过高已严重威胁人类健康[1]。砷可通过呼吸道、皮肤、消化道等途径进入人体,饮用水摄入是砷进入人体最主要的途径[2]。据统计全球约2亿人的饮用水中砷含量高于世界卫生组织规定的最高限值10 μg/L[3]。我国山西、新疆、云南等十几个省份存在饮用水砷超标问题。长期饮用含砷水不仅会损伤人体神经系统、心血管系统、呼吸系统和消化系统等,还能引发皮肤癌、肺癌、膀胱癌和肝癌等[4]。研究还发现,饮用水砷超标可致男性生育能力低下,使精子数量减少、活力减弱、畸形率增加[5]。目前还没有有效的措施解决高砷饮水地区男性生育力下降的问题。
动物实验表明,砷是生殖毒物之一,会引起一系列生殖毒性。长期饮用含砷水会导致睾丸类固醇生成抑制,睾丸和附属器官质量减轻,精子数量减少、活性降低,血清促性腺激素和睾酮水平改变[6-8]。现有研究认为,砷的生殖毒性可能与其引发的氧化胁迫有关,补充抗氧化剂VC能减轻砷摄入对小鼠雄性生殖能力的影响[9]。
鉴于此,本课题组前期基于抗氧化能力提升和营养成分均衡的原则研制了一款杂粮早餐粉[10],本实验通过毒理学实验程序研究杂粮早餐粉对饮水摄入砷带来的雄性生殖毒性的缓解作用,以期为高砷地区居民提供方便食材,通过日常饮食缓解砷毒性,达到保护机体健康的目的。
1 材料与方法
1.1 材料与试剂
健康昆明种纯系雄性小白鼠40 只,体质量(23±2)g(生产许可证号:SCXK 2017-0001;使用许可证号:SYXK 2017-0003),由山西省肿瘤医院提供;小鼠饲喂专用全价大颗粒饲料由山西医科大学提供。
超氧化物歧化酶(superoxide dismutase,SOD)、H2O2、还原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成科技有限公司;乙醇、甲醇、甲醛、二甲苯(分析纯) 无锡市晶科化工有限公司;伊红(分析纯) 上海西陇化工有限公司;苏木精(分析纯) 北京亚米生物科技有限公司;亚砷酸钠 美国Sigma公司;氯化钠(分析纯)山东德彦化工有限公司;考马斯亮蓝 沈阳乐衡科技有限公司;戊巴比妥钠(纯度99%) 北京华业寰宇化工有限公司;石蜡 海门市峰益实验器材厂。
1.2 仪器与设备
SynergyH1多功能酶标仪 美国BioTek Instruments公司;BX41荧光生物显微镜 日本Olympus公司;HC-2518R高速冷冻离心机 安徽中科中佳科学仪器有限公司;800Y高速多功能粉碎机 永康市铂欧五金制品有限公司;G70F20CN1L-DG(B0)家用微波炉 广东格兰仕集团。
1.3 方法
1.3.1 早餐粉溶液的配制
课题组前期研制的早餐粉配方如下[10]:小米27.76%(质量分数,下同)、白砂糖24.44%、黄豆20.00%、核桃仁19.70%、葡萄皮5.00%、黄原胶3.00%。其中,葡萄果皮粉过120 目筛,其他成分过80 目筛。
早餐粉溶液的配制:取1 g早餐粉加入水温90 ℃以上的蒸馏水7 mL冲调,配制质量浓度为14.30 g/100 mL的早餐粉溶液;取1 g早餐粉加水温90 ℃以上的蒸馏水14 mL冲调,配制质量浓度为7.15 g/100 mL的早餐粉溶液。
1.3.2 实验动物分组
将小鼠按体质量随机分为4 组,每组10 只。设正常对照组:小鼠饮用蒸馏水;砷染毒组:小鼠饮用含砷蒸馏水(用NaAsO2配制,砷质量浓度为10 mg/L);早餐粉干预组:小鼠在饮用含砷水的同时灌胃7.15 g/100 mL(低剂量组)或14.30 g/100 mL早餐粉溶液(高剂量组)。灌胃起始剂量为每次每只0.4 mL,小鼠体质量每增加2 g,灌胃体积增加0.03 mL,每3 d灌胃一次。实验周期60 d。所有实验小鼠均饲喂专用全价大颗粒饲料,每只小鼠5 g/d。各组小鼠均自由取水,每2 d对小鼠的饮水量进行监测记录,将该笼小鼠的饮水量除以小鼠数量,即为该笼每只小鼠的日均饮水量。实验期间平均饮水量为日均饮水量的平均值。每周称体质量1 次。染毒结束前12 h禁食。
1.3.3 实验动物解剖与取材
将小鼠麻醉、称质量、解剖,取双侧附睾用于制备精子悬液,取双侧睾丸用预冷的生理盐水浸洗,滤纸吸干表面浮水,称质量,将左侧睾丸浸泡于体积分数4%的中性甲醛溶液中固定,右侧睾丸冷冻于-80 ℃冰箱中备用。睾丸脏器系数按下式计算。
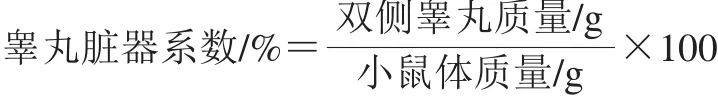
1.3.4 睾丸组织氧化胁迫指标测定
取冻存的睾丸组织,加生理盐水制备质量分数10%的组织匀浆液。按照试剂盒操作说明,检测SOD活力和GSH、H2O2、MDA含量。用考马斯亮蓝比色法[11]测定蛋白含量。
1.3.5 精子数量和形态的观察
将附睾用生理盐水洗净,置于小平皿中,加入500 μL生理盐水浸没,用眼科剪纵向剪1~2 次,于37 ℃水浴5 min,皿中液体经擦镜纸过滤得到精子悬液[12],用血球计数板对精子数量计数。
取精子悬液,推片、干燥、甲醇固定,用体积分数1%~2%伊红染色,显微镜观察。精子畸形计数以7 种畸变类型为基准,包括无钩、香蕉头、胖头、不定型头、双头、尾折叠和双尾。选择背景清晰,精子结构无损坏、无重叠的制片区域,统计该精子制片畸形精子数和精子总数,每只小鼠观察精子共计约1 000 个,计算精子畸形率[12]。
1.3.6 睾丸组织切片与观察
取甲醛固定的睾丸组织,制备石蜡切片。组织经自来水浸洗,乙醇脱水,二甲苯透明处理,浸蜡(石蜡熔点58~60 ℃),包埋,切片(厚度3~4 μm)、展片、贴片,苏木精-伊红染色,光学显微镜观察。
1.4 数据统计与分析
各组实验所得结果均以平均值±标准差表示。采用SPSS 17.0软件进行统计学分析,组间比较采用单因素方差分析方法。
2 结果与分析
2.1 实验小鼠的一般情况
整个实验期间,所有小鼠毛发顺畅,行走、饮食正常,未出现死亡。根据实验期间对饮水量的监测,砷染毒组小鼠饮水量平均值为5.57 mL/d,由饮水量计算小鼠砷摄入量均值为1.731 6 mg/(d·kg mb),砷染毒组和早餐粉干预组小鼠饮水量无显著差异(P>0.05),因此两组小鼠砷摄入量也无显著差异(P>0.05)。实验结束时各组小鼠的体质量均无显著差异。
2.2 砷对小鼠睾丸脏器系数和精子总数的影响及杂粮早餐粉干预效应

图1 小鼠睾丸脏器系数Fig. 1 Mouse testicular coefficient
由图1可知,与正常对照组相比,砷染毒组小鼠睾丸脏器系数显著降低,14.30 g/100 mL早餐粉干预组小鼠的睾丸脏器系数较砷染毒组显著升高(P<0.05)。

图2 小鼠的精子总数Fig. 2 Total sperm count of mice
由图2可知,砷染毒组小鼠的精子总数显著低于正常对照组(P<0.05),7.15 g/100 mL的早餐粉溶液干预后小鼠的精子总数略高于砷染毒组,14.30 g/100 mL的早餐粉溶液干预后小鼠的精子总数显著高于砷染毒组(P<0.05),且接近正常对照组。
2.3 砷对小鼠睾丸组织的氧化损伤及杂粮早餐粉的干预效应
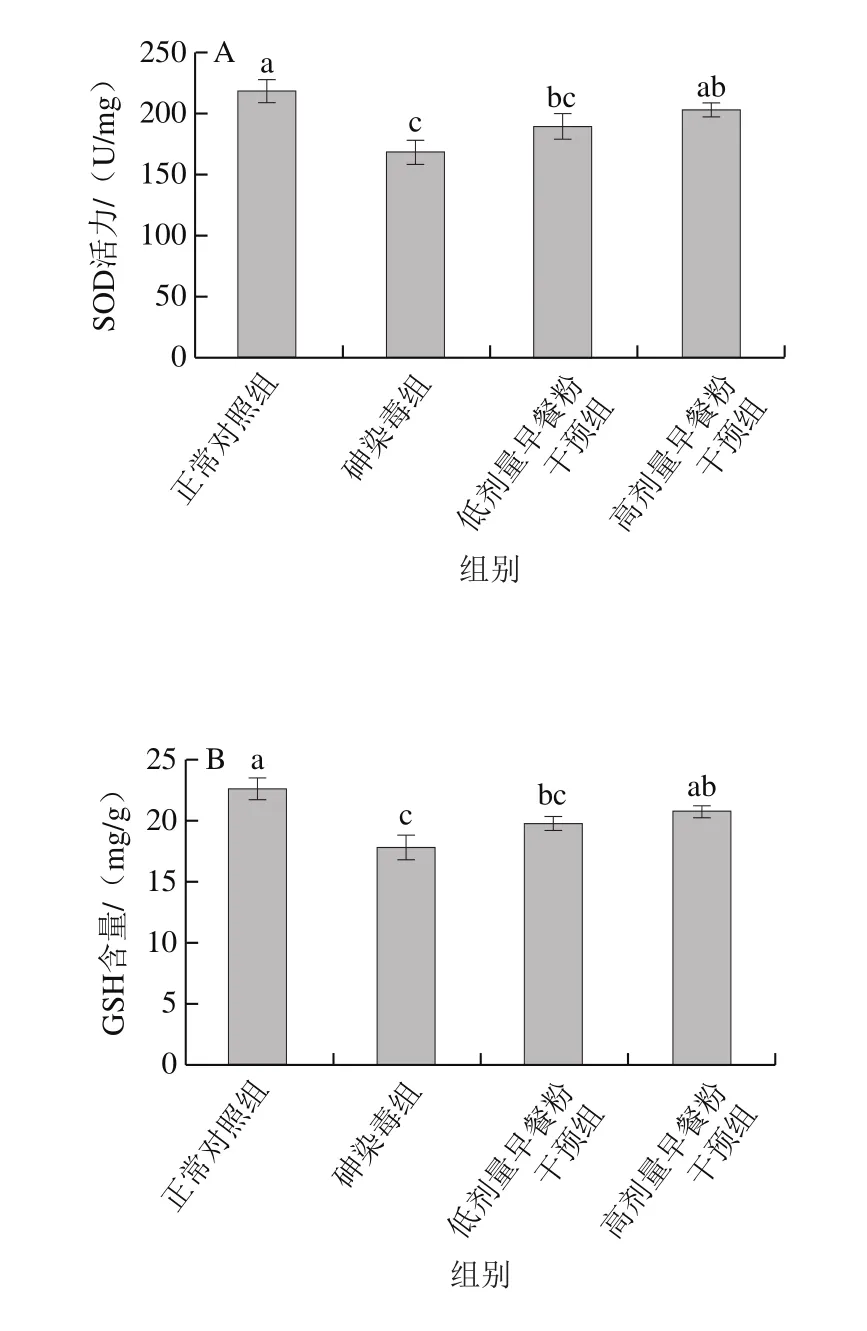

图3 小鼠睾丸组织的氧化胁迫指标Fig. 3 Oxidative stress indexes of testicular tissue in mice
由图3可知,与正常对照组相比,砷染毒组小鼠睾丸组织SOD活力和GSH含量显著降低(P<0.05),H2O2和MDA含量显著升高(P<0.05),采用杂粮早餐粉干预后,睾丸组织中SOD活力和GSH含量较砷染毒组提高,其中14.30 g/100 mL早餐粉干预组显著高于砷染毒组(P<0.05)。两个早餐粉干预组中H2O2和MDA含量均显著低于砷染毒组(P<0.05),睾丸组织氧化损伤程度明显降低。
2.4 砷对小鼠精子的致畸作用及杂粮早餐粉干预效应
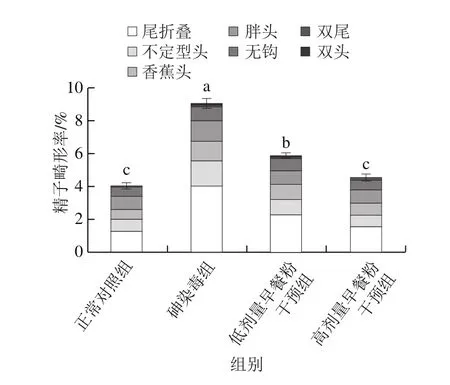
图4 小鼠精子畸形率Fig. 4 Sperm deformity percentage in mice
由图4可知,砷染毒组的精子畸形率显著高于正常对照组,7 种精子畸形类型所占比例依次为:尾折叠>不定型头>香蕉头>胖头>无钩>双尾、双头,其中双尾和双头所占比例很少。与正常对照组相比,砷染毒组中不同类型精子畸形率的增幅分别为:尾折叠2.64%、不定型头0.78%、香蕉头0.58%、胖头0.48%和无钩0.16%。早餐粉干预组的精子畸形率显著低于砷染毒组,其中,14.30 g/100 mL早餐粉溶液干预后精子畸形率降低至接近正常对照组,效果好于7.15 g/100 mL早餐粉干预组。
2.5 砷对小鼠睾丸组织结构的损伤及杂粮早餐粉干预效应
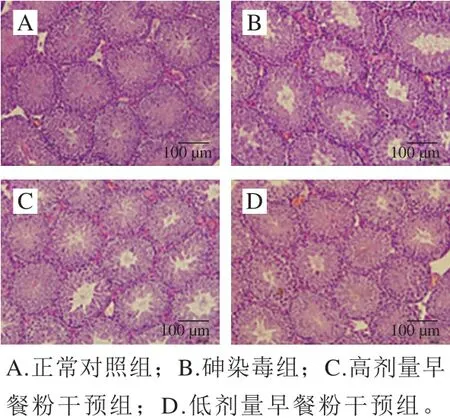
图5 小鼠睾丸组织切片(×200)Fig. 5 Testicular tissue sections of mice (× 200)
由图5可知,光学显微镜下,正常对照组小鼠睾丸生精小管排列规则,基膜结构完整,管腔内有大量精子,生精细胞排列紧密且层次分明,各发育阶段精细胞均有,生精细胞大约有5~6 层。砷染毒组生精小管间有间隙产生,基膜结构出现破损,生精细胞排列疏松且不规则,生精小管管腔内成熟精子较少。采用早餐粉干预后,生精细胞排列的紧密度和规则性提高,生精小管基膜结构较完整,管腔内的精子较砷染毒组明显增多。两个早餐粉干预组相比,14.30 g/100 mL早餐粉干预组的睾丸结构更接近于正常对照组。
3 讨 论
现有研究表明,氧化损伤是砷毒性作用的主要机制[13-15],本研究采用含砷质量浓度为10 mg/L的蒸馏水饲喂小鼠,60 d后小鼠精子数量下降、结构异常,睾丸组织出现氧化应激和结构损伤,说明本实验所用昆明种小鼠对砷致雄性生殖毒性的反应与大鼠和雄兔[16]等实验动物一致,建立的毒理模型具有较好的代表性。而杂粮早餐粉干预不仅能改善砷摄入引发的睾丸组织氧化胁迫,对砷致睾丸组织结构损伤也有明显的缓解效应,可能与杂粮早餐粉增加机体抗氧化活性继而降低砷诱发的氧化损伤有关。
脏器系数是动物实验中重要的检测指标,脏器系数降低说明该组织器官萎缩[17]。本研究中通过饮水摄入10 mg/L砷,导致小鼠睾丸质量的下降,在用14.30 g/100 mL早餐粉溶液干预后小鼠睾丸脏器系数得到显著提升(P<0.05),表明摄入一定量的早餐粉可缓解砷致小鼠雄性生殖器官的毒性作用。
精子数量和质量是判断砷致雄性生殖毒性的重要指标,进入机体的砷会抑制雄性生殖细胞的发生和发育,使精子总数减少[8,18],畸形率升高。本研究中砷染毒组精子总数降低,精子畸形率增加,表明本实验条件下摄入的砷剂量已对小鼠精子的生成产生毒性或抑制作用,使精子总数降低、形态异常。采用杂粮早餐粉干预后小鼠精子总数升高,可能是杂粮早餐粉中含有的生物活性物质,如植物抗氧化成分、功能小分子物质等,可有效地提高小鼠机体抗氧化能力,缓解砷摄入引发的小鼠生精过程异常。
生物体内存在抗氧化防御系统,维持生物体内氧化还原状态的动态平衡。本研究中砷染毒组SOD活力和GSH含量降低,H2O2和MDA含量提高,这与前人在动物实验中取得的结果[14-15]一致,说明饮用水摄入砷引发了小鼠睾丸组织细胞的氧化还原失衡。SOD是机体抗氧化系统的第一道防线,摄入砷使睾丸SOD活力降低,可能是砷对巯基的高亲和力导致酶结构发生变化,竞争性抑制Cu2+和Zn2+等微量元素的吸收,致使含巯基的抗氧化酶失活[18]。GSH是抗氧化系统的第二道防线,可通过自身氧化还原循环降低胞内自由基水平,GSH也是谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽硫转移酶(glutathione S-transferases,GST)的底物,砷染毒组还原型GSH消耗量增加[19],导致还原型GSH含量减少、机体还原能力降低,通过影响GPx和GST活力引发机体抗氧化能力下降。砷染毒组H2O2含量提高表明睾丸组织中存在较高水平的自由基,胞内高水平自由基能损伤生物大分子,使抗氧化分子减少、抗氧化酶活力降低,膜脂过氧化产物MDA浓度提高。采用杂粮早餐粉干预后SOD活力和还原型GSH含量升高,H2O2和MDA含量降低,可能是杂粮早餐粉中含有的大豆异黄酮、花色苷和VC等活性物质增加了睾丸组织中酶和非酶抗氧化剂的水平,阻止了自由基链式反应[20]。
本课题组研制的杂粮早餐粉,其主要成分包括小米、大豆、核桃和葡萄皮,小米中含有丰富的不饱和脂肪酸、维生素、氨基酸和多酚类物质[21];大豆含有丰富的全蛋白、不饱和脂肪酸、花色苷等黄酮类物质[22];核桃中含有丰富的可溶性蛋白、VE、VC、氨基酸、多酚类物质和核桃油,核桃油中含不饱和脂肪酸、棕榈酸、槲皮素和鞣花酸等[23];葡萄皮中含有大量的植物天然活性成分,如白藜芦醇、VC、原花青素和花青素等[24-25]。大豆中的全蛋白易于被人体消化吸收,不仅能为人体活动提供能量,还能提供必需氨基酸,全蛋白中的酪蛋白能够缓解砷引起的氧化应激,抑制活性氧生成,提高机体抗氧化酶活力[26]。早餐粉中含有的VC是氧化还原反应中的单电子供体,可直接中和活性氧,保护SOD和过氧化氢酶的活力,降低砷对机体的氧化应激作用[9];原花青素、花青素、白藜芦醇、槲皮素、鞣花酸和花色苷等黄酮类和酚类物质具有很好的抗氧化、抗炎症和清除自由基功效,具有减缓砷氧化应激的作用[27-30];不饱和脂肪酸α-亚麻酸可上调SOD蛋白和基因的表达水平,从而提高其活力和含量[14],提高睾丸组织的抗氧化能力。
上述结果表明,通过饮水摄入砷能诱发睾丸组织氧化胁迫,机体的氧化应激反应可能会导致雄性生殖毒性,包括睾丸组织氧化还原系统失衡、精子质量和数量异常、睾丸组织结构破坏。杂粮早餐粉能显著增强小鼠睾丸组织的抗氧化能力,缓解砷摄入对睾丸组织的氧化胁迫,提高精子数量和质量,并对睾丸组织结构有一定保护作用。
