姜黄素对幽门螺杆菌及其诱导人胃GES-1细胞损伤的影响
2020-01-08任娇艳杨宜婷袁尔东
任娇艳,苟 娜,高 立,杨宜婷,李 良,袁尔东,
(1.华南理工大学食品科学与工程学院,广东 广州 510641;2.中新国际联合研究院,广东 广州 510000;3.无限极(中国)有限公司,广东 广州 510665)
幽门螺杆菌(Helicobacter pylori,Hp)是革兰氏阴性、微需氧、可在人胃黏膜中定植的螺旋杆菌。虽然世界上50%的人口携带Hp,但大多数感染人群是无症状的。其中,10%~15%的Hp感染个体会发展成慢性炎症,导致萎缩性胃炎、消化性溃疡以及胃癌[1]。世界卫生组织将Hp定为第Ⅰ类致癌物,认为其具有显著引发胃癌的风险[2]。所以,根除Hp是治疗其相关疾病最有效的方法。
正常情况下人体胃内的pH值大约在1~2之间,因此极少有细菌能够在胃中存活下来,Hp能够在此环境下生存主要是依靠其能够产生具有强大活力的脲酶[3],该种酶可以充分分解胃液中少量的尿素而产生氨,在Hp周围形成一片“氨云”,中和胃酸,保护细菌不被胃酸杀灭。脲酶占据整个Hp可溶蛋白的10%~15%,这不仅是其区别于其他胃肠道微生物的主要特征,也是其重要的定植和致病因子[4]。
临床上,根除Hp感染主要是通过“三联疗法”,包括两种抗生素(克拉霉素和阿莫西林或甲硝唑)和质子泵抑制剂(奥美拉唑、艾普拉唑)[5]。但是,这种疗法对胃肠道有明显的副作用,如呕吐、腹泻、腹痛、恶心等。而且,因为抗生素治疗耐受性差并可能导致治疗中断,因此这种方案逐渐被弃用。
很多研究将天然活性成分用于防治Hp感染,如抗氧化剂、益生菌、维生素以及各种植物提取物等,这些物质开启了控制Hp相关炎症和癌前病变的新维度[6-7]。姜黄素是一种多酚类黄色素,从植物姜黄(Curcuma longa)的根茎中提取得到,可作为香料、色素、染料等用于护肤产品和纺织工业[8]。近年来许多研究发现,姜黄素具有抗炎、抗氧化和抗感染功效[9-10],并可以抑制多种寄生虫、细菌和病原真菌等,对Hp、枯草芽孢杆菌、恶性疟原虫等具有良好的抑制作用[11],且具有抗菌谱广、不易产生耐药性等优点。姜黄素对肿瘤具有良好的预防和强效抑制作用[12-13],可通过致胃癌细胞突变[14]、调控细胞周期[15]、致细胞凋亡[16]以及抑制肿瘤细胞血管生成等途径来抑制人胃癌细胞的增殖,因此,姜黄素也被认为是预防胃癌的一种安全性较高的活性物质,已成为食品、功能性食品以及医药领域的研究热点。
本实验基于Hp感染引起的胃黏膜细胞损伤,对姜黄素的作用及机制进行研究。在研究姜黄素对Hp体外抑制活性的基础上,对抑制脲酶活力的方式进行探讨;构建Hp感染人胃GES-1细胞损伤模型,研究姜黄素对Hp感染引起胃黏膜损伤的修复作用。
1 材料与方法
1.1 材料与试剂
Hp、人胃GES-1细胞 南方医科大学南方医院消化科。
姜黄素(纯度90%,食品级) 郑州百思特食品添加剂有限公司;无菌脱纤维绵羊血 广州鸿泉生物科技有限公司;胎牛血清 美国Gibco公司;脑心浸液(brain heart infusion,BHI)、CM0331B哥伦比亚血琼脂基础培养基 广州翔博生物科技有限公司;革兰氏染色液试剂盒 青岛海博生物技术有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT)细胞增殖及细胞毒性检测试剂盒 上海碧云天生物技术有限公司。
1.2 仪器与设备
超净工作台 苏州净化设备有限公司;万分之一电子天平、高压灭菌锅、厌氧培养罐(细菌) 上海安亭科学仪器有限公司;UV754N紫外-可见分光光度计INESA上海仪电分析仪器有限公司;XDS-1B倒置相差显微镜 北京荣兴光恒科技有限公司;离心机 美国Thermo公司。
1.3 方法
1.3.1 Hp的活化及菌悬液的制备
取出-80 ℃冻存Hp菌株,37 ℃水浴2 min解冻,吸取100 μL Hp菌液,涂布接种至含有质量分数7.5%无菌脱纤维绵羊血的哥伦比亚血琼脂培养基,于37 ℃、微需氧(含5% O2、10% CO2、85% N2)、饱和湿度环境倒置培养48 h用于实验或传代。将Hp刮取收集于含10%胎牛血清的BHI培养液中,制备成活菌悬液。
1.3.2 Hp菌落浓度的检测
在600 nm波长处检测Hp活菌悬液的OD值,以OD600nm=1时细菌浓度109CFU/mL为标准[17],确定Hp活菌悬液细菌浓度。
1.3.3 Hp生长曲线的绘制
Hp菌株平板培养48 h后,用灭菌接种环挑取单个菌落至10 mL含10%胎牛血清的BHI中进行液体培养。每隔12 h从中吸取100 μL Hp培养液至900 μL新鲜BHI中稀释。再吸取不同浓度梯度液体50 μL转至固体培养基,微需氧条件下培养48 h,对菌落进行计数。
1.3.4 姜黄素对Hp的抑制作用
以0.1%二甲基亚砜(dimethyl sulfoxide,DMSO)溶解姜黄素,在含10%胎牛血清的BHI培养液中进行梯度稀释,过0.22 μm滤膜,备用。在24 孔板中加入10 μL菌悬液(109CFU/mL)和990 μL含25、50、100、200、400、800 μmol/L姜黄素的BHI培养液[18]。同时,阴性对照组加入不含姜黄素的BHI培养液和菌悬液,阳性对照组加入含100 μg/mL阿莫西林和50 μg/mL克拉霉素混合抗生素[19]的BHI培养液和菌悬液。37 ℃微需氧条件下培养24 h后,适当稀释后并转至哥伦比亚血琼脂培养基上,培养48 h后对菌落进行计数,确定最低抑菌浓度。
1.3.5 姜黄素对脲酶的体外抑制活性
脲酶能水解尿素产生氨,通过贝特洛比色法测定所产生氨态氮的含量即可了解脲酶的活力。其作用原理是,氨在碱性条件下与苯酚、次氯酸盐反应产生一种靛酚蓝-蓝色络合物,该络合物的色度与NH4+浓度在一定范围内呈良好的线性关系,且灵敏度高、重现性好[20]。
分别将脲酶溶液(10 U/mL)与不同浓度(0.625、1.25、2.5、5、10 mmol/L)的姜黄素溶液各100 μL混匀,于37 ℃避光反应20 min。加入50 mmol/L尿素100 μL,在室温下避光反应20 min。加入贝特洛显色液200 μL,混匀,在室温下避光反应10 min,测定595 nm波长处OD值(OD样品)。对照组则加入含乙二胺四乙酸的磷酸盐缓冲液,同样方法检测OD值(OD对照)。以相应溶液的溶剂作为空白组测OD值(OD空白)。同时,以槲皮素作为阳性对照。计算剩余酶活力(residual activity,RA)(式(1))及半数抑制浓度(median inhibition concentration,IC50)[21]。

1.3.6 姜黄素对人胃GES-1细胞的影响
将人胃GES-1细胞以2.5×106个/瓶接种于25 mL培养瓶中,加入5 mL含10%胎牛血清的DMEM培养基,37 ℃、5% CO2培养。细胞融合至80%时,用质量分数0.25%胰酶消化计数,按每孔1×104个将人胃GES-1细胞接种至96 孔板培养,每组设6 个复孔。细胞贴壁12 h后加入姜黄素,使其终浓度为68、136、680 μmol/L,继续培养12、24、36、48 h,光学显微镜下观察细胞形态变化。
采用MTT法检测细胞存活率。每孔加入20 μL MTT溶液(5 g/L),培养4 h后弃去上清液,加入150 μL DMSO,振荡溶解结晶,测定570 nm波长处OD值(OD样品)。对照组不加姜黄素溶液,同样方法检测OD值(OD对照)。以相应溶液的溶剂作为空白组测OD值(OD空白),按式(2)计算人胃GES-1细胞存活率。
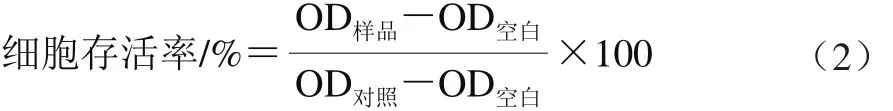
1.3.7 姜黄素对Hp感染人胃GES-1细胞的影响
按每孔1×104个将人胃GES-1细胞接种至96 孔板培养,每组设6 个复孔。细胞贴壁12 h后,按照感染复度100将Hp标准菌株悬液加入96 孔板与人胃GES-1细胞共培养24 h。然后加入姜黄素,使其终浓度为0、68、136、680 μmol/L;对照组为未加Hp菌悬液和姜黄素的人胃GES-1细胞。继续培养12、24、36、48 h,光学显微镜下观察细胞形态变化,采用1.3.6节MTT法检测细胞存活率。
1.4 数据统计与分析
所有数据均独立平行测定3 次,数据结果以平均值±标准差表示,采用SPSS 13.0软件对数据进行分析,采用GraphPad Prism 6.0软件对数据进行方差分析并作图,以P<0.05为差异显著。
2 结果与分析
2.1 Hp生长曲线
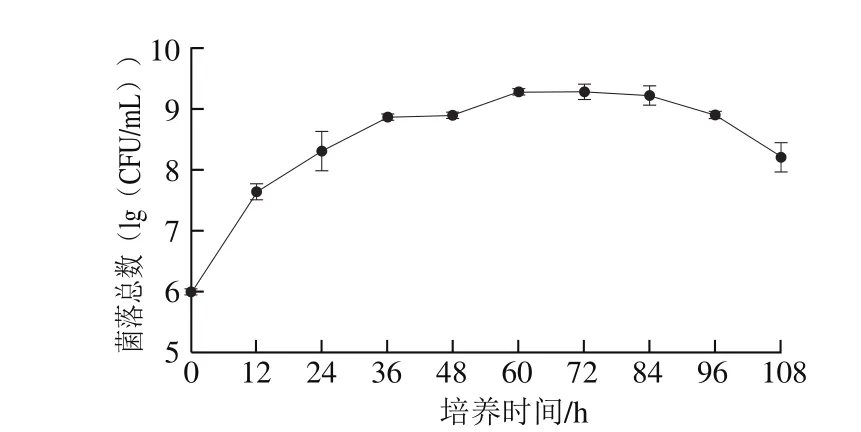
图1 Hp生长曲线Fig. 1 Growth curve of Hp
如图1所示,在0~48 h期间Hp细菌处于对数生长期,48~84 h期间细菌处于稳定生长期,84 h后细菌处于衰退期。因此,为保证菌株生长活力,在后续抑菌实验中的液体培养阶段,培养时间为24 h,使Hp菌株处于对数生长期。
2.2 姜黄素对Hp生长的抑制作用

图2 阿莫西林-克拉霉素及姜黄素对Hp生长的抑制作用Fig. 2 Inhibitory effect of amoxicillin-clarithromycin and curcumin on Hp
参照临床中用于治疗Hp感染的三联疗法(艾普拉唑10 mg、阿莫西林1 000 mg、克拉霉素500 mg),采用阿莫西林与克拉霉素质量比为2∶1的混合抗生素作为抑菌实验的阳性对照药物。如图2所示,混合抗生素对Hp生长有很好的抑制作用,呈现明显的剂量依赖效应,阿莫西林和克拉霉素的最低抑制浓度分别为100 μg/mL和50 μg/mL。因此,本实验选择100 μg/mL阿莫西林和50 μg/mL克拉霉素联用作为阳性对照药物。
如图2所示,姜黄素可明显抑制Hp的生长。随着姜黄素浓度的升高,其抑菌效果也更加明显,其对Hp的最低抑制浓度为200 μmol/L。有研究认为,姜黄素可直接抑制Hp生长,可能是由于其具有良好的膜渗透性,破坏了Hp细胞膜的完整性,从而导致Hp死亡[22]。
2.3 姜黄素对脲酶活力的抑制作用
极高的脲酶活力是Hp重要的生物学特征之一[23]。脲酶在胃部高酸环境下定植,会引起胃炎和胃溃疡等疾病,长期感染甚至会导致胃癌[24-25]。脲酶广泛存在于自然界,酵母、真菌、藻类、细菌和一些高等植物都能产生脲酶,且各种来源的脲酶的氨基酸序列均相似[26]。因此,本实验以脲酶(刀豆)作为Hp脲酶的研究模型,来探讨活性物质对Hp的抑制机理。目前,己有许多黄酮类化合物被证明为脲酶的抑制剂,其中槲皮素是公认效力最强的脲酶抑制剂[27]。因此,本实验选择以槲皮素作为阳性对照物,研究姜黄素对脲酶(刀豆)活力的抑制作用,以探讨姜黄素抑制Hp的作用机制。

图3 姜黄素和槲皮素对脲酶(刀豆)的抑制效果Fig. 3 Inhibitory effect of curcumin and quercetin on Jack bean urease activity
如图3所示,姜黄素和槲皮素对脲酶(刀豆)都有明显的抑制作用,并呈现明显的剂量-效应关系,其IC50分别为1.735 mmol/L和0.801 mmol/L。由此推断,姜黄素可能通过抑制Hp脲酶的活力,减弱其在胃部的定植能力,并降低脲酶这一毒力因子对胃部的损伤,从而可能对Hp诱导的胃部损伤起到一定的缓解作用。
2.4 姜黄素对人胃GES-1细胞增殖的影响

图4 姜黄素对人胃GES-1细胞增殖的影响Fig. 4 Effect of curcumin on GES-1 cells proliferation
姜黄素对人胃GES-1细胞增殖有明显影响(图4)。以68 μmol/L姜黄素作用12 h后,人胃GES-1细胞存活率略有增长,但与正常细胞相比不显著。当姜黄素浓度和作用时间继续增加,人胃GES-1细胞存活率明显下降。以680 μmol/L姜黄素作用48 h后,其对人胃GES-1细胞的抑制率已达到52.661%。说明高浓度姜黄素对人胃GES-1细胞增殖具有一定的抑制作用。
有研究显示,姜黄素可通过下调胃癌细胞中细胞周期蛋白D1的表达来抑制体内肿瘤生长[28]。本研究中,较高浓度姜黄素对人胃GES-1细胞增殖的抑制作用,可能是由于姜黄素通过降低Bcl2表达或增强活性氧产生来诱导细胞凋亡,并通过下调细胞周期蛋白D1表达来诱导细胞周期停滞在G1期[29]。
2.5 姜黄素对Hp感染人胃GES-1细胞的影响

图5 姜黄素对Hp感染人胃GES-1细胞增殖的影响Fig. 5 Effect of curcumin on the viability of GES-1 cells injured by Hp

图6 人胃GES-1细胞形态的变化(20×)Fig. 6 Morphological change of GES-1 cells (20 ×)
图5 所示为姜黄素对Hp感染人胃GES-1细胞存活率的影响。如图6A所示,生长状态良好的人胃GES-1细胞形态为梭形或扁平多边形,呈小岛状成片贴壁生长。当被Hp感染24 h后,如图6B所示,人胃GES-1细胞变圆,贴壁细胞减少,漂浮细胞增多,细胞间隙增大,细胞周围出现碎片,同时细胞存活率与相对存活率为100%的未感染Hp的细胞相比显著下降(图5)。说明Hp可明显抑制人胃GES-1细胞的增殖,且作用时间越长其抑制效果越明显。
如图6C所示,在Hp感染24 h后加入68 μmol/L姜黄素,12 h后显微镜观察发现人胃GES-1细胞贴壁细胞数量增多,细胞形态有一定程度的复原;同时,人胃GES-1细胞存活率略有升高,但不显著。其原因可能在于姜黄素对Hp生长和脲酶活力具有抑制作用,在一定程度上减缓了Hp对人胃GES-1细胞的损害,对于维持细胞形态和细胞数量具有一定效果[30]。
当姜黄素浓度提高到136、680 μmol/L时,人胃GES-1细胞存活率明显下降。Yang Hongru等的研究也得到类似的结果,虽然姜黄素对胃癌细胞具有良好的抑制作用,但是较高浓度的姜黄素对人胃GES-1细胞也会呈现一定抑制作用[31]。其原因可能是高浓度姜黄素对Hp和脲酶的抑制作用仍不足以缓解其对人胃GES-1细胞增殖的抑制作用。因此,过高浓度的姜黄素对Hp感染引起的人胃GES-1细胞损伤并无明显作用。
因此,对于Hp感染引起的胃黏膜细胞损伤,可考虑使用具有增殖胃黏膜细胞作用的活性成分(如紫葳科植物、蔓越橘、佛手柑提取物等[32-33])与具有抑制Hp生长作用的姜黄素协同作用,从而达到抑制Hp生长、修复胃黏膜损伤的目的。
3 结 论
姜黄素具有良好的抑制Hp增殖作用(最低抑菌浓度为200 μmol/L),并可明显抑制脲酶活力(IC50=1.735 mmol/L)。同时,姜黄素对人胃GES-1细胞具有一定的抑制作用,并呈现剂量、时间-效应关系。对于Hp感染引起的人胃GES-1细胞损伤,高浓度姜黄素可导致细胞存活率的下降。因此,姜黄素对Hp和脲酶的抑制作用仍不足以缓解Hp对人胃GES-1细胞的损伤。可以考虑将具有促进胃黏膜细胞增殖作用的活性物质与姜黄素协同使用,以修复Hp对胃黏膜细胞造成的损伤。
