基于膜滤法处理的预发酵椰子水促进细菌纤维素合成机理
2020-01-07傅美娟罗佳茜李从发刘四新
傅美娟,邓 健,罗佳茜,林 雪,李从发,刘四新,2,*
(1.海南大学食品科学与工程学院,海南 海口 570228;2.海南大学理学院,海南 海口 570228)
细菌纤维素(bacterial cellulose,BC)是某些细菌合成的由多个D-吡喃葡萄糖分子通过β-1,4糖苷键连接聚合而成的葡聚糖,呈高度持水的凝胶状[1]。其生物合成的途径主要包括4步:聚合、分泌、装配、结晶。合成过程中涉及到几个关键酶(如尿苷二磷酸葡萄糖焦磷酸化酶、纤维素合成酶、葡萄糖激酶、异构酶等)和多种代谢途径(如磷酸戊糖途径、糖酵解途径、三羧酸循环和糖异生作用),图1是早期研究时木醋杆菌(现在名称为木驹形杆菌[2])合成BC的主要碳代谢途径[3]。
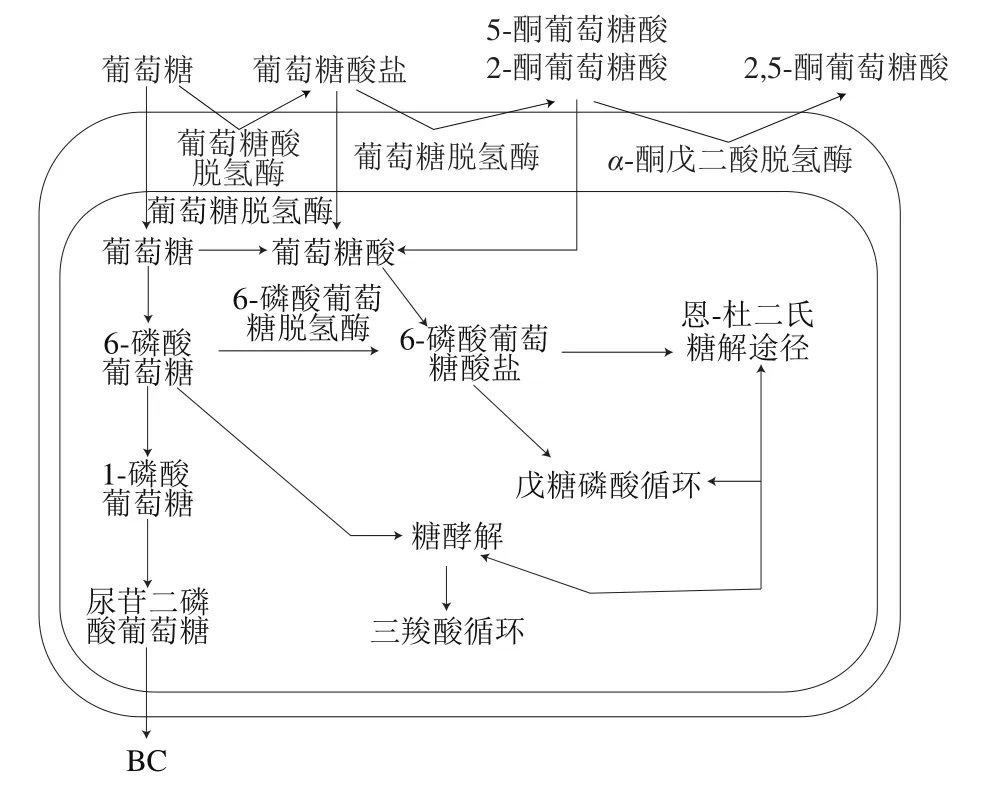
图1 木醋杆菌合成BC的代谢途径Fig. 1 Biosynthesis pathways of bacterial cellulose by Acetobacter xylinum
目前,BC在国内食品工业中应用最广泛,被称为椰纤果、椰果、椰子凝胶等[4]。BC是区别于植物纤维素(常含半纤维素、木质素等)的纳米级高纯度纤维素,其具有高纯度、高结晶度和聚合度、抗张强度、保水性、生物可降解性和生物适应性等优良特性[5-9],所以BC被高附加值地应用于高级造纸、生物医药、医学组织工程材料和纺织材料等研究领域[10-12]。因此对于BC的高效发酵工艺及其调控机制研究十分必要。
用于发酵生产BC的研究涉及到各种原料,均以提高产率和降低成本为目标[13],包括椰子水[14]、酒厂废水[15]、玉米浆[16]、果汁[17]、水解液[18]等,其中以椰子水为主要原料产量最高、效率最好。由于椰子水主要产于热带地区且不易贮存,因此,目前对于椰子水高效合成BC方面的研究鲜有报道。本团队前期一直从事椰子水基质合成BC的研究,发现新鲜椰子水(natural coconut water,NCW)需经过自然预发酵过程,才能成为较好的合成BC的培养基原料,发酵生产的得率最终呈倍数增长[19-20]。Zhang Jiaochao等[21]、杨一冲[22]采用宏基因组学方法研究椰子水自然预发酵过程中微生物的组成及动态变化,发现其中存在乳酸菌、酵母菌、醋酸菌等各类种属不同的复杂微生物区系。本研究提出以膜过滤法处理预发酵椰子水(fermented coconut water,FCW),有效避开“热效应”的不利影响和干扰,以探究FCW中菌体及其代谢产物对BC的合成作用,为进一步探明促进BC合成的“关键成分”及其调控影响机制提供新的研究思路和重要参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
NCW:海口集市批发椰子果,破壳取水,3 层纱布过滤,迅速分装至干净的矿泉水瓶中,置于-20 ℃速冻备用。
FCW:将已分装至矿泉水瓶的新鲜椰子水存于室温下,使其自然发酵至7 d,于-20 ℃速冻备用。
椰冻驹形杆菌(Komagataeibacter nataicola)Y19由海南大学食品生物技术实验室保藏[23]。
硫酸铵、硫酸镁、磷酸二氢钾、蔗糖、冰醋酸、氢氧化钠(均为分析纯) 广州化学试剂公司;葡萄糖酸、D-酒石酸、草酸、L-苹果酸、L-乳酸、乙酸、柠檬酸、琥珀酸(均为色谱纯) 北京索莱宝科技有限公司;甲醇(色谱纯) 美国Tedia公司;仲辛醇(色谱纯) 美国阿拉丁试剂公司。
1.1.2 培养基
BC发酵培养基:3 g/L (NH4)2SO4、0.3 g/L MgSO4·7H2O、0.3 g/L KH2PO4,50%椰子水(新鲜/预发酵),50%蒸馏水,pH 5.0,调节糖度至6 °Brix。115 ℃灭菌15 min。
1.2 仪器与设备
PB303-N电子分析天平、Delta320-S pH计 梅特勒-托利多仪器有限公司;Biofuge primo R高速冷冻离心机 赛默飞世尔科技有限公司;SPX智能型生化培养箱 宁波江南仪器厂;G154DW自动压力蒸汽灭菌锅 致微(厦门)仪器有限公司;SW-CJ超净工作台 苏州佳宝净化工程设备有限公司;1200液相色谱仪、HP6890/5973N气相色谱-质谱联用仪 美国Agilent公司。
1.3 方法
1.3.1 FCW膜滤处理及培养基的设置
将FCW在9 000 r/min条件下离心20 min后,取上清液配制BC发酵培养基,以0.45 µm膜抽滤除菌得到膜滤上清液组培养基(以下简称FCW-M);取离心菌体及滤膜上截留菌体添加(带滤膜)至NCW中,得到菌体组BC发酵培养基(以下简称FCW-P),分别设NCW和FCW培养基为阴性和阳性对照,每个组设3 个重复。全部培养基调pH 5.0,后三者经121 ℃、15 min灭菌。
1.3.2 BC的发酵及产量测定
将已活化好的Y19二级种子液以2%接种量分别接种到上述4 种发酵培养基中(100 mL三角瓶装液量50 mL),30 ℃静置培养7 d,回获BC膜。
水洗、浸泡于NaOH稀溶液中80 ℃水浴保温直至BC膜呈乳白色,依次以稀乙酸中和、去离子水洗直至pH值呈中性,置于80 ℃烘箱烘至恒质量。产量以干质量(g/L)计。
1.3.3 气相色谱-质谱测定条件
色谱条件:DB-5毛细管柱(60 m×0.25 mm,0.25 µm);恒定流速1.0 mL/min;进样口温度250 ℃;载气为氦气(99.999%);程序升温:初始温度40 ℃,保持6 min,以3 ℃/min升温至120 ℃,然后以4 ℃/min升温至230 ℃。
质谱条件:电子电离源;电子能量70 eV;质量扫描范围30~450 u;采集方式为全扫描;溶剂延迟3 min。
定性定量分析:采用对总离子流色谱图中的各个峰经质谱扫描后的质谱图,与质谱仪自带的数据处理系统MSWORKSTATION version7.0.NIST谱库检索,并结合保留指数和查阅相关文献进行人工谱图解析,定性分析,获得初步的鉴定结果。样品定量分析采用内标法。
1.3.4 高效液相色谱法测定有机酸组成
分别测定FCW-M和NCW中的有机酸组成。将待测样品于9 000 r/min离心20 min,取上清液经0.22 µm微孔滤膜过滤到进样瓶中,进样量10 µL,结果用回归方程计算各成分含量。
色谱条件:Z O R B A X-S B-A q色谱柱(250 mm×4.6 mm,5 μm);紫外检测器;检测波长210 nm;柱温30 ℃;流速0.8 mL/min,流动相为pH 2.3磷酸溶液;进样量10 µL。采用外标法进行定量分析。
1.4 数据处理
采用SPSS Statistics V20.0软件进行均值、方差分析和Pearson相关性分析,采用Duncan检验方法(P<0.05,差异显著;P<0.01,差异极显著);使用GraphPad Prism 5.0软件绘图。
2 结果与分析
2.1 FCW-M组和FCW-P组对BC合成的影响
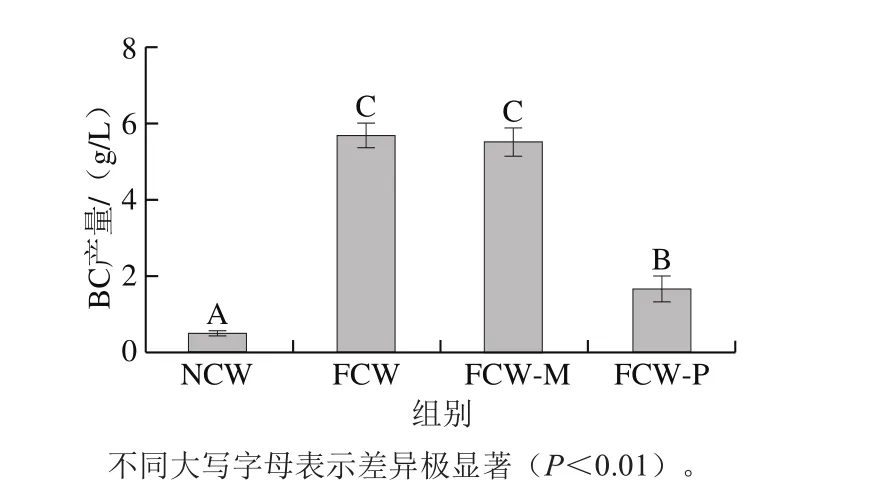
图2 预发酵7 d的FCW中上清液和菌体对BC合成的影响Fig. 2 Effects of filtrate and bacterial cell residue of 7 d fermented coconut water on BC synthesis
如图2所示,膜滤液组FCW-M的BC产量为阴性对照组NCW的10 倍,呈极显著差异,而只比阳性对照组FCW产量稍低,但无极显著差异(P>0.01),说明膜滤液中含有与未经过滤的FCW几乎相同,且对BC合成有极显著促进作用的未知成分。FCW-P的BC产量仅有1.56 g/L,但从差异分析上发现,与阴性对照组NCW也存在极显著性(P<0.01),可能是因为菌体经热灭菌后死亡、崩解,菌体碎片提供了BC发酵合成的生长因子等营养成分,但其对BC的促进显著弱于FCW-M组(增产10 倍)和FCW组(增产10.5 倍)。说明椰子水经过预发酵后显著促进BC合成的主要贡献来自预发酵中微生物的未知代谢产物,而且可能涉及BC合成代谢通路上的调控因子,而非普通的菌体生长营养成分(如氨基酸核苷酸类等生长因子)。
2.2 预发酵时间对FCW-M组和FCW-P组合成BC影响程度的比较
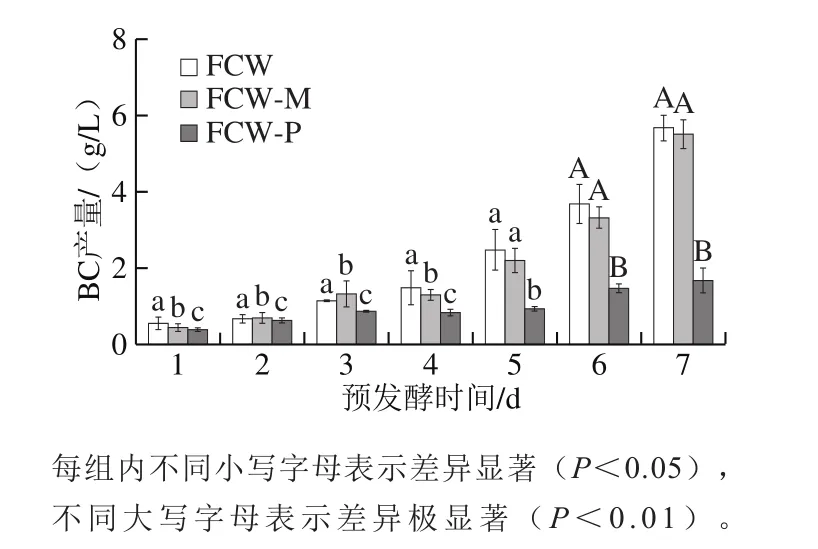
图3 预发酵过程中FCW-M和FCW-P对BC产量的影响Fig. 3 Effects of filtrate and bacterial cell residue with different fermentation times on BC yield
2.1 节仅表明预发酵时间7 d时的FCW中FCW-M组对BC合成有显著促进作用,故继续探究预发酵过程中(1~7 d)每个时间点是否都存在类似的规律,如图3所示,预发酵前4 d 3 组BC产量差异显著(P<0.05),FCW-M组对BC产量的促进作用没有得到体现,预发酵后期(5~7 d)FCW组和FCW-M组的BC产量明显提高,FCW-M组第3天的BC产量较第1天仅提高2.8 倍,直到第7天提高12.5 倍,此时组内显著性差异分析发现,预发酵第5天时FCW组的BC产量与FCW-M组无显著性(P>0.05),与FCW-P组存在显著差异(P<0.05),预发酵第6、7天时FCW组与FCW-P组的差异达到极显著(P<0.01)。结果表明,FCW-M组对BC产量的促进作用主要集中在预发酵后期,推测可能是FCW-M中不同种微生物积累的某类“促进作用”代谢产物不断增加,也可能是某一类微生物所产该“促进作用代谢产物”浓度不断增大。上清液和菌体促进BC合成的时间响应程度差异再次说明促进BC合成贡献最大的是FCW-M,而非菌体,推测预发酵过程产生了对BC合成有重要调控作用的代谢产物。
并且实验发现膜滤的速度随椰子水预发酵时间而显著不同,呈逐渐加快的趋势,预发酵1、3、5 d和7 d的椰子水膜滤平均速率约为0.33、6、10 mL/min和15 mL/min,推测预发酵过程中,微生物将椰子水中的糖类、蛋白质类以及其他可能的带黏性类物质逐渐分解利用,使体系的黏度降低,而加快了过滤除菌的速度。椰子水培养基体系的黏度变化是否对BC合成产生影响,以及预发酵超过7 d后的BC产量情况,值得进一步研究。
2.3 FCW-M的成分分析

图4 NCW(A)和FCW-M(B)的气相色谱-质谱总离子流图Fig. 4 GC-MS total ion current chromatograms of NCW (A) and FCW-M (B)

表1 GC-MS分析结果Table 1 GC-MS analysis of volatile compounds of NCW and FCW-M
2.1 节和2.2节结果表明FCW-M对BC的产量有显著促进作用,说明预发酵过程产生了对BC合成有重要调控作用的代谢产物。因此对NCW、FCW-M进行气相色谱-质谱联用法分析比较,结果如图4、表1所示。NCW共检出76 种化合物,醇类和醛类所占比例最大,达2/3以上,醇类相对含量约为46%。FCW-M共检出66 种化合物,醇类相对含量最高,约占62%。从化合物的总含量上分析,NCW中能检出的挥发性成分含量较少,FCW-M中的成分总量约为NCW的5 倍。FCW-M中的醇类及酸类的含量远超过NCW,但醛类相对含量远低于NCW,说明椰子水经预发酵后醇类和酸类物质变化较大。FCW-M中的醇类物质以乙醇为主,酸类物质以乙酸为主,FCW-M中的乙醇质量浓度(2 149.615 µg/L)是NCW(483.416 µg/L)的4.5 倍,乙酸质量浓度(522.808 µg/L)是NCW(10.95 µg/L)的48 倍,乙酸、乙醇质量浓度的增加与BC产量的提高具有一致性,说明乙酸和乙醇可能参与菌种Y19的代谢调节而影响BC的合成。另一方面,预发酵后醛类物质减少,也可能减弱了BC合成过程中的负调控,值得深入研究。
根据国内外其他人的研究,Li Yuanjing等[24]为改善BC的合成,在发酵过程中将乙醇和柠檬酸钠加入培养基中,指出乙醇快速氧化所产生的高能荷三磷酸腺苷(adenosine triphosphate,ATP)是戊糖磷酸途径中6-磷酸葡萄糖脱氢酶的抑制剂,从而使代谢流量更多的进入BC合成方方。Sakurai等[25]采用DNA微阵列技术分析了乙醇作用下A. acetiNBRC 14818细胞生长过程中转录组的变化,结果发现细胞开始氧化乙醇后,乙醛酸途径酶基因显著上调,说明该途径对乙醇作为碳源的利用具有重要意义。Mohammadkazemi等[26]研究乙酸对K. xylinusI 2281合成BC的影响,表明乙酸可以被活化成乙酰辅酶A进入乙醛酸途径,经糖异生作用形成葡萄糖,而利于BC的生物合成。类似的还有张丽平等[27]研究发现乳酸、乙酸、苹果酸等对木醋杆菌合成BC有促进作用,马霞等[28]研究发现培养基中含有乳酸盐或甲硫氨酸,能加速细胞生长,提高纤维素产量。因此,推断椰子水经预发酵后乙酸和乙醇含量的增加对BC的合成途径具有一定的正调控作用。
2.4 椰子水预发酵过程中有机酸的变化分析
图5结果显示,在椰子水整个预发酵过程中乙酸、乳酸和葡萄糖醛酸为主体酸,含量较丰富,其次是柠檬酸、苹果酸、酒石酸和琥珀酸等。椰子水经预发酵后其中乳酸及乙酸含量呈持续上升趋势,表明FCW中乳酸菌、酵母菌及醋酸菌生长活跃。BC产量(图2)结果与此对应,将FCW 1、3、5 d和7 d的BC产量与乙酸、乙醇含量经Pearson相关性分析(图6)可知,乙酸和乳酸含量与BC产量呈正相关,相关系数分别为0.690和0.712,可能说明乳酸和乙酸的增长对BC合成起到促进作用。BC合成是一个需要消耗大量ATP的过程,乳酸和乙酸可进入三羧酸循环,参与胞内代谢并产生大量ATP,较多的能量可以促进BC的合成[29-30]。经过1~2 d预发酵后椰子水中葡萄糖酸含量降低,至第3天达最低,此时其BC产量(图2)增长也达显著。葡萄糖酸是葡萄糖-6-磷酸的氧化产物,其含量的降低说明葡萄糖-6-磷酸进入经变位酶后生成尿苷二磷酸葡萄糖的途径,从而使BC得以顺利合成、显示其产量进入快速增长阶段[31-32]。柠檬酸、琥珀酸、苹果酸和草酸等几种有机酸在发酵过程中变化不显著,这些有机酸是三羧酸循环中常见的中间产物,从对BC的合成途径影响看可能性不大,说明预发酵过程中产醋酸、乳酸的微生物可能对BC产量的影响较大。

图5 椰子水预发酵过程中FCW-M的有机酸含量Fig. 5 Changes in organic acid contents of FCW-M during the fermentation of coconut water
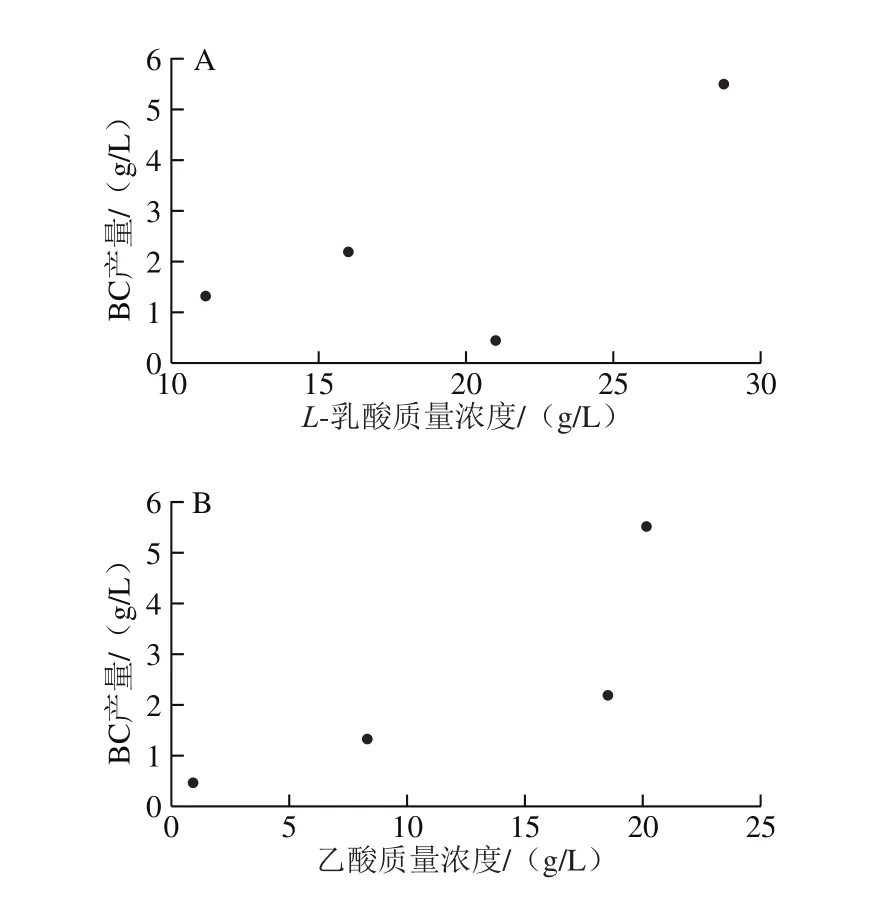
图6 BC产量与L-乳酸(A)、乙酸(B)的相关性分析Fig. 6 Correlation analysis of BC yield with L-lactic acid (A) and acetic acid (B)
3 结 论
本实验将椰子水在预发酵FCW中的菌体与上清液分开,研究其对BC合成产生显著促进性影响的可能原因。结果显示,在预发酵7 d时FCW-M组与FCW组的BC产量无极显著差异(P>0.01),而菌体沉淀组FCW-P对BC的促进作用显著弱于FCW-M组和FCW组。从不同预发酵时间角度比较时,组内显著性分析发现预发酵前期(1~4 d)FCW-M组的BC产量与FCW组差异显著(P<0.05),此时FCW-M对BC的促进作用没有得到体现,后期(5~7 d)可能由于预发酵中微生物积累的某类“促进作用”代谢产物种类不断增加或是“促进作用代谢产物”浓度不断增大,FCW-M组的BC产量与FCW组在极显著水平无差异(P>0.01),说明FCW-M中存在对BC合成有重要调控的代谢产物。因此,由进一步的气相色谱-质谱法和高效液相色谱法对FCW-M预发酵过程中的挥发性成分和有机酸成分分析,初步推测预发酵椰子水中的乙酸、乳酸和乙醇很可能参与促进BC合成的调控过程。本研究以膜滤除菌代替加热灭菌、避开“热效应”的干扰影响,揭示了椰子水预发酵中是代谢产物而非菌体对BC合成的促进性影响发挥了最关键作用的规律,解答了“预发酵过程是否提供了酵母膏样生长因子”的质疑问题。下步拟将以代谢组学技术分析FCW中的各差异代谢物,并进一步解析预发酵过程与BC合成代谢的调控过程之间的相关关系,为最终研究BC的代谢调控路径及调控机理提供理论基础。
