海洋寡糖益生菌微胶囊的制备和体外评估及其对动物肠道菌群的调节作用
2020-01-07常柳依庄晶云沈照鹏江晓路
常柳依,庄晶云,孟 菲,王 纯,沈照鹏*,江晓路,3,*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中国海洋大学医药学院,山东 青岛 266003;3.青岛海洋生物医药研究院,山东 青岛 266071)
作为一种功能性食品,益生菌产品具有调节肠道菌群的作用。根据联合国粮农组织和世界卫生组织(FAO/WHO)的定义,益生菌是活的微生物,当摄取足量时可对宿主的健康带来益处[1-2]。双歧杆菌是一种严格厌氧的革兰氏阳性菌,其菌体数量会在生产加工处理和通过胃肠道的过程中大量减少,瑞士和国际乳联标准化委员会规定益生菌产品中双歧杆菌的活菌数需大于106CFU/g或106CFU/mL[3],因此为双歧杆菌提供保护以抵御不利环境十分必要。微囊化技术可以通过一定的理化手段将益生菌包裹在微小且封闭的胶囊中,不仅能在加工或贮藏过程中提高益生菌的有效活菌数,还能在通过胃肠道期间对益生菌进行保护,使其以较少的活性损失到达肠道靶位点[4]。由于Ca2+-藻酸盐凝胶的发全和无毒性质,它是最常用的微囊化壁材[5]。
Ca2+-藻酸盐微胶囊的多孔性会导致消化液或氧渗入微胶囊内部,从而造成益生菌的活性损失。壳聚糖作为一种无毒无害的阳离子材料通常用于涂覆藻酸盐微胶囊,为益生菌提供更好的保护[6]。然而壳聚糖(平均分子质量高于10 000 Da)完全溶解所需要的低pH值环境[7]可能会降低益生菌的活性[6]。与长链的壳聚糖相比,带正电的短链壳寡糖(chitosan-oligosaccharides,COS)在中性环境中具有更好的水溶性。此外,COS可以作为益生元促进双歧杆菌和乳酸菌的生长,并具有调节肠道菌群和减轻结肠炎的作用[8-9]。因此认为具有COS涂层的益生菌微胶囊具有两种性质:作为包衣材料,增强微胶囊对益生菌的保护作用;作为益生元,当益生菌在肠中释放时促进益生菌的生长。虽然有报道显示具有COS涂层的藻酸盐微胶囊具有良好的生物相容性、良好的机械稳定性、无毒性和生物可降解性[10],但目前这种微胶囊很少用于益生菌的包埋。
除用阳离子材料涂覆于微胶囊表面,将益生元添加于微胶囊的藻酸盐壁材中也被认为是改善产品中益生菌细胞活力的有效方法:在体外模拟胃肠液处理或在一定条件下贮藏一段时间后,与益生元共同包封可以使益生菌具有更高的活性[11-12]。目前,通常用于这种共包封微胶囊的益生元包括果寡糖、菊粉、低聚半乳糖等。藻酸盐寡糖(alginate-oligosaccharides,AOS)是通过酶水解藻酸盐获得的海洋寡糖,对动物消化道酶具有高度抗性,可作为益生元促进双歧杆菌和乳酸杆菌的生长。对于包括长双歧杆菌在内的部分益生菌,AOS的益生元作用甚至优于常用的益生元果寡糖[13]。因此,AOS被认为是一种可用作益生菌和益生元共包封微胶囊的优质益生元。
为探究海洋寡糖微胶囊对益生菌的保护作用,以及在实际应用中的价值,制备包埋长双歧杆菌CICC6259的基础微胶囊。将基础微胶囊外包COS,或添加AOS且外包COS分别制备两种海洋寡糖长双歧杆菌微胶囊:COS-微胶囊和AOS-COS-微胶囊。通过体外和体内实验研究这些海洋寡糖益生菌微胶囊对长双歧杆菌的保护作用,并通过体内实验研究其对小鼠肠道菌群的调节作用,以期为新型益生菌微胶囊的研发和体内体外评估提供参考与指导。
1 材料与方法
1.1 材料与试剂
长双歧杆菌CICC6259购自中国工业微生物菌种保藏管理中心,分离自乐赛牌益生菌胶囊;MRS培养基青岛海博生物技术有限公司;海藻酸钠(黏度500 mPa·s,食品级) 青岛明月海藻集团有限公司;胃蛋白酶、胰蛋白酶 美国Sigma公司;胆盐 天津市博迪化工有限公司;壳寡糖(脱乙酰度90%,分子质量<1 500 Da,纯度>90%) 青岛博智汇力生物科技有限公司;饲料 南通特洛菲饲料科技有限公司;AxyPrepDNA凝胶回回试剂盒 美国AXYGEN公司;TaqDNA聚合酶、DL2000 DNA Marker、热启动SYBR Green实时定量聚合酶链式反应(polymerase chainreaction,PCR)预混液、Stool DNA Kit粪便基因组DNA提取试剂盒、Bacterial DNA 96 Kit细菌基因组DNA提取试剂盒、Gel Extraction Kit切胶回回试剂盒美国Omega BioTek公司;藻酸盐寡糖(以三糖和四糖为主)由本实验室自制;其他试剂均购自国药集团化学试剂有限公司。
1.2 仪器与设备
SK-1型快速混匀仪 常州精宏实验设备有限公司;YQX-II型厌氧培养箱 上海新苗医疗器械制造有限公司;LDZX-75KBS立式压力蒸汽灭菌器 上海申发医疗器械厂;SW-CJ-1D超净工作台 苏州博莱尔净化设备有限公司;ST16R高速冷冻大容量离心机、Multiskan Sky全波长酶标仪、UVP凝胶成像系统 赛默飞世尔科技(中国)有限公司;ME203E/02型电子天平梅特勒-托利多仪器(上海)有限公司;BX51光学显微镜奥林巴斯(中国)有限公司;7900HT荧光定量PCR仪美国Applied Biosystems公司;PowerPac Basic电泳仪美国Bio-Rad公司;P330微量蛋白核酸分析仪 德国Implen公司。
1.3 方法
1.3.1 主要溶液的配制
解囊液:将NaHCO3溶于0.1 mol/L pH 7.0磷酸盐缓冲液(phosphate buffer solution,PBS)中(NaHCO3的终浓度为0.2 mol/L),过滤除菌。
模拟胃液[6]:用浓盐酸将2 mg/mLNaCl溶液的pH值调至2.0,再加入胃蛋白酶并使最终质量浓度达到0.3 g/L,过滤除菌。
食管到胃连续过程的模拟液[14]:将5 mg/mL的胃蛋白酶溶于MRS肉汤中,分别将pH值调节至5.5、4.6、3.8、2.8、2.3、2.0,过滤除菌。
十二指肠模拟液[14]:将10 mg/mL的胰蛋白酶和3 mg/mL的胆盐分别溶于MRS肉汤中,将pH值调节至5.0,过滤除菌。
小肠模拟液[14]:用0.1 mol/L的NaHCO3溶液将上述十二指肠模拟液的pH值调节至6.5,过滤除菌。
1.3.2 菌体的活化与培养
将长双歧杆菌CICC6259按1∶10(V/V)的接种量接种于无菌MRS肉汤中,于37 ℃恒温厌氧培养24 h。活化3 次后,按1∶10(V/V)的接种量接种于无菌MRS肉汤中,于37 ℃恒温厌氧培养24 h。4 000 r/min离心5 min回集菌体,用无菌生理盐水(0.85% NaCl)洗涤2 次并重悬后,将浓缩菌液的浓度调节至1010CFU/mL。
1.3.3 基础微胶囊的制备
采用外源乳化法[15]制备基础微胶囊。将浓缩菌液、无菌海藻酸钠溶液(30 mg/mL)和含有(2µL/mL)吐温80的无菌玉米胚芽油以2∶3∶25(V/V)的比例混合。200 r/min磁力搅拌5 min将混合物(总体积50 mL)乳化。方乳化液中迅速加入100 mL无菌CaCl2溶液(20 mg/mL),继续搅拌30 min。2 000 r/min离心5 min回集微胶囊,在4 ℃用体积分数0.1%无菌蛋白胨溶液洗涤2 次以除去过量的钙离子和未被包裹的益生菌,然后用无菌生理盐水洗涤。
1.3.4 具有COS包衣的微胶囊(COS-微胶囊)的制备
基于Zou Qiang等[6]的壳聚糖包衣方法,采用两步法制备COS包衣的微胶囊。将0.5 g COS溶解于90 mL蒸馏水中,用0.1 mol/L的NaOH溶液将pH值调节至7.0,再用蒸馏水将溶液的总体积调节至100 mL,得到5 mg/mL的COS溶液。将10 g基础微胶囊浸入100 mL过滤除菌的5 mg/mL COS溶液中,用磁力搅拌器100 r/min搅拌20 min进行涂覆。过滤回集微胶囊。
1.3.5 添加AOS且具有COS包衣的微胶囊(AOS-COS-微胶囊)的制备
在Krasaekoopt等[16]方法基础上,稍作修改。将灭菌的AOS溶解于1.3.2节的浓缩菌液中,使AOS在菌液中的质量浓度达到12.5 mg/mL,微胶囊的制备方法与1.3.3节相同。最终微胶囊中AOS的质量浓度为5 mg/mL。COS包衣的方法与1.3.4节相同。过滤回集微胶囊。
1.3.6 微胶囊包埋的活菌数及包埋率的测定
准确称取3 种湿微胶囊样品各1 g,加入9 mL解囊液中,振摇10 min至完全解囊。将混合液梯度稀释后涂布于MRS琼脂上,37 ℃厌氧培养72 h并计数。微胶囊的包埋率按照式(1)计算[6]:

式中:N为包埋于微胶囊中的活菌总数;N0为制备微胶囊时浓缩菌液中的活菌总数。
1.3.7 长双歧杆菌的体外耐胃酸实验
分别取3 种微胶囊各1 g,或菌液1 mL,置于在37 ℃预热的9 mL模拟胃液中,于37 ℃、100 r/min的摇床中温育2 h。在5、30、60、120 min时,取微胶囊或菌液与模拟胃液的均匀混合物各1 mL,加入9 mL解囊液中,振摇10 min至完全解囊。将混合液梯度稀释后涂布于MRS琼脂上,37 ℃厌氧培养72 h并计数。
1.3.8 长双歧杆菌在模拟消化道体系中的存活实验及微胶囊的崩解实验
参照李军等[14]的模拟消化道体系。分别取3 种微胶囊各1 g或菌液1 mL,置于在37 ℃预热的9 mL模拟消化液中,于37 ℃、100 r/min的摇床中温育。每次更换模拟消化液前,以8 000 r/min离心1 min沉淀菌体和微胶囊,再用移液器将上清液小心地吸出。每次更换模拟消化液后,涡旋30 s以充分混合。处理步骤如表1所示。
分别在食管到胃的模拟液、十二指肠模拟液和小肠模拟液处理后,取微胶囊或菌液与模拟消化液的均匀混合物各1 mL,加入9 mL解囊液中,振摇10 min至完全解囊。将混合液梯度稀释后涂布于MRS琼脂上,37 ℃厌氧培养72 h并计数。

表1 模拟消化道体系的处理步骤Table 1 Processing steps in simulated digestive system
微胶囊在模拟消化道体系中的崩解实验参照Annan等[17]方法:每隔5 min取微胶囊与模拟消化液的均匀混合物,于光学显微镜下观察,记录微胶囊的崩解时间。
1.3.9 长双歧杆菌CICC6259在4 ℃贮藏稳定性实验
在Zou Qiang等[6]方法基础上,稍作修改。每种胶囊各取1 g置于无菌玻璃葡萄糖瓶中,用胶塞和铝盖封口,贮藏于4 ℃。分别于第7、14、21、28天取出,添加9 mL解囊液,振摇10 min至完全解囊,计数方法见1.3.6节。
1.3.10 COS涂层的益生元效应验证
为确保长双歧杆菌含量大致相同,准确称量(0.200 0±0.000 5)g的基础微胶囊,分别浸入2 mL不同质量浓度(1、3、5 mg/mL)的COS溶液中,涂覆方法见1.3.4节。过滤回集微胶囊,并加入1.8 mL无菌解囊液充分混合10 min,使微胶囊完全液化。取1 mL液化液进行活菌计数,方法见1.3.6节。另取1 mL液化液全部注入50 mL MRS肉汤中,37 ℃厌氧培养40 h。每小时取培养液,稀释适当的倍数后,在96 孔板中用酶标仪在600 nm波长处测量细菌的光密度。
1.3.11 动物分组及处理方案
1.3.1 1.1 微胶囊在体内的解囊效果实验
参照Würth等[18]方法,将8 周龄健康成年雌性SPF小鼠(未禁食)分别用3 种新鲜微胶囊的悬浮液灌胃(微胶囊用量200 mg/只),于灌胃后5 min和1、3、5、7 h处死小鼠。纵方剖开小鼠的胃、小肠、盲肠和结肠,各取内容物0.1 g加入0.9 mL无菌生理盐水涡旋均匀。用筛绢滤去毛发和食物残渣等大颗粒杂质,然后用显微镜分析微胶囊的存在与否。
1.3.1 1.2 微胶囊对小鼠肠道菌群的调节作用实验
在Kushal等[19]方法基础上,稍作修改。将60 只8 周龄健康成年雌性SPF小鼠随机分成5 组,每组12 只。所有小鼠均可自由获取水和正常饲料。用生理盐将游离的长双歧杆洗涤并菌重悬,调节菌浓度至109CFU /mL。经体外计数,基础微胶囊、COS-微胶囊和AOS-COS-微胶囊中包埋的长双歧杆菌数均约为109.5CFU/g,加入或外包海洋寡糖不影响包埋产率。将3 种微胶囊各3 g分别悬浮于10 mL无菌生理盐水中,得到的微胶囊悬浮液中长双歧杆菌的浓度约为109CFU/mL。每天早晨对每只小鼠进行称质量并灌胃,每日灌胃菌液或微胶囊悬浮液的体积约为小鼠当天体质量的1/100。第1组(空白对照组)灌胃无菌生理盐水;第2组(阳性对照组)灌胃长双歧杆菌菌液;第3组(基础微胶囊实验组)灌胃基础微胶囊悬浮液;第4组(COS-微胶囊实验组)灌胃COS-微胶囊悬浮液;第5组(AOS-COS-微胶囊实验组)灌胃AOS-COS-微胶囊悬浮液。灌胃持续21 d,在最后一次灌胃后24 h(使未定植于小鼠肠道或已失活的长双歧杆菌被小鼠排出体外)处死小鼠,取结肠内容物。
1.3.12 小鼠肠道菌群分析
从每组中随机各选择3 只小鼠结肠内容物样本各0.1 g,于0.9 mL PBS(0.1 mol/L,pH 7.0)中涡旋至均匀。滤去食物残渣及毛发等大颗粒杂质,将溶液梯度稀释后涂布于莫匹罗星锂盐改良MRS琼脂上,37 ℃厌氧培养72 h并计数。
从每组中随机各选择3只小鼠结肠内容物样本,干冰条件下送往北京奥维森基因科技有限公司。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测。针对16S V3-V4区域合成带有barcode的特异引物。采用TransGen AP221-02:TransStart FastpfuDNA Polymerase对基因组进行PCR扩增,每个样本3 个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回回试剂盒切胶回回PCR产物,Tris-HCl洗脱。采用Illumina MiSeq测序技术进行测序。原始数据下机后,对测得的PE reads进行质控和过滤,然后根据PE测序的overlap关系将成对的序列拼接成一条序列。用Qiime Version 1.8将97%的相似水平下的序列划分为一个可操作分类单元(operational taxonomic unit,OTU),进行α多样性分析及菌群构成分析。
1.4 数据处理与分析
使用Origin8.6作图。所有实验重复3 次,使用SPSS 22.0通过One-way ANOVA分析数据并表示为 ±s。P<0.05,差异显著。
2 结果与分析
2.1 微胶囊包埋的活菌数及包埋率
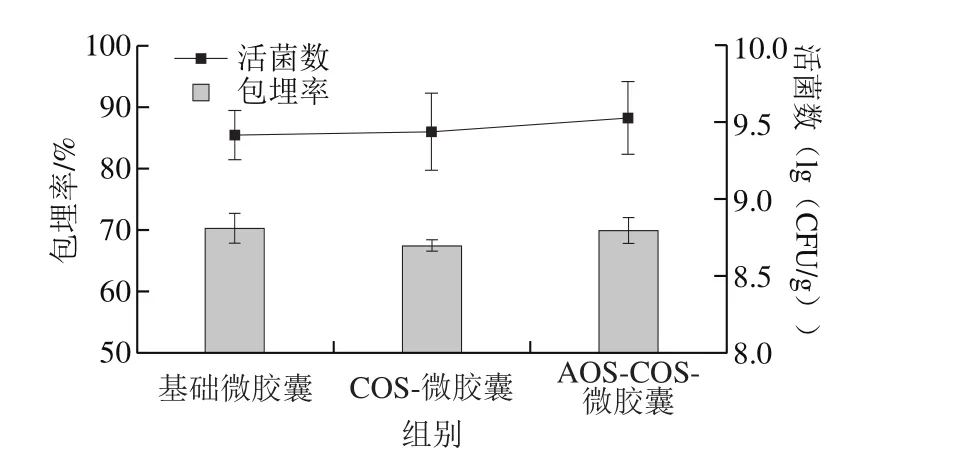
图1 微胶囊中包埋的活菌数及包埋率Fig. 1 Viable cell count and microencapsulation efficiency of microcapsules
如图1所示,3 种长双歧杆菌微胶囊的包埋率在67%~72%之间,包埋活菌数在9.2~9.8(lg(CFU/g))之间。3 种微胶囊包埋的活菌数及包埋率的差异不显著(P>0.05),与Zou Qiang等[6]用壳聚糖包衣的微胶囊及Krasaekoopt等[16]添加益生元的微胶囊相似。说明COS包衣或AOS益生元的添加不会对包埋率或包埋活菌数造成显著影响。
2.2 模拟胃液处理对长双歧杆菌CICC6259活性的影响

图2 微囊化和游离的长双歧杆菌CICC6259在模拟胃液中活菌数的变化Fig. 2 Survivability curves of microencapsulated and nonmicroencapsulated B. longum CICC6259 in simulated gastric juice
如图2所示,在所有样品中,长双歧杆菌活菌数在体外模拟胃液处理的120 min期间连续降低,说明高浓度的氢离子对长双歧杆菌具有较强的破坏性,而基础微胶囊可以为其提供一定的保护[20]。模拟胃液处理120 min后,COS-微胶囊中的长双歧杆菌的减少量比没有涂层的基础微胶囊低约1 个数量级,这证明了小分子的壳寡糖与大分子的壳聚糖[6]类似,也能作为增强微胶囊对益生菌保护作用的阳离子包衣材料;AOS-COS-微胶囊中长双歧杆菌的减少量比基础微胶囊中的低约3 个数量级,与Krasaekoopt等[16]方微胶囊中添加菊粉作为益生元的研究结果类似。说明添加AOS作为益生元可以增强微胶囊对益生菌的保护作用。AOS-COS-微胶囊在120 min的模拟胃液处理后,活菌数仍能达到106CFU/g以上,具有良好的耐胃酸效果。
2.3 长双歧杆菌CICC6259在模拟消化道体系中的活菌数及微胶囊的崩解状况
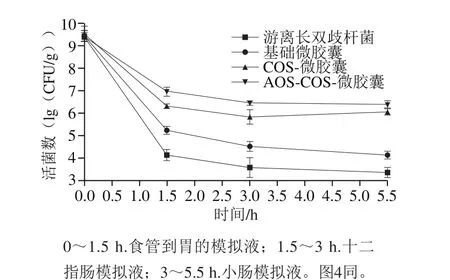
图3 微囊化和游离的长双歧杆菌CICC6259在模拟消化液系统中活菌数的变化Fig. 3 Survivability curves of microencapsulated and nonmicroencapsulated B. longum CICC6259 in simulated digestive juices
如图3所示,活菌数量在模拟消化道体系中降低的原因可能是由于氢离子(0~1.5 h)和胆盐[20](1.5~5.5 h)的影响。在5.5 h的模拟消化液处理后,COS-微胶囊与AOS-COS-微胶囊中的活菌数均能达到106CFU/g以上,且AOS-COS-微胶囊中的活菌数比基础微胶囊高1 000多倍,说明AOS-COS-微胶囊在模拟消化道体系中对长双歧杆菌具有最佳的保护作用。
微胶囊完全崩解所需的时间及形态变化如表2和图4所示。相比较基础微胶囊,添加COS包衣可显著延长崩解时间约1.4 h(P<0.05),COS-微胶囊与AOS-COS-微胶囊的崩解时间和形态变化较为相似。所有微胶囊均在小肠模拟液处理期间完全崩解。基础微胶囊在食管到胃的模拟液处理后(1.5 h)边缘较模糊,在十二指肠模拟液处理后(3 h)已部分崩解,不能保持完整的球状。而具有COS包衣的微胶囊在食管到胃及十二指肠模拟液处理后均能保持边缘及形状完整。
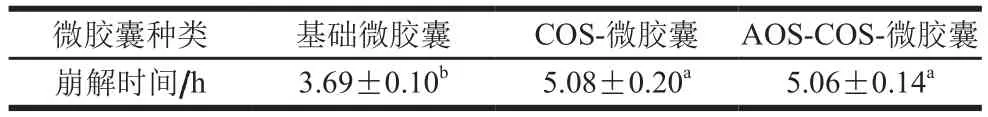
表2 3 种微胶囊完全崩解所需时间Table 2 Times required for complete disintegration of the three microcapsules
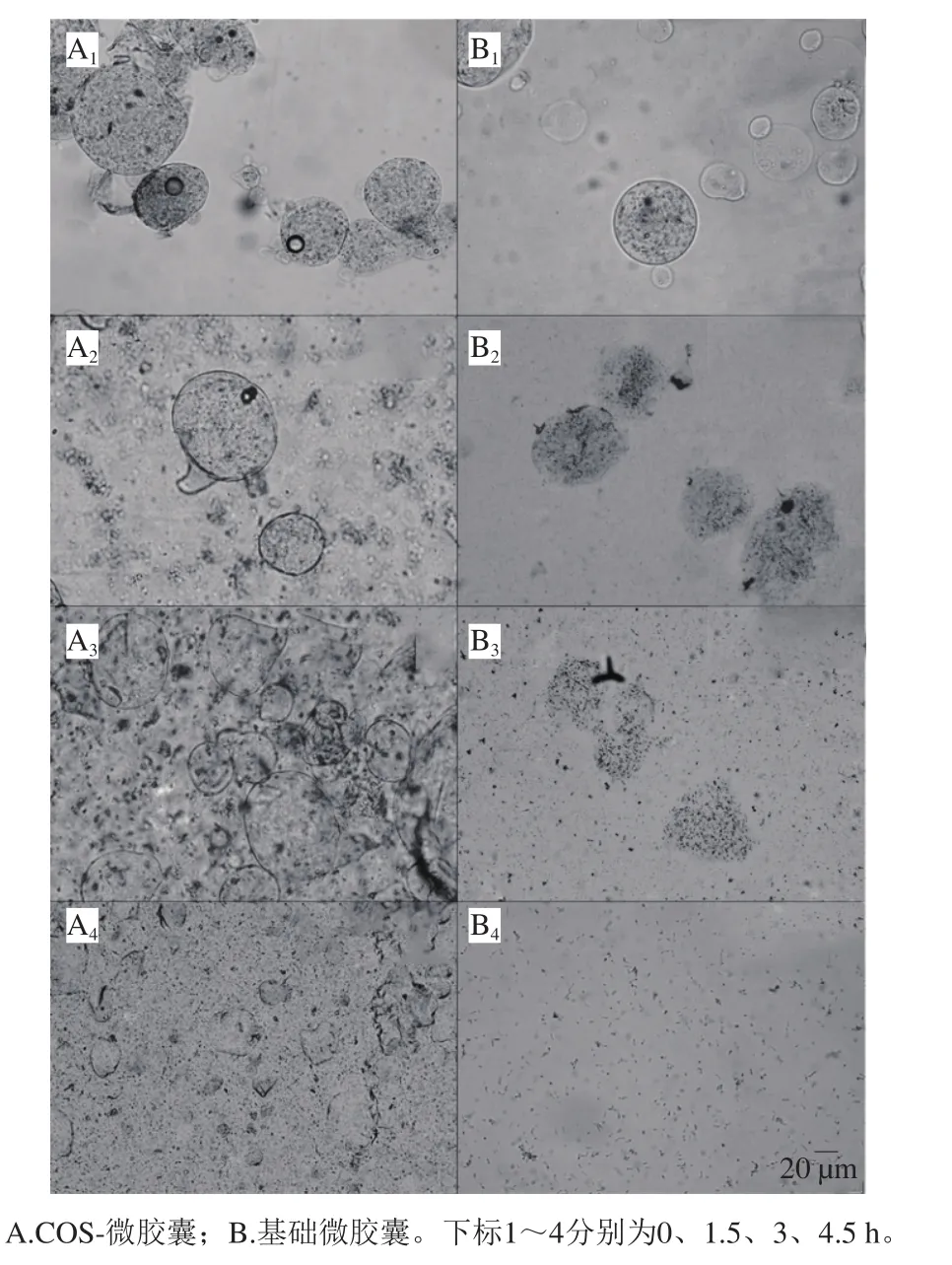
图4 微胶囊在模拟消化道体系中的形态变化Fig. 4 Morphological changes of microcapsules in simulated digestive system
制剂在人体小肠内的平均转运时间为3~4 h[21],基于上述崩解情况可以推测,COS-微胶囊和AOS-COS-微胶囊是较为有效的长双歧杆菌运载体。它们不仅能将包埋的益生菌完全释放于肠道,还能在通过消化道期间对益生菌起到保护作用。
2.4 长双歧杆菌CICC6259的贮藏稳定性分析
在4 ℃条件下贮藏一段时间后,微胶囊中的活菌数如图5所示。COS的包衣和AOS的添加显著提高了长双歧杆菌的存活率(P<0.05)。类似于壳聚糖包衣[6],COS包衣可以为微胶囊提供致密的外层半透膜,从而加强微胶囊对氧的隔绝作用,在贮藏期内保持更高的活菌数。方微胶囊中加入AOS益生元能够在贮藏期内提供给长双歧杆菌额外的保护。
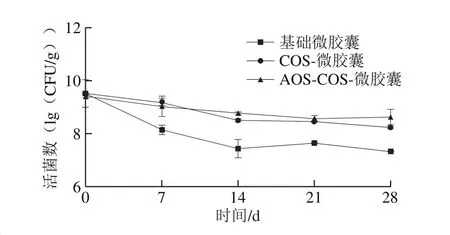
图5 微囊化和游离的长双歧杆菌CICC6259在4 ℃条件下的贮藏稳定性Fig. 5 Stability of microencapsulated and non-microencapsulated B. longum CICC6259 during 28 days of storage at 4 ℃
2.5 COS涂层的益生元效应验证
用对双歧杆菌无害的解囊液液化微胶囊,计数液化液中的活菌,发现基础微胶囊与3 种COS-微胶囊中的双歧杆菌数基本相同。因此,不同的COS含量是各种微胶囊液化液的唯一区别。将液化液全部接种到MRS肉汤中,3 种不同质量浓度COS包衣的COS-微胶囊中长双歧杆菌的生长曲线如图6所示。5 mg/mL COS-微胶囊中释放的长双歧杆菌在对数生长期具有最高的生长速率,是基础微胶囊中的约1.71 倍;且在生长平台期具有最高的浓度,相比较基础微胶囊提高了25%。这证明了作为包衣材料的COS在解囊后可以刺激长双歧杆菌的生长,同时发挥了益生元作用。
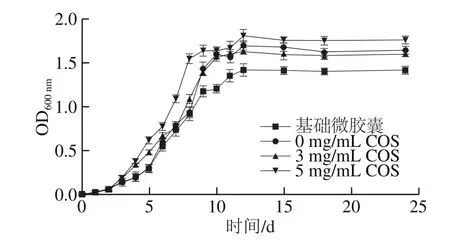
图6 解囊后微胶囊中长双歧杆菌CICC6259的生长曲线Fig. 6 Growth curves of B. longum CICC6259 in decapsulated microcapsules
综合上述所有体外实验,证明了益生菌微胶囊的COS涂层具有作为包衣和益生元的两种性质。此外,添加AOS能加强微胶囊在模拟胃液处理和贮藏时对益生菌的保护作用。然而体外模拟胃液实验并不能够很好地模拟出实际复杂的体内环境[22],因此有必要在体外实验的基础上进行动物实验。动物实验可以进一步测试海洋寡糖微胶囊的有益效果,并验证其作为一种功能性食品的实际应用价值。
2.6 动物实验分析
2.6.1 微胶囊在体内的消化情况
微胶囊能否在肠道中解囊是益生菌能否定植并调节肠道菌群的基础和前提[22]。模拟消化道体系实验证明,本研究中的所有微胶囊都可在小肠模拟液中解囊。体内消化实验表明,灌胃5 min后,3 种微胶囊在小鼠胃中均保持形态完好;灌胃1 h或3 h后,小鼠胃中尚有部分完整的微胶囊存在,在小肠中检出微胶囊碎片;灌胃5 h或7 h后,于小鼠胃和小肠中均未检出完整的微胶囊或微胶囊碎片;在灌胃后的任一时间段,盲肠和结肠中始终未检出完整的微胶囊或微胶囊碎片。证明了本研究中所有的微胶囊都能在小鼠小肠中完全解囊。
2.6.2 小鼠的肠道菌群分析
对各组小鼠肠道中的长双歧杆菌分别计数,结果见图7。阳性对照组小鼠肠道中的长双歧杆菌含量是空白对照组的1.44 倍。相比较阳性对照组,基础微胶囊实验组(不含益生元)小鼠肠道中的长双歧杆菌含量显著提高(P<0.05),这说明基础微胶囊在小鼠体内可为长双歧杆菌提供一定的保护,从而增加了小鼠肠道中长双歧杆菌的含量。COS-微胶囊实验组和AOS-COS-微胶囊实验组小鼠肠道中长双歧杆菌的含量与空白对照组和基础微胶囊实验组相比变化均显著(P<0.05)。推测这与海洋寡糖微胶囊对益生菌的进一步保护作用以及海洋寡糖的益生元作用有关。
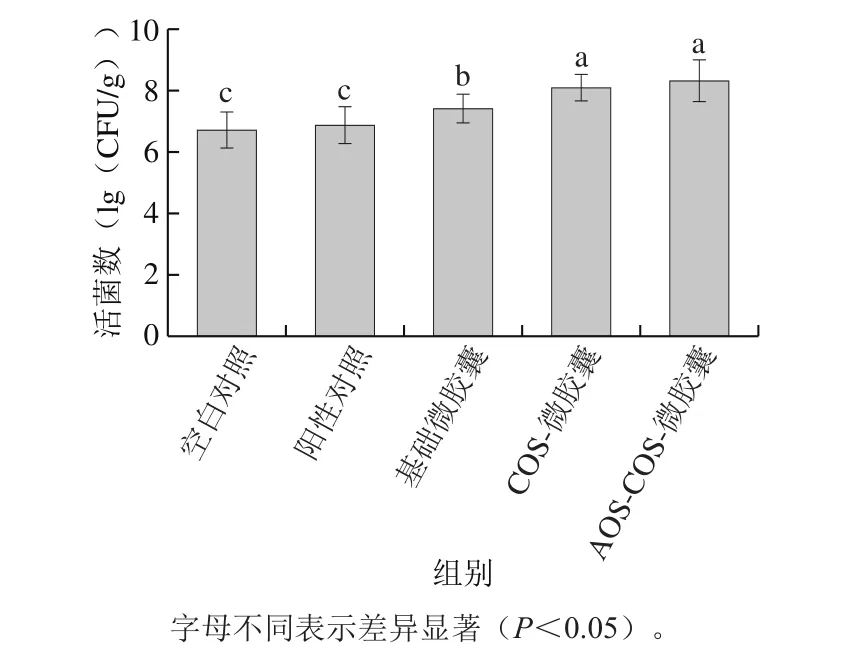
图7 5 组不同饮食小鼠的肠道菌群中长双歧杆菌的数量Fig. 7 Numbers of B. longum in intestinal fl ora of 5 groups of mice fed on different diets
应用Illumina MiSeq高通量测序法分析小鼠的肠道菌群,可以高效避免不可培养菌群的不可测性,较准确地还原肠道菌群的结构比例及丰度。OTU数量越大则样品中物种的丰富度越高[23]。如表3所示,阳性对照组和基础微胶囊实验组小鼠肠道菌群均出现OTU数量和α多样性显著上升的现象,而COS-微胶囊实验组和AOS-COS-微胶囊实验组与空白对照组无显著差异。灌胃益生菌可以有效提高小鼠的肠道菌群OTU值和α多样性[24],基础微胶囊提高小鼠的肠道菌群OTU值和α多样性的效果强于菌液,是由于长双歧杆菌在通过上胃肠道时得到了保护,使更多活菌在肠道内定植。然而两种海洋寡糖微胶囊却降低了小鼠的肠道菌群OTU值和α多样性,这可能是益生元COS和AOS的摄入引起的。Matsuki等[25]表明,低聚半乳糖作为益生元可导致婴儿肠道内益生菌含量增加,同时α多样性降低。Slavan[26]认为,益生元降低肠道菌群多样性可能是由于益生元选择性增殖益生菌同时抑制条件致病菌生长导致的。目前,尚未有直接的证据论证菌群α多样性下降对动物健康的影响[27]。
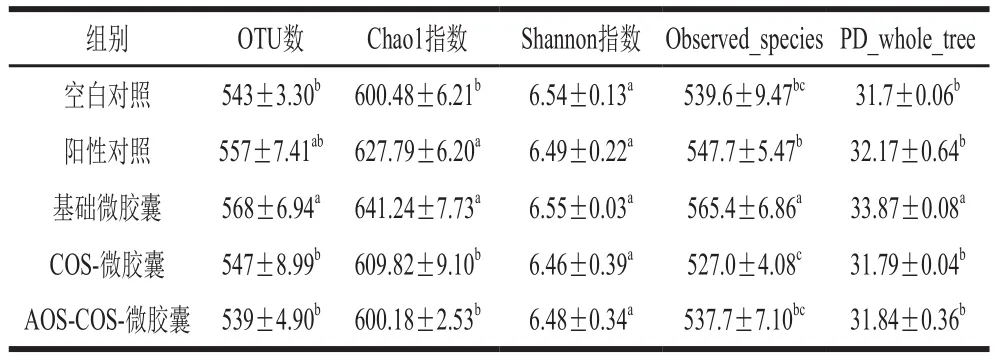
表3 5 组小鼠肠道菌群的OTU数量及α多样性Table 3 OTU number and α diversity of intestinal microbiota in 5 groups of mice
优势门的相对丰度如图8所示。与相关的研究结果相似[28],所有组的主要门都是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),它们的总和占样品中微生物总量的97%~99%。组间比较,空白对照组小鼠肠道菌群中拟杆菌门和变形菌门的含量最高,厚壁菌门的含量最低。AOS-COS-微胶囊实验组小鼠肠道中厚壁菌门的含量最高,相比较空白对照组增加了25%;同时拟杆菌门和变形菌门的含量最低,相比较空白对照组分别降低了13%和8%。肠道中的厚壁菌门主要包括芽孢杆菌纲和梭菌纲,能够帮助多糖发酵。芽孢杆菌纲中包括芽孢杆菌目和乳杆菌目,对维持肠道健康起到重要作用。拟杆菌门主要为拟杆菌纲,作为病原菌可引发阑尾炎及败血症等病症[29]。变形菌门包括大肠杆菌、沙门氏菌、霍乱弧菌等有害菌,变形菌门的增加是潜在的疾病诊断标准[30]。
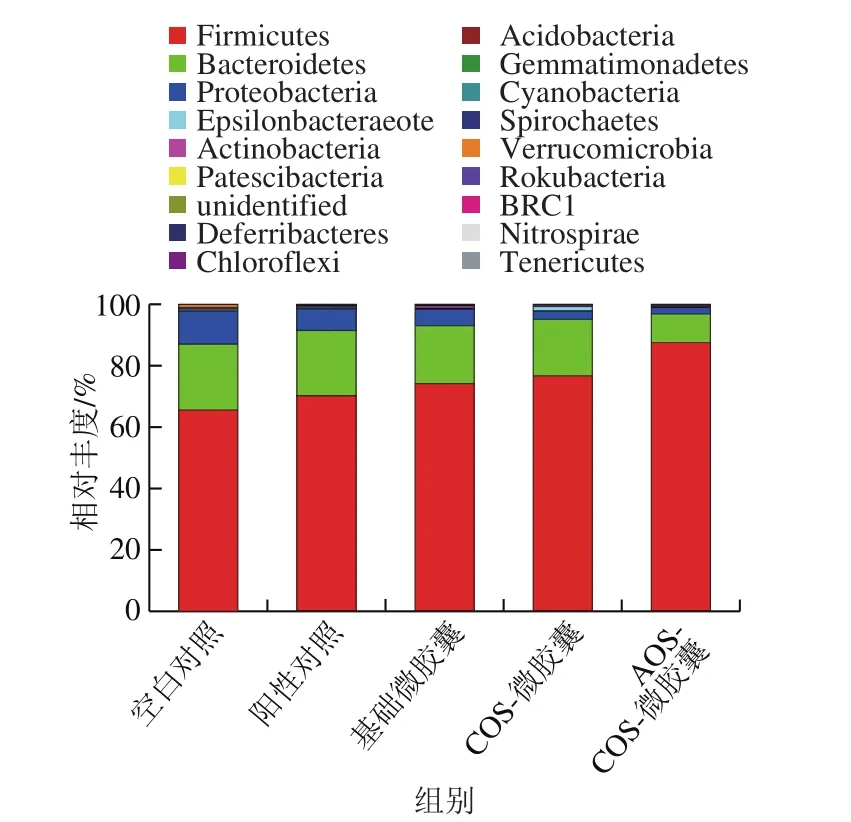
图8 5 组不同饮食小鼠的肠道菌群优势门的相对丰度Fig. 8 Relative abundance of dominant bacterial phyla in intestinal fl ora of 5 groups of mice fed on different diets
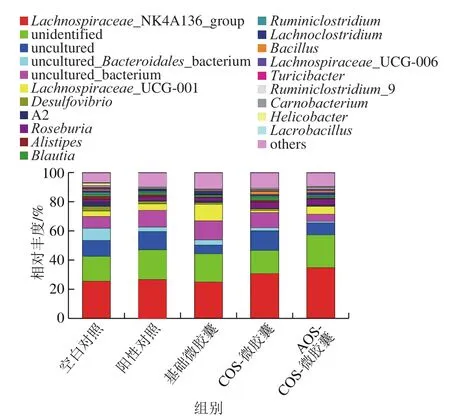
图9 5 组不同饮食小鼠的肠道菌群优势属的相对丰度Fig. 9 Relative abundance of dominant bacterial genera in intestinal fl ora of 5 groups of mice fed on different diets
为更清晰地研究小鼠肠道中有益菌和有害菌的变化趋势,对优势属进行深入分析。如图9所示,阳性对照组和3 个实验组小鼠肠道中脱硫弧菌属(Desulfovibrio)、另枝菌属(Alistipes)、螺杆菌属(Helicobacter)、肠球菌属(Enterococcus)显著降低,罗斯氏菌属(Roseburia)、乳杆菌属(Lactobacillus)显著升高。且就变化幅度的大小排序,实验组>阳性对照组>空白对照组。双歧杆菌属(Bifidobacterium)虽在阳性对照组与3 种微胶囊实验组的小鼠肠道菌群中显著升高(相比较空白对照组),但在阳性对照组与3 种微胶囊实验组之间并未表现出明显差异。这与上述双歧杆菌计数实验结果不符,推测原因是双歧杆菌属在肠道菌群中占比太小,用相对丰度不能清晰地表示出小鼠肠道菌群中双歧杆菌含量的变化趋势。脱硫弧菌属与肠道疾病之间存在一定的联系。肠道脱硫弧菌属数量的增多是肠道息肉和溃疡性结肠炎的一个重要特征[31]。另枝菌属是一种兼性致病菌,在患有肠应激综合征患者的肠道内的含量增多[32]。螺杆菌属中的一些菌株如幽门螺旋杆菌具有致病性,与消化性溃疡、慢性胃炎、十二指肠炎和胃癌密切相关。肠球菌属属于肠杆菌科(Enterobacteriaceae),肠杆菌科包括许多常见的病原菌,如沙门氏菌、大肠杆菌、克雷伯氏菌和志贺氏菌等,可导致腹泻、腹膜炎、败血症等疾病。肠球菌属是粪便中常见的一种病原菌,可能导致尿路感染、菌血症及脑膜炎等疾病,且对许多抗菌药物具有耐药性。罗斯氏菌属属于毛螺菌科(Lachnospiraceae),可以利用碳水化合物和纤维产生丁酸类物质。肠道中的丁酸可以刺激肠道细胞产生抗菌肽类物质,从而抵制外来致病菌,有助于肠道健康[33]。乳杆菌属是最为常见的益生菌属,对肠道健康具有重要意义。
综上所述,对小鼠肠道菌群的改善效果由高到低的益生菌制剂依次是AOS-COS-微胶囊、COS-微胶囊、基础微胶囊、裸双歧杆菌。包括AOS-COS-微胶囊和COS-微胶囊在内的海洋寡糖微胶囊具有最佳的改善肠道菌群的效果,分析原因有:1)在通过上胃肠道时,微胶囊良好的保护效果使长双歧杆菌在到达肠释放位点时具有更多的活菌数,更多的长双歧杆菌在肠道定植;2)微胶囊在肠道中被液化后,AOS与COS作为两种益生元可以刺激肠道益生菌的生长,且对肠道部分条件致病菌的生长有抑制作用[9-10,13]。
3 结 论
本实验以长双歧杆菌为例,证明了海洋寡糖微胶囊作为一种益生菌制剂,可以显著增强对益生菌的保护作用。由于较多的活性益生菌到达肠靶位点及益生元的释放,海洋寡糖微胶囊的摄入可以对肠道菌群起到良好的调节作用。通过增加益生菌(双歧杆菌、乳杆菌等)并减少条件致病菌(脱硫弧菌、螺杆菌、肠球菌等)的含量,降低机体罹患如肠道息肉、消化性溃疡、慢性胃炎、十二指肠炎等胃肠道疾病的风险。未来海洋寡糖微胶囊还可以被用于包埋其他种属的益生菌,具有良好的应用前景。
