转谷氨酰胺酶交联大豆分离蛋白结构表征
2020-01-07臧学丽
臧学丽,陈 光*
(1.长春医学高等专科学校,吉林 长春 130031;2.吉林农业大学生命科学学院,吉林 长春 130118)
大豆营养丰富,蛋白质含量较高,是人类摄取最廉价和最优质的植物蛋白来源[1]。大豆蛋白中人体必需氨基酸含量丰富[2],各成分分布均衡[3],是人类获取植物蛋白的主要来源。大豆分离蛋白(soy protein isolate,SPI)是大豆中主要的蛋白成分,主要由7S及11S球蛋白组成,是优质的植物蛋白[4]。SPI具有一定溶解性、凝胶性、乳化性等功能特性,并被广泛应用于食品等多个领域[5-7]。但天然的SPI功能特性并不理想,未经加工的SPI功能尚不能满足人们在日常生产中的需求。目前大豆蛋白改性的方法有物理法、化学法、生物酶法。物理法和化学法改性存在凝胶效果不好或食品发全等问题,生物酶法具有发全可靠、反应温和等优点,已成为研究热点[8-9]。
转谷氨酰胺酶(transglutaminase,TGase)是一种能催化蛋白质中赖氨酸上的-氨基与谷氨酸上γ-羟酰胺基之间发生联合反应的酶[10],能聚合蛋白多肽之间形成共价聚合物。TGase交联能改变SPI的溶解性、凝胶特性、疏水性等[11]。Walsh等[12]采用TGase对SPI进行处理,研究表明经TGase处理后,SPI的溶解性显著提高,溶解特性得到改善。Gan等[13]采用TGase为改性剂交联SPI,研究结果显示,经过TGase改性的SPI凝胶强度和黏弹性均有显著的变化。SPI经过酶作用后,蛋白内部的非极性氨基酸残基暴露到表面,使蛋白的疏水性增大,发生聚集效应[14],形成凝胶。但TGase处理大豆蛋白结构和功能变化的关系及作用机制的研究还不系统,限制了酶改性SPI工业的发展。
本实验通过热力学、波谱学、微观结构等方法对TGase交联SPI的二级结构进一步分析,采用差示扫描量热仪、红外光谱、扫描电镜、X-射线衍射、圆二色谱[15-16]等研究TGase交联SPI二级结构的变化,进一步探索TGase交联对SPI分子结构的影响,为TGase交联SPI的作用机制提供理论基础,以期为大豆制品的开发利用提供依据。
1 材料与方法
1.1 材料与试剂
吉林芽豆SPI由实验室自制;TGase 美国Sigma公司;氨基酸检测标准品 日本Wako公司;溴化钾(分析纯) 美国Amresco公司;磷酸盐缓冲溶液 东莞树万化工有限公司;戊二醛(分析纯) 广东翁江化学试剂有限公司;乙醇(分析纯) 常州市启迪化工有限公司。
1.2 仪器与设备
L-8900型氨基酸全自动分析仪 日本日立公司;3K15台式高速冷冻离心机 美国Sigma公司;ALPHA1-4LSC冷冻干燥机 德国Marin Christ公司;DSCq2000差示扫描量热仪 美国TA仪器公司;Sanyo Versatile圆二色光谱仪 法国Bio-Logic公司;AF206制冰机 美国Scotsman制冰机系统有限公司;BC-163D酸度计 北京市华云分析仪器研究所;D8广角X-射线衍射仪、TENSOR 27红外光谱仪 德国Bruker公司;MLS-3780超低温冰箱日本Sanyo Labo Autoclave公司;UV-1800紫外-可见分光光度计 日本岛津公司;85-1C磁力搅拌机 上海梅颖浦有限公司;EVO MA 25扫描电镜 德国卡尔蔡思公司。
1.3 方法
1.3.1 SPI的制备
参照Sorgentini等[17]方法并略作改动。吉林芽豆经粉碎脱脂后得到大豆粉为原料,按照豆粉与水的比例1∶10(g/mL)混合,用1 mol/L NaOH溶液调pH值至8.0。4 ℃低温搅拌提取2 h,8 000×g离心30 min。上清液用1 mol/L HCl溶液调pH值至4.5,在室温下静止1 h,再次离心,条件同上,弃掉上清液。沉淀用去离子水溶解,并用1 mol/L NaOH溶液调pH值至7.0。充分搅拌溶解后,4 ℃低温条件下对提取液透析24 h除盐,冷冻干燥制备得SPI,4 ℃保存备用。
1.3.2 TGase交联SPI样品的制备
将SPI配制成2%蛋白溶液,按照TGase交联SPI制得凝胶强度最佳条件[18],即酶添加量34.67 U/g、反应温度60 ℃、pH 7.22、反应时间2.21 h,立即放入冰浴中,然后进行冷冻干燥,得到SPI交联样品。
1.3.3 表面疏水性的测定
采用1-苯胺基-8-萘磺酸(1-a n i l i n o-8-naphthalenesulfonic acid,ANS)荧光分光光度计法。准确称取交联前后最佳条件下的SPI样品0.01 g,溶于pH 7.0的磷酸盐缓冲溶液,在室温下,搅拌1 h,10 000 r/min离心20 min。上清液用磷酸盐缓冲液(0.01 mol/L,pH 7.0)稀释成不同的质量分数,分别为0.005%、0.01%、0.02%、0.1%、0.2%。以上稀释液样品分别量取4 mL,加入浓度为8 mmol/L的ANS(配制时,采用同一缓冲溶解)溶液40 μL,充分混匀。在室温条件下静止10 min。溶液中不加ANS作为空白,在激发波长为390 nm,发射波长470 nm条件下,用荧光分光光度计测定蛋白样品的荧光强度。横坐标为蛋白质的浓度,纵坐标为不同浓度蛋白对应的荧光强度,作图。蛋白质的表面疏水性指数(S0)用曲线初始阶段的斜率表示。
1.3.4 自由氨基含量的测定
取酶交联前后最佳条件下的SPI 250 µL,加入4.0 mL 0.2 mol/L pH 8.2的磷酸缓冲液混匀,加入0.01%的2,4,6-三硝基苯磺酸溶液2 mL,混合均匀。置于50 ℃水浴锅中水浴30 min,然后在反应体系中加入亚硫酸钠溶液4.0 mL,终止反应。静止20 min,在室温下,用紫外分光光度计测定波长420 nm处吸光度。以不加入SPI的样品作为对照,计算自由氨基含量。
1.3.5 差示扫描量热分析
准确称取5.0 mg交联前后最佳SPI凝胶强度的蛋白冻干粉,放置于铝干锅中,用压片机压片密封,选择空白压片干锅盒作为对照,升温速率为5 ℃/min,升温范围30~140 ℃。分析差示扫描量热曲线,得到最佳条件下交联前后蛋白样品的变性温度和变性焓值。
1.3.6 TGase加入后SPI凝胶扫描电镜分析
取适量的TGase交联前后最佳条件下SPI的蛋白冻干粉。5 000 r/min离心10 min,保留沉淀并均匀分散于4%的戊二醛溶液中,4 ℃冰箱中过夜固定。用pH 7.4的磷酸盐缓冲液冲洗3 次。使用乙醇溶液(体积分数30%、50%、70%、85%、95%)逐级脱水,无水乙醇脱水2 次,每次脱水时间为15 min。5 000 r/min离心10 min回集沉淀物。真空冷冻干燥机中冷冻干燥,电镜检测。
1.3.7 X-射线衍射分析
将交联前后最佳条件下SPI的蛋白冻干粉样。放入X-射线衍射仪中,对广角X-射线衍射进行分析。测试条件:波长0.154 nm,电压40 kV,电流50 nA,衍射角范围3~50 ℃。
1.3.8 红外光谱扫描
准确称取1 mg交联前后最佳条件下干燥蛋白冻干粉。加入100 mg溴化钾,充分研磨混匀,进行全波段扫描,波长范围为4 000~400 cm-1。分辨率4 cm-1,扫描次数为32 次。
1.3.9 圆二色谱分析
称取交联前后最佳条件下5 mg SPI样品,溶于5 mL pH 7.2的5 mmol/L磷酸盐缓冲液中,室温条件下搅拌25 min,8 000 r/min离心10 min。回集上清液稀释至0.1 mg/mL进行圆二色谱检测。圆二光谱的检测波长为190~250 nm。
1.3.10 氨基酸组分分析
参照GB/T 5009.124—2003《食品中氨基酸的测定》的方法测定。利用氨基酸自动分析仪测定TGase交联前后最佳条件下SPI蛋白冻干粉样品17 种氨基酸含量。
2 结果与分析
2.1 TGase对SPI表面疏水性的影响
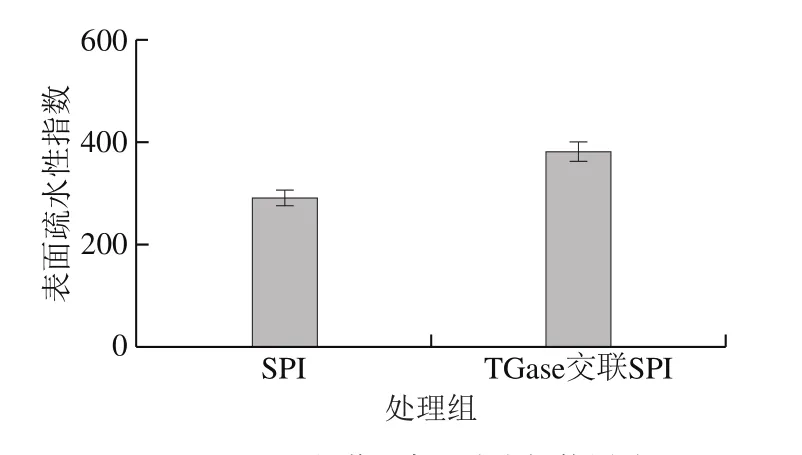
图1 TGase交联对表面疏水性的影响Fig. 1 Effect of TGase cross-linking on the surface hydrophobicity of SPI
如图1所示,交联后提高了SPI的表面疏水性,表面疏水性指数由原来的282.10增加到383.32,提高了35.9%。表面疏水性提高,分析原因有可能是表面疏水性由蛋白质的表面残基暴露的程度所决定。暴露于分子表面疏水性残基越多,表面疏水性越强,SPI经TGase催化后,使SPI的结构发生了改变,多肽链展开,疏水区域从分子内部基团逐渐暴露出来,使表面疏水性升高。
2.2 TGase交联SPI表面自由氨基含量的变化
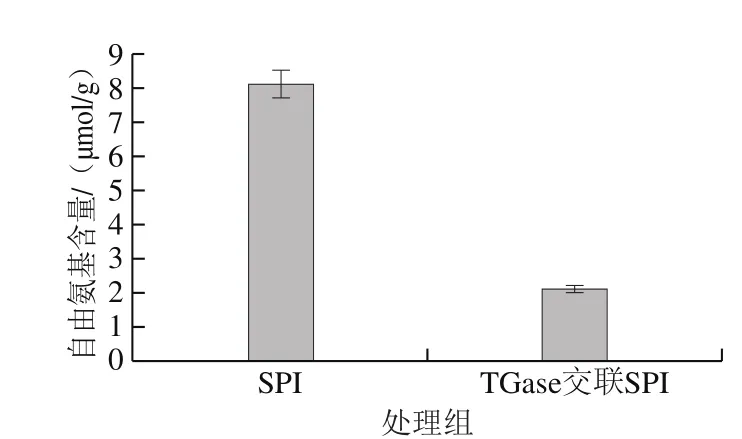
图2 TGase对SPI自由氨基含量的影响Fig. 2 Effect of TGase cross-linking on the free amino content of SPI
如图2所示,TGase交联SPI交联产物的自由氨基含量降低,自由氨基含量由未交联的8.12 µmol/g下降到的2.13 µmol/g,下降了73.8%。自由氨基含量降低,原因是TGase催化蛋白质交联的过程中,使蛋白质肽段上的氨基转变成NH3释放出来,发生了脱氨反应;另外一方面原因有可能是TGase的作用使谷氨酸分子上酰胺基与赖氨酸上的氨基发生结合,使交联产物自由氨基的含量降低。同时自由氨基含量的下降在一定程度上说明了TGase作用后交联作用的发生程度。
2.3 差示扫描量热分析
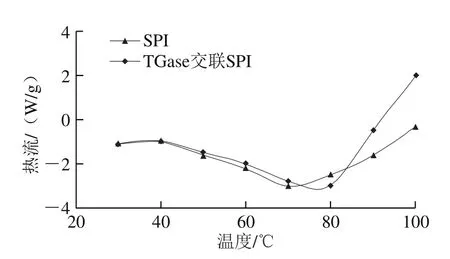
图3 TGase交联前后SPI的差示扫描量热图谱Fig. 3 DSC thermograms of native and TGase cross-liked SPI
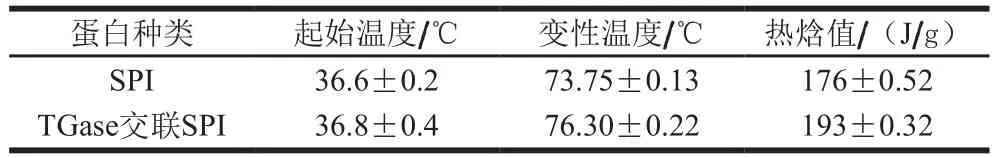
表1 TGase处理前后差示扫描量热分析Table 1 DSC characteristics of native and TGase cross-liked SPI
由图3可以看出,T G a s e作用后的变性温度和热焓值都有所提高,交联前S P I的变性温度为(7 3.7 5±0.1 3)℃,交联后变性温度为(76.30±0.22)℃。变性温度提高反应蛋白的热稳定性,说明交联后SPI热稳定性有所提高。热焓值交联前为(176±0.52)J/g,交联后热焓值为(193±0.32)J/g,热焓值能反映蛋白质的疏水性和聚集程度,热焓值提高,原因可能是酶交联后蛋白侧链上特定基团交联形成更大的分子,产生了大量的高能异肽共价键,从而使产物的热稳定性提高,与Jiang Shujuan等[19]研究结果相一致。从这一结论可以看出交联可能产生了异肽共价键,热稳定性升高,凝胶强度增强。
2.4 TGase对SPI凝胶结构的影响
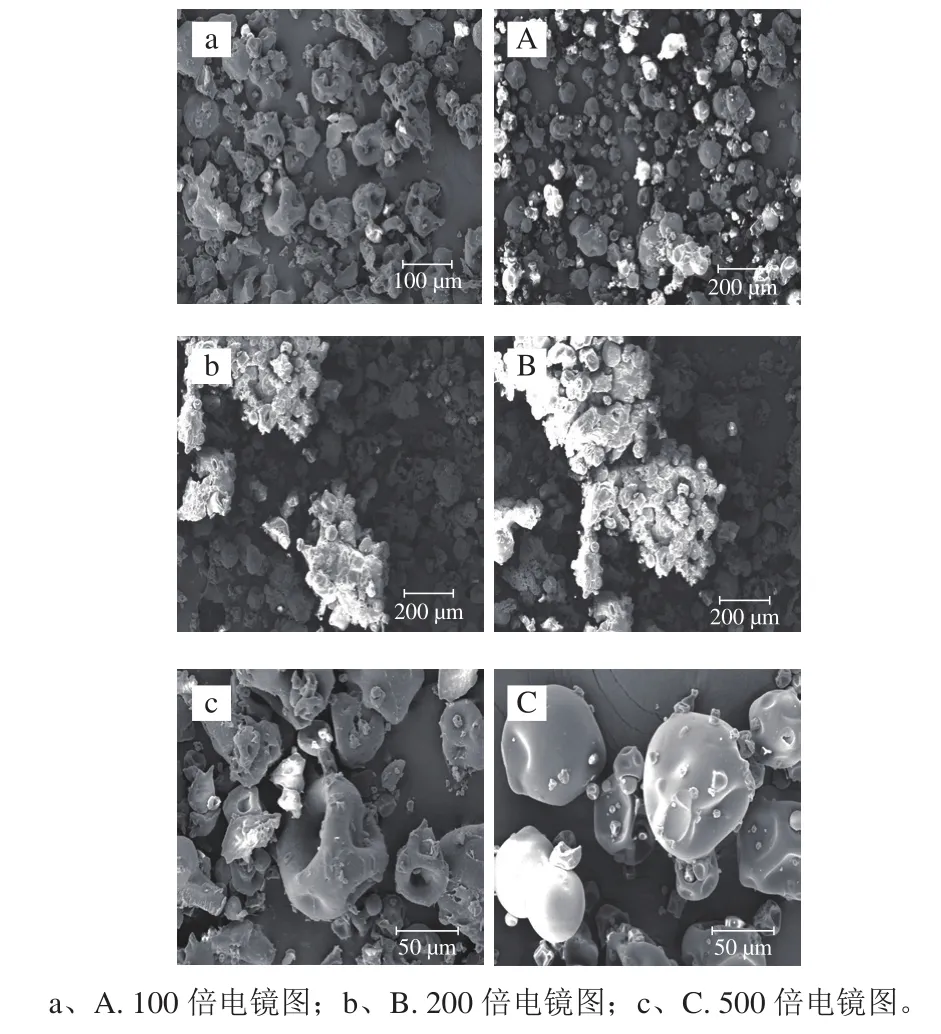
图4 TGase交联SPI(a~c)和SPI(A~C)凝胶电镜图Fig. 4 Scanning electron micrographs of TGase cross-linked SPI (a-c)and native SPI (A-C)
由图4可以看出,未添加TGase的SPI凝胶的表面光滑,呈球形结构,TGase交联后结构由球形结构变成凹陷坑洼球形结构。说明TGase对SPI凝胶的内部结构或集团之间的相互作用有着非常重要的调节作用[20],酶交联改变的大豆蛋白的表面形貌。Arzeni等[21]利用扫描电镜观察高场强超声波处理大豆蛋白的变化,蛋白质结构表现更加明显的网状结构,超声波处理属于物理改性,超声波处理后大豆蛋白的表面形貌改变与TGase交联表面形貌改变的不同,说明不同的方法处理大豆蛋白对蛋白的结构会有不同的影响。
2.5 X-射线衍射分析
由图5可知,SPI衍射峰分别出现在衍射角为9.6°和20.2°处,明显的衍射峰出现在20.2°处;TGase衍射峰出现在衍射角为20.1°处,TGase交联后SPI衍射峰出现在衍射角为20.2°处;经过酶交联后SPI,在衍射角为9.6°处衍射峰消失,在衍射角为20.2°处衍射峰强度相对TGase和未交联的SPI相比较均有所减弱,但峰形变的尖锐;衍射峰能够形成结晶行为的样品必须具备有序的分子结构,TGase经SPI交联后衍射峰减弱。说明SPI经TGase处理后,使SPI结构发生了变化,对SPI微观晶体结构有所影响。分析原因有可能交联后蛋白多肽链充分伸展,结晶度降低。
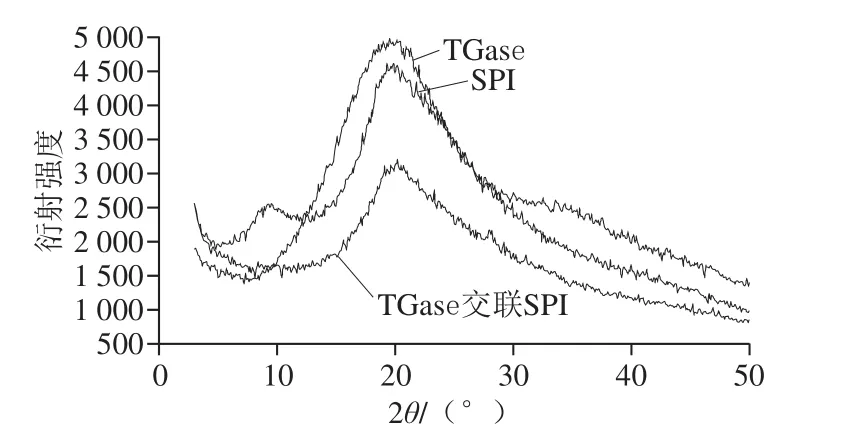
图5 TGase、TGase交联前后SPI的X-射线衍射图谱Fig. 5 X-ray diffraction analysis of native and TGase cross-liked SPI
2.6 红外光谱分析
2.6.1 TGase对SPI红外图谱的影响
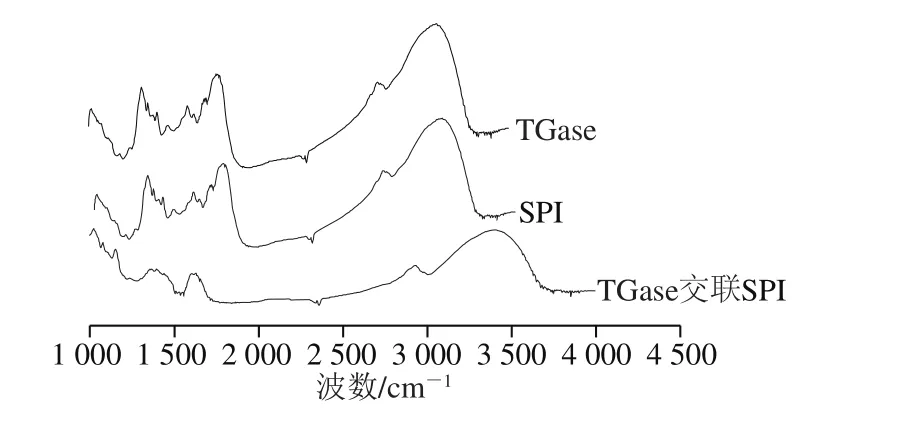
图6 TGase、TGase交联前后SPI红外光谱图Fig. 6 FTIR spectra of native and TGase cross-liked SPI
如图6、表2所示,SPI 3 600~3 300 cm-1波段的吸回峰值不变,最强吸回峰均为3 409 cm-1,迁移到了3 420 cm-1,迁移了11 cm-1。说明TGase交联会引起SPI分子内和分子间的氢键改变,或O—H伸缩振动、N—H伸缩振动[22]。2 980~2 850 cm-1波段SPI最强吸回峰在2 940 cm-1,TGase交联后最强吸回峰为2 933 cm-1,酶交联引起吸回峰迁移7 cm-1,且峰值升高。说明TGase处理后SPI能够引起蛋白质分子饱和结构中CH3和CH2基团的C—H伸缩振动增强,可能交联后蛋白质结构展开或进一步断裂,与X-射线衍射分析相一致。1 700~1 600 cm-1波段,SPI高峰在1 651 cm-1,酶交联后最高峰在1 633 cm-1,并且吸回峰的强度有所增强。说明酶交联后酰胺I带C—O伸缩振动和H—O—H弯曲振动增加。
2.6.2 TGase对SPI二级结构的影响
蛋白质的红外图谱中,蛋白质主要包括4 种构相结构,α-螺旋、β-转角、β-折叠和无规卷曲等。二级结构与各波段吸回峰的位置关系为α-螺旋对应波段l 650~1 658 cm-1,β-折叠为1 610~1 640 cm-1和1 682~1 700 cm-1,β-转角为1 664~1 681 cm-1,无规卷曲为1 640~1 650 cm-1。酰胺III 1 220~1 330 cm-1波段内蛋白质二级结构与波段对应关系为:α-螺旋为1 290~1 340 cm-1,无规卷曲为1 255~1 288 cm-1,β-折叠结构1 181~1 248 cm-1。如图6所示,未处理SPI高峰在1 651 cm-1,酶交联后最高峰在1 633 cm-1,迁移了15 cm-1。这说明SPI经TGase交联后β-折叠结构含量有较大的提高。分析原因有可能蛋白质二级结构中的一部分α-螺旋结构转换为β-折叠,形成了稳定的β折叠构造,SPI的二级结构发生了变化。
2.7 圆二色谱分析
从图7可以看出,SPI和TGase交联SPI样品的远紫外圆二色谱图在194 nm波长处出现正峰,218 nm波长处出现负肩峰,这是高度有序的β类型结构的一种特征。通过Reed拟合计算,得到2 种样品的二级结构组成见表3。
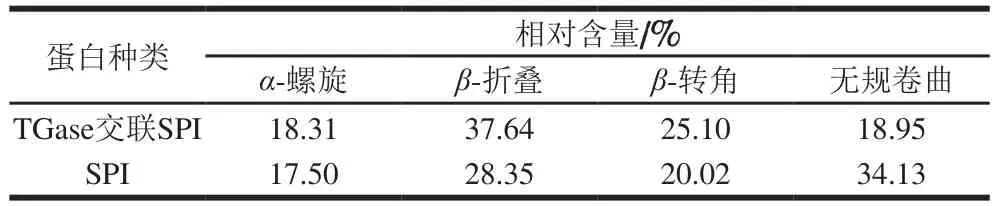
表3 TGase交联前后SPI二级结构的变化Table 3 Secondary structure compositions of native and TGase crossliked SPI
从表3可以看出,TGase交联前后SPI的二级结构存在一定的差别。与未经过酶交联的SPI相比,经过TGase交联后的大豆蛋白有序度更高,无规卷曲结构相对含量较低;而β-折叠相对含量增加,与红外光谱结果一致,与王辰等[23]的相关研究,表面疏水性随着SPI的二级结构中α-螺旋相对含量降低而增大,β-折叠相对含量升高而增大的结果相一致。进一步证明了SPI的功能特性与二级结构紧密相关。胡晓[24]利用红外光谱分析了TGase交联后花生蛋白的二级结构的变化,得出交联后α-螺旋和β-转角含量降低,β-折叠及无规卷曲含量增加,与本研究结果不一致,可能是由于TGase交联使不同作用底物二级结构发生不同的变化。
2.8 氨基酸测定结果
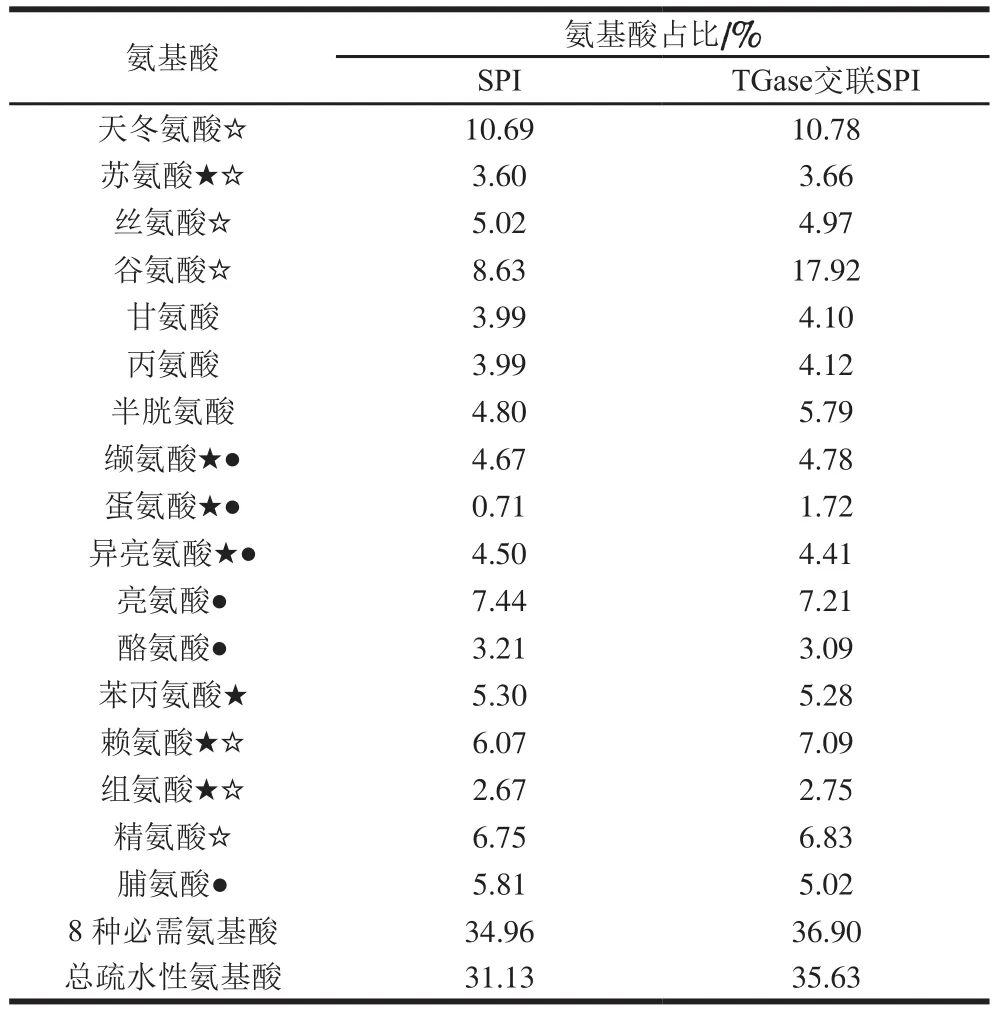
表4 TGase交联前后SPI氨基酸的成分及含量Table 4 Amino acid compositions of native and TGase cross-liked SPI
由表4可以看出,SPI中氨基酸含量最高的为天冬氨酸。丝氨酸、组氨酸、脯氨酸等氨基酸的含量有所降低。交联前后8 种必需氨基酸和疏水性氨基酸比较,必需氨基酸占比由34.96%升高到36.90%,升高了5.5%。分析原因有可能是交联后蛋白质谷氨酸酰胺基和赖氨酸的氨基之间结合形成含有共价聚合物的交联,赖氨酸等必需氨基酸被引入SPI中,TGase改善了蛋白质结构和特性,提高了蛋白质的营养价值。疏水性氨基酸占比由31.13%提高到35.63%,提高了14.5%。研究[25-27]表明,蛋白质的表面疏水性显著影响蛋白质的凝胶性,SPI经酶交联后,必需氨基酸的含量升高,疏水性氨基酸含量升高。蛋白中疏水性氨基酸的含量与其表面疏水性呈正比例相关,交联后疏水性氨基酸含量升高说明表面疏水性升高,与表面疏水性一致,进一步证明了疏水性氨基酸含量与凝胶强度正相关。
3 结 论
通过对TGase交联后SPI的结构变化进行表征,交联后表面疏水性提高,表明SPI经TGase催化后,使SPI的结构发生了改变,多肽链展开,疏水区域从分子内部基团逐渐暴露出来,使表面疏水性升高。自由氨基的含量降低,说明交联后发生了脱氨反应或使谷氨酸分子上酰胺基与赖氨酸上的氨基发生结合,使交联产物自由氨基的含量降低。交联前后扫描电镜分析,表明交联后由球形结构变成陷孔状结构,分子结构发生了改变。X-射线衍射分析表明交联后多肽链充分伸展,空间结构改变,结晶度降低。红外光谱、圆二色谱对交联前后二级结构变化进行研究,结果表明交联后有序度更高,β-折叠相对含量增加,形成了稳定的结构,无规卷曲相对含量降低。而氨基酸含量测定结果表明交联后引入赖氨酸等必需氨基酸,必需氨基酸占比由34.96%升高到36.90%,疏水性氨基酸占比由31.13%提高到35.63%,交联后可以提高疏水性氨基酸的含量,改善SPI的表面疏水性,提高β-折叠含量,使凝胶强度增强。本研究结果可以看出,TGase交联后结构由球形结构变成凹陷坑洼球形结构,与胡晓[24]研究的交联花生蛋白结构变化不同,说明TGase交联使不同作用底物二级结构发生不同的变化。TGase交联SPI后产生了异肽共价键,热稳定性升高,凝胶强度增强,表明选育含疏水性氨基酸高的大豆品种可以提高凝胶强度,为食品加工专用型大豆品种的选育提供了可行的研究思路。
