大米球蛋白铜离子结合肽的鉴定及其螯合活性分析
2020-01-07邢常瑞初晨露张晓云汪金燕鞠兴荣
邢常瑞,初晨露,张晓云,汪金燕,鞠兴荣,袁 建*
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与发全协同创新中心,江苏高校粮油质量发全控制及深加工重点实验室,江苏 南京 210023)
稻谷是世界上最重要的粮食作物,2012年全球稻谷年产量超过7亿 t[1]。在稻谷加工成精米的过程中,根据工艺不同,产生的米糠约占稻谷质量5%~8%。新鲜的米糠气味清淡,味道微苦微甜,我国大部分米糠都是作为优质的动物饲料直接使用。在日本、印度等国家,去脂米糠添加到莫米粉或者大米粉中用于制作一些传统淀粉基食品,尽管米糠的添加对食品外观和颜色有些影响,但是对食品质构影响不大;米糠中油脂、蛋白含量高的特点也用于生产米糠油、替代鱼粉等。米糠成分复杂,对不同成分的深入研究和利用可以极大提高米糠的商业价值[2]。
米糠营养价值高,可以提供丰富的维生素、矿物质、不饱和脂肪酸和大量的蛋白质[3]。同时,营养学家对大米蛋白、玉米蛋白、蚕丝蛋白、方日葵蛋白等在内的许多自然资源进行研究,发现很多蛋白、水解物和多肽具有酪氨酸酶抑制、抗癌、抗氧化活性和金属离子螯合活性[4-7]。
铜作为一种人体必需的微量元素,是多种氧化酶的组成成分[8]。Megas等[9]用胃蛋白酶和胰液素对方日葵蛋白进行酶解,发现具有Cu2+螯合活性的肽,氨基酸分析发现其富含组氨酸和精氨酸,抗氧化活性与β-胡萝卜素相当。Perkins等[10]发现甘氨酸-L-组氨酸-L-赖氨酸三肽与铜结合后形成稳定的络合物,可以增加肝癌细胞对铜的吸回,并且铜络合物具有诱导血管生成的能力。多肽-金属螯合物比单纯的氨基酸-金属元素螯合物具有更高的配合率、稳定性及生理活性[11-12]。Kubglomsong等[13]通过分离米糠白蛋白水解物,发现多个肽序列具有酪氨酸酶抑制和铜螯合活性,一些多肽具有高效的酪氨酸酶抑制作用和螯合铜的能力。目前对于大米蛋白源金属螯合肽的研究和发现比较少,加强对大米蛋白酶解多肽与金属元素的结合能力和特异性研究,有助于多种金属元素肽的发现和提高大米蛋白的高值产品的开发价值。
本实验从大米球蛋白胃蛋白酶水解物中筛选、鉴定并人工合成两条多肽(QGWSSSSE和YYGGEGSSSEQGY),研究其与金属离子的螯合活性,并比较这两条多肽与乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、柠檬酸和金属硫蛋白螯合金属离子的能力大小,为后续进一步研究生理活性和酪氨酸酶抑制能力提供依据。
1 材料与方法
1.1 材料与试剂
稻谷为2018年采集自淮发市淮发区粳稻品种“淮稻5号”。
醋酸钠缓冲溶液(p H 6.0)、儿茶酚紫、CuSO4•5H2O、EDTA、柠檬酸、金属硫蛋白(相对分子质量约为6 500);合成肽1(QGWSSSSE)和合成肽2(YYGGEGSSSEQGY)由江苏申基生物科技有限公司合成,纯度大于95%。
1.2 仪器与设备
SpectraMax®M5多功能酶标仪 美谷分子仪器(上海)有限公司;7700x电感耦合等离子质谱仪 美国Agilent公司;TRIPLETOF 5600液相色谱-质谱联用系统美国应用生物系统公司。
1.3 方法
1.3.1 大米中蛋白的提取和测定
稻谷用砻谷机将稻谷外壳去掉,保留糙米,然后用万能粉碎机将糙米磨成粉末,过60 目筛得到糙米粉,进行4 种蛋白的连续提取。
根据4 种蛋白(清蛋白、球蛋白、醇溶蛋白、谷蛋白)溶解度的差异,分别以蒸馏水、5% NaCl溶液、70%乙醇溶液、0.05 mol/L NaOH溶液作为主要溶剂,采用Osborne法分步提取4 种蛋白[14]。每次室温搅拌提取时间2 h、固液比4∶1,10 000 r/min离心10 min分离沉淀蛋白,每步重复提取3 次,合并提取液通过0.45 μm滤膜过滤。通过滴加2 mol/L HCl溶液调节等电点沉淀提取液中的蛋白质,进行冷冻干燥,-20 ℃保存。对冷冻干燥的蛋白质进行ICP-MS测定,测定25 种元素含量[15]。
1.3.2 胃蛋白酶水解球蛋白
由于谷蛋白和醇溶蛋白的水溶解差,只有在碱性条件下才能溶解,故选择球蛋白进行酶解。将分离得到的1 g的大米球蛋白溶解于蒸馏水中,使其质量分数为5%,调节反应的温度(37 ℃)和pH值(胃蛋白酶pH 2),搅拌溶解1 h后,加入胃蛋白酶质量分数为4%。酶解4 h,监测反应pH值,通过1 mol/L的HCl溶液保持反应pH值不变。
1.3.3 球蛋白酶解肽鉴定和人工合成
回集酶解液,使用超滤管进行分离,超滤管截留分子质量为3 kDa。通过超滤膜后的下层滤液,用50%乙腈溶液,稀释10 倍,过0.22 μm的有机系微孔滤膜,通过SCIEX Triple-TOF-MS液相色谱-质谱联用系统进行分析,选择Agilent 120 EC-C18(4.6 mm×150 mm,4 μm)作为分离柱,流速0.4 mL/min,柱温37 ℃,上样体积10 μL。质谱离子源选择正离子模式,干燥气温度200 ℃,干燥气流速15 L/min,鞘气温度370 ℃,鞘气流速12 L/min,碰撞电压380 V,质谱扫描范围m/z100~2 000,梯度洗脱条件见表1。

表1 测定球蛋白水解多肽梯度洗脱条件Table 1 Gradient elution conditions for separation of rice globulin peptides
获得的测试数据通过PEAKS软件鉴定球蛋白酶解多肽的种类,对比数据库中的球蛋白氨基酸序列,并分析其可能的金属元素螯合能力,并进行人工合成。
1.3.4 大米多肽和不同参照物Cu2+金属离子螯合活性的测定
对比文献[13]和分析氨基酸组成,选择2 条可能具有螯合元素活性的大米多肽(记为合成肽1和合成肽2),根据Carrasco-Castilla等[16]的方法测定其与Cu2+金属离子螯合活性。同时测定参照物EDTA、柠檬酸、金属硫蛋白和Cu2+金属离子螯合活性,并比较螯合能力的大小。
1.3.4.1 大米多肽与Cu2+金属离子螯合活性的测定
用pH 6.0醋酸钠缓冲溶液配制多肽溶液,合成肽1的溶液浓度梯度为0~68.48 mmol/L,合成肽2的浓度梯度为0~38.76 mmol/L。取20 μL大米多肽溶液与270 μL的50 mmol/L醋酸钠缓冲溶液和6 μL的4 mmol/L儿茶酚紫溶液以及10 μL的4 mmol/L CuSO4•5H2O溶液混合,混匀静置反应15 min。用酶标仪测量溶液在632 nm波长处的吸光度,按照下式计算铜螯合率:

1.3.4.2 EDTA、柠檬酸及金属硫蛋白与Cu2+金属离子螯合活性的测定
取用pH 6.0醋酸钠缓冲溶液配制的EDTA或柠檬酸溶液,EDTA和柠檬酸溶液浓度梯度为0~10.0 mmol/L,金属硫蛋白溶液浓度梯度为0~2.08 mmol/L。取10 μL溶液与280 μL的50 mmol/L醋酸钠缓冲溶液(pH 6.0)和6 μL 4 mmol/L儿茶酚紫溶液以及10 μL的4 mmol/L CuSO4•5H2O溶液混合,混匀静置反应15 min。用酶标仪测量溶液在632 nm波长处的吸光度,计算铜螯合率。
1.3.5 大米多肽和不同参照物与Cd2+、Fe2+、Ca2+等金属离子螯合活性的测定
先用醋酸钠缓冲溶液配制20 mmol/L CdCl2、FeCl2和CaCl2等溶液,按照上述实验过程,分别取上述不同浓度的大米多肽溶液(20 μL)、EDTA(10 μL)、柠檬酸(10 μL)和金属硫蛋白溶液(10 μL),与10 μL 20 mmol/L CdCl2溶液混合均匀,室温静置反应1 h。余下的实验步骤相同,测定大米多肽和参照物与Cd2+金属离子螯合活性(以吸光度表示)。按照同样的方法测定大米多肽和参照物与Fe2+和Ca2+金属离子螯合活性。
2 结果与分析
2.1 大米蛋白的提取和多元素含量分析
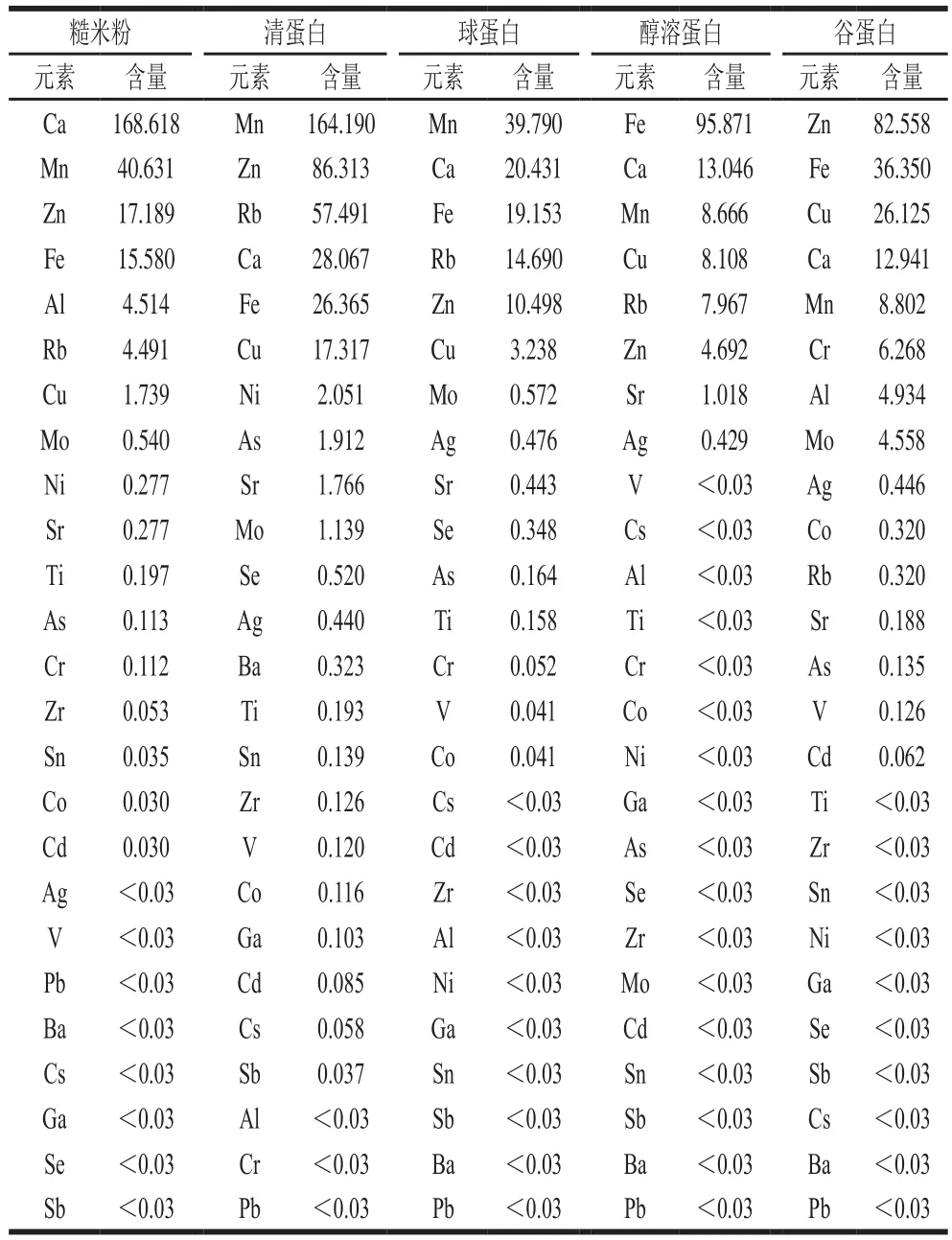
表2 糙米粉和大米蛋白中不同元素含量Table 2 Metal element contents in brown rice fl our and rice proteins mg/kg
糙米粉经过石油醚搅拌脱脂后,根据蛋白溶解度的差异,采用分步提取4 种蛋白,冷冻干燥后进行ICP-MS检测,检测与蛋白质结合的多种优势元素。由表2可知,在4 种蛋白质中都含有铜,范围为3.238~26.125 mg/kg。因此,分析这大米4 种蛋白中的铜结合肽可行。Kubglomsong等[13]报道从大米清蛋白中发现多个肽序列具有铜螯合活性,特别是SSEYYGGEGSSSEQGYYGEG肽序列,肽螯合铜的活性比EDTA螯合铜的能力要强,考虑到在实验中观察到谷蛋白和醇溶蛋白的水溶解性差,在胃蛋白酶酶解过程中易产生沉淀,酶解不完全,本实验选取球蛋白进行后续实验。
2.2 大米球蛋白胃蛋白酶水解多肽鉴定、分析和人工合成
对超滤后的多肽进行质谱分析,通过SCIEX Triple-TOF-MS分析m/z在100~2 000之间的目标物,通过软件分析肽的序列,匹配覆盖率最高的蛋白是由Os05g0499100基因编码的19 kDa globulin,品种来源是Oryza sativasubsp.japonica,整个蛋白的序列是MASKV VFFAAALMAAMVAISGAQLSESEMRFRDRQCQREVQ DSPLDACRQVLDRQLTGRERFQPMFRRPGALGLRMQC CQQLQDVSRECRCAAIRRMVRSYEESMPMPLEQGWS SSSSEYYGGEGSSSEQGYYGEGSSEEGYYGEQQQQPG MTRVRLTRARQYAAQLPSMCRVEPQQCSIFAAGQY。氨基酸序列出峰时间在2~7 min之间,23 条肽的氨基酸序列、分子质量、m/z和保留时间见表3。

表3 胃蛋白酶水解球蛋白多肽序列鉴定Table 3 Identification of globulin peptides derived from enzymatic hydrolysis with pepsin
能够和元素结合的多肽已经有许多报道。早在1973年发现GHK-Cu具有与Cu2+结合能力,多项研究表明GHK-Cu对健康非常有益,特别是在防止氧化应激和退行性老化方面具有显著的功能[17]。Wang Li等[18]报道发现Phe-Val-Asp-Val-Thr具有与Ca2+结合的能力。Kubglomsong等[13]发现多条具有与Cu2+结合活性的多肽,比如多肽序列QGWSSSSSEYYGGEGSSSEQGYYGEG,SSEYYGGEGSSSEQGYYGEG和金属铜有较强的螯合活性。研究发现多个相邻的丝氨酸(serine,S)在分离组分1多肽中占比较高,表明SS、SSS和SSSS可能与铜的结合活性和酶抑制能力相关[4,13,19]。Mandal等[20]报道了丝氨酸残基可以通过羧基和氨基基团上的氧原子和氮原子结合Cu2+,而含有多个丝氨酸的多肽正是通过结合酪氨酸酶中的Cu2+从而抑制其活性。尽管Kubglomsong等[13]已经报道了大米蛋白经木瓜蛋白酶酶解后形成较长的多肽,并具有铜结合能力。实验发现这些多肽序列在经过胃蛋白酶消化后,更倾方于形成较短的多肽,见表3。
基于之前多项研究结论,分析获得的23 个多肽序列,合成肽1:QGWSSSSSE,M=993(包含表3中的肽序号2序列)和合成肽2:YYGGEGSSSEQGY,M=1 599.7(与表3中肽序号22序列相同)进行后续的实验。原因是这两个肽含有SSS和SSSSS连续的丝氨酸序列,同时这两个序列是Kubglomsong等[13]报道的具有铜螯合活性序列(QGWSSSSSEYYGGEGSSSEQGYYGEG)的前半部分和后半部分。其中合成肽2是SSEYYGGEGSSSEQGYYGEG中间部分,具有铜螯合活性和酶抑制能力的可能性很大。
在确定选取这两条多肽后,进行人工合成,并通过质谱进行检测分析,结果见图1。

图1 人工合成的合成肽1(A)和合成肽2(B)检测结果Fig. 1 Mass spectra of artificially synthesized QGWSSSSSE (A) and YYGGEGSSSEQGY (B)
2.3 大米多肽和不同参照物与Cu2+金属离子螯合活性的测定
EDTA是能与Cu2+、Cd2+、Fe2+、Pb2+等二价金属离子结合的一种螯合剂,在很多核酸、酶和蛋白质中作为辅基而发挥作用,因此EDTA可作为核酸酶、蛋白酶的抑制剂。在之前的研究中通过EDTA螯合金属离子形成人工抗原制备重金属的单克隆抗体,表明EDTA具有很强的Pb2+、Cd2+、Hg2+、Cr3+和Cu2+螯合活性,能够在免疫系统中稳定存在并作为抗原位点刺激免疫系统[21-25]。柠檬酸对很多金属离子也具有螯合作用,对于不同的金属离子其螯合的能力也不一样,已经报道可以利用柠檬酸除去大米中的重金属Cd2+而对Pb2+不是很理想[26]。Lerch[27]发现金属硫蛋白在动植物元素转运和去毒方面具有重要作用,并且发现铜金属硫蛋白与镉金属硫蛋白、锌金属硫蛋白具有类似的肽序列,表明蛋白中特定的肽序列具有元素结合的能力。因此,在测定大米多肽与Cu2+螯合活性过程中,选取了EDTA、柠檬酸和金属硫蛋白作为能够与铜螯合的小分子、有机酸和蛋白质的代表。
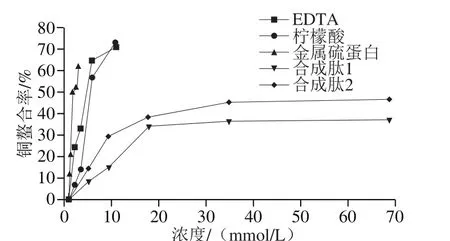
图2 大米多肽和不同参照物与Cu2+金属离子螯合率Fig. 2 Copper-chelating activity of rice peptides and other chelating agents
从图2可知,所测定物质螯合铜能力大小排序为:金属硫蛋白>EDTA>柠檬酸>合成肽2>合成肽1。
IC20、IC50和IC80是某一药物或者小分子抗原的浓度抑制某些生物化学反应过程,抑制效果可以达到相对于空白20%、50%和80%的浓度。包括生物化学反应酶催化、抗原抗体反应等[28]。IC20值越低,对底物或者生化反应的抑制作用效果越好。通过计算IC20可知:EDTA的IC20为1.10 mmol/L,柠檬酸IC20为2.91 mmol/L,金属硫蛋白IC20为0.28 mmol/L,人工合成肽1的IC20为10.78 mmol/L,人工合成肽2的IC20为5.40 mmol/L,人工合成肽2的螯合铜的效果好于人工合成肽1,原因可能是人工合成肽2的氨基酸数量更多,种类更丰富,与Cu2+结合形成的络合物结构更稳定[29]。人工合成肽2螯合Cu2+的效果在低浓度范围内更接近柠檬酸。
2.4 大米多肽和不同参照物与Cd2+、Fe2+、Ca2+金属离子螯合活性的测定
为比较大米多肽和不同参照物与Cd2+、Fe2+、Ca2+的结合能力,用不同浓度的大米多肽溶液、EDTA、柠檬酸和金属硫蛋白溶液跟含有20 mmol/L的Cd2+、Fe2+和Ca2+溶液混合均匀,室温静置反应1 h,检测结果见表4。

表4 EDTA与不同金属离子的螯合活性Table 4 Chelating activity of EDTA toward Cd2+, Fe2+ and Ca2+
以EDTA为例,如果EDTA与Cd2+、Fe2+、Ca2+可以形成螯合物,结合稳定性比与Cu2+螯合物的稳定性相当或者更高,则不会与Cu2+形成螯合物,从而不会影响儿茶紫酚与铜的复合物的数量,显色保持不变。如果形成螯合物的结合稳定性比与Cu2+螯合物的稳定性差,那么在有Cu2+存在时会倾方于与Cu2+形成螯合物,随着EDTA浓度增加,儿茶紫酚与铜的复合物数量降低,显色水平降低。从表4可知,EDTA与Cd2+、Fe2+的结合能力与Cu2+相当或者更强;而与Fe2+的结合能力比Cu2+差。结果与EDTA的螯合稳定性常数一致(lgK(Cu-EDTA)=18.8,lgK(Fe-EDTA)=25.1,lgK(Cd-EDTA)=16.4,lgK(Ca-EDTA)=11.0)[30-31]。
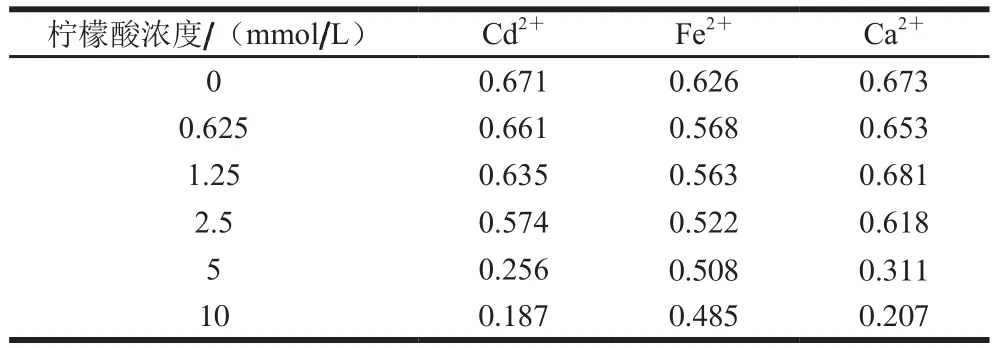
表5 柠檬酸与不同金属离子的螯合活性Table 5 Chelating activity of citric acid toward Cd2+, Fe2+ and Ca2+
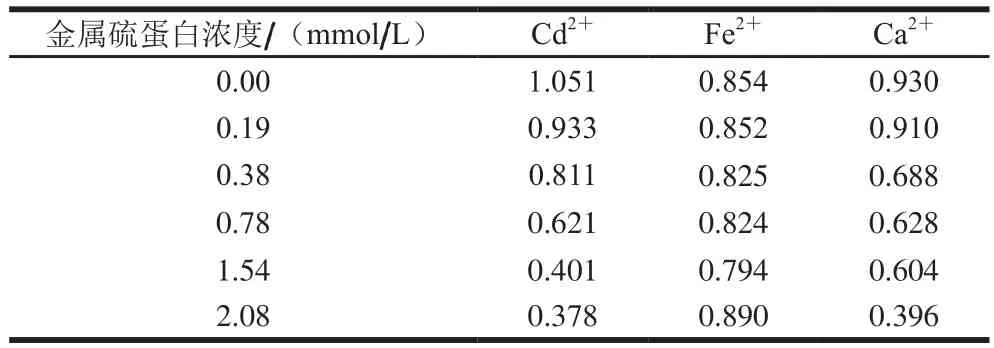
表6 金属硫蛋白与不同金属离子的螯合活性Table 6 Chelating activity of metallothionein toward Cd2+, Fe2+ and Ca2+
从表5可知,Cd2+和Ca2+反应液的吸光度随柠檬酸浓度增加大幅度降低;而Fe2+的吸光度相比较之下几乎不变。结果表明,在柠檬酸和Cd2+和Ca2+螯合后,再加入Cu2+,Cu2+会取代螯合位点的Cd2+和Ca2+,Cu2+与儿茶紫酚的复合物减少,吸光度降低。结果符合金属离子与柠檬酸的螯合稳定性顺序:Cu2+>Cd2+>Ca2+,柠檬酸与Cu2+螯合后的稳定性最好[32]。对于Fe2+,柠檬酸与之螯合后会形成黄色的沉淀,不容易再被Cu2+占据螯合位点,因此会使得溶液的吸光度几乎不变。按照同样的方法得知(表6),金属硫蛋白的螯合金属离子稳定性的顺序为:Fe2+>Cu2+>Cd2+、Ca2+。

表7 合成肽1与不同金属离子的螯合活性Table 7 Chelating activity of synthetic peptide 1 toward Cd2+, Fe2+, Ca2+ and Pb2+
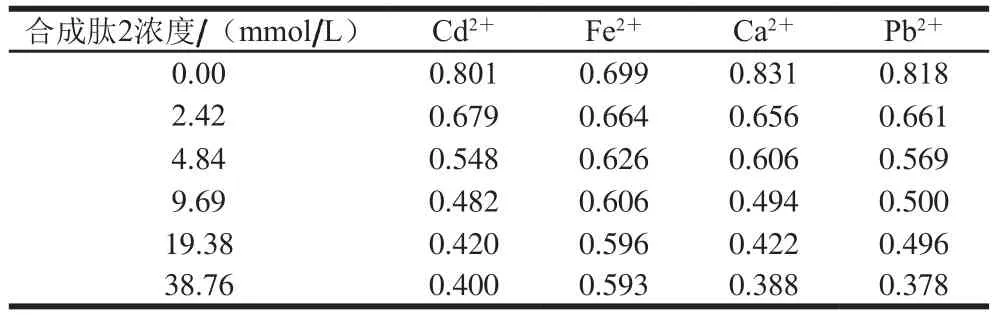
表8 合成肽2与不同金属离子的螯合活性Table 8 Chelating activity of synthetic peptide 2 toward Cd2+, Fe2+, Ca2+ and Pb2+
合成肽1和合成肽2与其他元素的结合效果见表7、8。合成肽1和合成肽2与Cd2+、Ca2+、Pb2+的螯合吸光度变化趋势和大米多肽与Cu2+的螯合活性变化几乎呈现相同的趋势,表明Cd2+、Ca2+、Pb2+与合成肽的螯合物稳定性没有Cu2+强;而Fe2+混合液的吸光度几乎不变,说明Fe2+螯合大米多肽的稳定性比Cu2+要好。因此,合成肽1和合成肽2形成稳定的复合物的顺序是Fe2+>Cu2+>Cd2+、Ca2+、Pb2+。
3 结 论
大米蛋白可以与多种元素结合,是稻谷富集元素的重要组成部分。本实验通过胃蛋白酶酶解大米球蛋白,筛选到两种大米蛋白源金属结合肽。其中,合成肽2在低浓度范围的螯合能力与柠檬酸相当,比合成肽1效果好。这两种金属结合肽与Cu2+螯合能力比EDTA和金属硫蛋白弱很多。在螯合选择性方面,合成肽1和合成肽2都具有较强的Cu2+和Fe2+螯合活性,而与Cd2+、Ca2+和Pb2+金属离子几乎不结合。
