山羊EDNRA基因编码区克隆与组织表达规律分析
2020-01-07周靖宣占思远王林杰张红平
王 梦,周靖宣,占思远,王林杰,李 利,张红平,仲 涛
(四川农业大学动物科技学院/畜禽遗传资源发掘与创新利用四川省重点实验室,成都 611130)
内皮素受体(endothelin receptor,EDNR)是结合内皮素配体的视紫红质受体β 组的G 蛋白偶联受体(G protein-coupled receptor;GPCR)[1],具有7 个跨膜结构域,通常由7 个外显子编码,N 端在细胞外,C 端在细胞内,这决定了内皮素受体与G 蛋白结合后可以参与动物细胞的增殖、迁移、分化和血管生成等多种生理过程[2-3]。内皮素受体家族基因主要包括内皮素受体A 型基因(EDNRA)和内皮素受体B 型基因(EDNRB)[4]。EDNR基因通过与鸟嘌呤-核苷酸结合(G)蛋白从而激活磷脂酰肌醇-钙第二信使系统发挥各种功能。EDNRA基因在羊驼中影响黑色素细胞的形成从而影响毛色的形成,且随着近现代的深入研究发现该基因与人类颅面发育及心血管疾病等有重要关系[5-7]。EDNRA基因主要在胎盘、心房、肾平滑肌、主动脉、脑血管、肺中分布,最新研究表明它可以参与介导平滑肌细胞的增殖和血管收缩舒张[8]。
内皮素(endothelin,ET)通过与受体结合而诱导信号通路,是目前发现的最强的血管收缩的物质[9]。内皮素有3种异构体,包括内皮素-1(ET-1)、内皮素-2(ET-2)、内皮素-3(ET-3)[10]。ET-1与EDNRA具有很高的亲和力,主要通过下游的这两个G 蛋白偶联受体EDNRA和EDNRB发挥作用。ET-1诱导表达受体EDNRA的交感神经元投射到通向心脏的腔静脉[11]。研究发现,内皮素轴组分(EDNRA、EDNRB、ET-1、ET-3)在髓外造血器官的发育中有表达[12]。在人类胚胎发生时期,ET-1-EDNRA轴对称调节颅面和心血管形态的发生,内皮素通路蛋白与动脉粥样硬化相关慢性疾病等血管疾病密切相关[5,13]。急性脑出血大鼠体内内皮素表达升高及血浆降钙素基因相关肽表达降低[14]。EDNRA的过表达可以促进体外骨髓细胞的增值和抗凋亡能力[15]。在非洲爪蟾中发现了第三种内皮素,被称为EDNRC,但对其还未有深入研究[10]。
EDNRA基因的表达与其功能有紧密的关系,但至今有关EDNRA基因的研究多集中在与人类血管有关的疾病上,在草食动物尤其是山羊体内的研究较少,其在山羊各组织中的表达规律尚不明确。因此,本试验以简州大耳羊为试验对象,克隆得到EDNRA的cDNA 序列、预测蛋白质结构并通过qPCR 技术来探究EDNRA在不同组织中的表达规律,为后续功能研究提供理论基础。
1 材料和方法
1.1 材料
试验动物简州大耳羊来自四川省简阳市简州大耳羊育种场,随机采集无亲缘关系的3 只2 月龄健康母羊的心脏、肝、脾、肺、肾、大脑和网膜共7 个组织样品,取各组织样3~5 g,用无菌生理盐水处理,迅速置于液氮中带回试验室,置于-80 ℃冰箱中保存备用。
1.2 方法
1.2.1 总RNA 的提取和反转录
将提前冻存的样品在液氮中迅速研磨成粉,采用Trizol(Invitrogen,美国)法提取样品的总RNA 后用核酸蛋白检测仪(Bio-Rad,美国)测定RNA 浓度(A260nm/A280nm>1.8),再经1.5%琼脂糖凝胶电泳进一步鉴定。采用反转录试剂盒PrimeScrip RT reagent Kit(TaKaRa,Dalian,China)对总RNA 进行反转录合成cDNA,编号后置于-20 ℃保存备用,RNA 存放于-80 ℃保存备用
1.2.2 引物设计与合成
下载NCBIGenBank 数据库中公布的山羊EDNRA基因的序列(XM_005691200.3),通过BLAST 对序列进行在线比对,确定EDNRA基因的保守序列,利用Primer Premier 5.0 软件设计引物(表1),用于基因的PCR 扩增及克隆测序。再根据克隆测序得到的山羊EDNRA基因CDS 全长序列及内参基因β-Actin序列设计实时定量PCR引物(表1)。引物均由成都擎科生物科技有限公司合成。并通过BLAST工具进行比对检索和PCR产物测序结果,验证引物的特异性。
1.2.3EDNRA基因的克隆与测序
以肝脏组织cDNA 为模板,PCR 扩增山羊EDNRACDS 区全长序列。PCR 扩增反应体系为30 μL:2×TaqPCR Master Mix 15 μL,ddH2O 11.5 μL,cDNA 0.5 μL,上、下游引物(10 μmol/L)各1.5 μL。PCR 扩增反应条件为:95 ℃预变性4 min;94 ℃变性45 s,退火(温度见表1)30 s;72 ℃延伸90 s,35 个循环;72 ℃延伸8 min;12 ℃保存。PCR 产物扩增后,在1.5%琼脂糖凝胶检测PCR 扩增产物,紫外凝胶成像仪(Bio-Rad)观察结果。使用凝胶回收试剂盒(TIAN gel Midi Purification Kit)纯化回收目的片段。将纯化回收的产物进行T-A 克隆,将EDNRA序列在16 ℃温度下连接到pMD19-T 载体上,转化大肠埃希菌DH5α 感受态细胞,涂布于LB 培养基中,37 ℃恒温箱培养过夜,挑选单克隆菌落扩大培养,将初步鉴定为阳性克隆的重组质粒送成都擎科伟业生物技术有限公司测序。
1.2.4EDNRA的生物信息学分析
对山羊EDNRA基因CDS 区进行序列分析和蛋白生物信息结构功能预测,分析预测工具见表2。
1.2.5EDNRAqPCR 检测
根据克隆得到的山羊EDNRA序列,选用βactin(NM_001009784)作为内参基因。采用Primer Premier5.0 软件设计实时荧光定量引物(表1)。使用Bio-Rad CFX 96 荧光定量PCR 仪检测目的基因及内参的表达量,每组3个重复。反应体系为10 μL:SYBRPremix ExTaqTMⅡ(TaKaRa,Dalian,China)5 μL,上下游引物(10 μmol/L)各0.4 μL,cDNA 模板0.8 μL,ddH2O 3.4 μL。反应条件.:95 ℃预变性30 s;95 ℃5 s,58.5 ℃30 s,39 个循环;以0.5 ℃/s的速度65 ℃缓慢递增到95 ℃,同时对荧光信号的变化进行观察,如果随着温度的升高信号强度随着降低,且形成一个单一的峰,没有任何杂峰,则说明产物的扩增为特异性的。

表1 引物信息Table 1 Primer information

表2 DNA 和蛋白质序列数据分析工具Table 2 DNA and protein sequence data analyses tools
1.3 统计分析
Bio-Rad CFX 96 荧光定量PCR 得到的结果采用2-ΔΔCt方法分析各目的基因的相对表达量,数据均用平均值±标准误表示,并用SAS 8.0 软件的GLM过程进行最小二乘分析,Duncan 法进行多重比较。
2 结果与分析
2.1 EDNRA 编码基因扩增及克隆结果
根据羊EDNRA基因mRNA 设计特异性引物,以山羊肝脏cDNA 为模板扩增后,在1.5%琼脂糖凝胶检测PCR 产物,紫外凝胶成像仪(Bio-Rad)观察所获得目标产物为1 284 bp(图1)与预期结果相符。克隆测序结果显示,片段大小为1 284 bp,与预期目的条带大小一致。
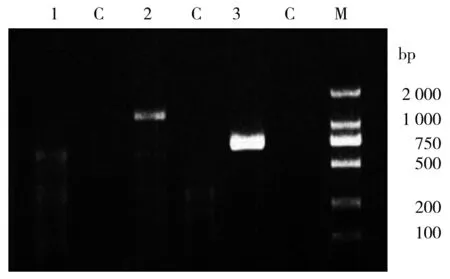
图1 山羊EDNRA 基因PCR 扩增产物琼脂糖凝胶电泳图Figure 1 Agarose gel electrophoresis of goat EDNRA gene amplified by PCR
2.2 EDNRA 序列分析
根据测序得到的CDS 全长序列,使用NCBI 的工具ORF Finder 对克隆得到的山羊EDNRA基因序列进行开放阅读框分析,得知该基因包含一个1 284 bp 的最长开放阅读框。该序列编码427 个氨基酸,含信号肽序列(第1 到第20 位氨基酸),以及7 型跨膜受体同系物结构域(图2)。
2.3 山羊EDNRA 蛋白质分析
2.3.1 蛋白质理化性质分析
在线软件ProtParam 分析结果显示蛋白质分子量为48 378.83 g/mol,等电点为8.354。负电荷氨基酸残基总数(Asp + Glu)28 个,正电荷氨基酸残基总数(Arg+Lys)是36 个。分子式C2200H3428N562O600S33,其不稳定系数为39.07,脂肪系数为100.87,总平均亲水指数0.325。

图2 山羊EDNRA 序列分析Figure 2 Sequence analysis of goat EDNRA
2.3.2 蛋白质亲水性/疏水性分析
关于蛋白质的亲水性/疏水性,从ProtScale 预测得到,EDNRA基因编码的多肽链的第312、位存在最大值3.422,疏水性最强。第412 位存在最小值-3.300,亲水性最强,整条链中亲水性氨基酸残基少于疏水性氨基酸残基,由此推测该基因编码的蛋白为疏水性蛋白(图3)。
2.3.3 蛋白质信号肽及跨膜结构域测分析
从Signal P 4.1 Server 预测信号肽的结果中可以看出,EDNRA基因在氨基酸序列的第20 和21位存在一个潜在的信号肽断裂位点,概率为0.450。S 和Y 指标最高点均处于20~21 位区间,表明EDNRA基因编码蛋白的1~20 位可能为该蛋白的信号肽,属于分泌蛋白(图4)。
PSORT 在线软件对目的蛋白进行亚细胞定位,结果发现该蛋白存在于细胞外的可能性为0.64,存在高尔基体的可能性为0.46,存在内质网膜的可能性为0.37,存在内质网腔的可能性为0.10,因此推测该蛋白属于膜外蛋白。
2.3.4 潜在磷酸化位点分析

图3 EDNRA 基因编码氨基酸疏水性/亲水性的预测Figure 3 Prediction of amino acid hydrophobicity/hydrophilicity encoded of EDNRA gene
氨基酸序列潜在磷酸化位点使用在线工具NetPhos 2.0 Server 分析,结果显示该序列具有潜在的磷酸化位点,总数为35,且分别位于丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)3种氨基酸上,其中丝氨酸(Ser)上潜在的磷酸化位点数最多,为20 个(图5)。
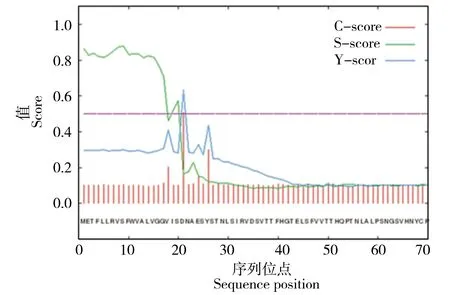
图4 EDNRA 基因编码蛋白信号肽预测Figure 4 Prediction of EDNRA gene coding protein signal peptide
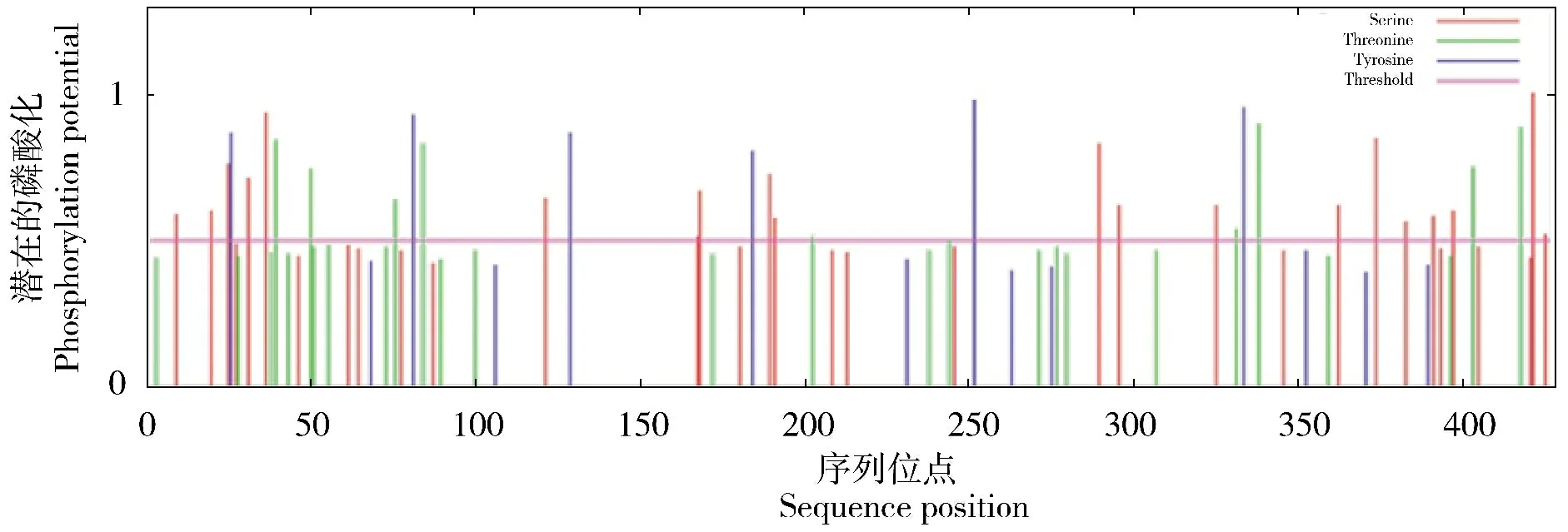
图5 EDNRA 基因氨基酸序列潜在磷酸化位点分析Figure 5 Analysis of potential phosphorylation sites of amino acid sequence of EDNRA gene
2.3.5 蛋白质二级结构预测
使用SOPMA 预测该蛋白的二级结构由α-螺旋(44.96%)、延伸链(13.58%)、无规则卷曲(39.11%)和β 转角(2.34%)4 种结构元件组成,其中α-螺旋和无规则卷曲比例较高(图6)。
2.3.6 蛋白质三级结构预测
EDNRA 蛋白可能的三级结构如图所示(图7),其主要构成依然为α-螺旋、延伸链、无规则卷曲和β 转角,与二级结构预测结构基本一致。其全局模型质量估计(Global model quality estimation,GMQE)值为0.66。
2.4 EDNRA 基因相似性及亲缘关系进化树分析
本研究采用基于系统遗传学的最大似然法(maximum likelihood)和贝叶斯分析法(Bayesian inference)进行系统发育的构建。在贝叶斯分析中,通过MrModeltest 2.3 中的Akaike information criterion(AIC)选择在DNA 序列中使用一个一般的时间可逆模型,其中有一定比例的不变位点,位点分布率不同。使用Phyml 引导评估树的稳定性。数据按密码子位置进行分区,本研究使用4 个独立的链(每1 000 代取样一次)进行了500 万代Bayesian Markov chain Monte Carlo 分析,前50 万代被丢弃。当分裂频率的平均标准差小于0.01 时,认为平稳性。为了得到一系列的系统发育距离收集了绵羊(Ovisaries)、牛(Bostaurus)、野牛(Bison)、野猪(Susscrofa)、驴(Equusasinus)、猕猴(Macacamulatta)、人(Homosapiens)、小鼠(Musmusculus)、褐家鼠(Rattusnorvegicus)的EDNRA氨基酸序列。初始数据集和完整数据集的蛋白质序列使用默认参数设置,分别由MUSCLE对齐,它是发现的性能最好的对齐程序之一。选择最小化手工对其编辑来避免引入偏差。PAL2NAL 是一种利用匹配氨基酸序列构建多密码子序列比对的程序,可以精确的获得序列的核苷酸对比。系统进化如树图8 所示。分析结果表明,山羊EDNRA基因和绵羊、牛以及野牛的亲缘关系较近。

图6 EDNRA 蛋白二级结构预测Figure 6 Secondary structure prediction of EDNRA protein

图7 EDNRA 蛋白三级结构预测Figure 7 The tertiary structure prediction of EDNRA protein
2.5 基因的组织表达分析
应用qPCR 的方法检测了山羊EDNRA基因在心、肝、脾、肺、肾、大脑和网膜组织7 种组织中的表达情况。以β-actin作为内参基因,检测的表达结果为:山羊EDNRA基因在心脏的表达量最高,在肝、脾、肾、大脑、网膜组织中的表达量较低,而在肺中表达最少(图9)。
3 讨论
本研究通过克隆获得了山羊该基因CDS 全序列,EDNRA基因编码区长度为1 284 bp,位于17号染色体上。EDNRA基因编码427 个氨基酸。蛋白质分子量为48 378.83 g/mol,分子式C2200H3428N562O600S33,等电点为8.353,负电荷氨基酸残基总数(Asp + Glu)28 个,正电荷氨基酸残基总数(Arg + Lys)是36个。其不稳定系数为39.07,脂肪系数为100.87,总平均亲水指数0.325。信号肽预测发现EDNRA基因在氨基酸序列存在潜在的信号肽,属于分泌蛋白,这表明了该蛋白可以转运到不同膜结构的亚细胞器内,并发挥相应的功能。据对目的蛋白的亚细胞定位,发现该蛋白存在于细胞外的可能性较大,适应于G蛋白偶联受体的功能,信号间传导通过细胞膜信号传导器G 蛋白将信息通过活化的受体从细胞外传到细胞内[3]。氨基酸序列存在潜在磷酸化位点,总数为35,且分别位于丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)3种氨基酸上,其中丝氨酸(Ser)上潜在的磷酸化位点数最多,为20 个,这使细胞间的各种信号可以有效传递和交流。该氨基酸序列与绵羊(Ovisaries)、牛(BosTaurus)、猪(Susscrofa)、人(Homosapiens)、小鼠(Musmusculus)的相似性分别为98.59%、98.13%、94.61%、93.68%和90.40%。这与氨基酸序列构建的系统进化树结果保持一致,也进一步证实了EDNRA序列在物种间具有高度保守性。通过在核苷酸和氨基酸水平上的同源比对分析,结果表明山羊EDNRA同源性与绵羊、牛、野牛相似度较高,即分类学观点也得到印证,即都属反刍亚目,牛科。在蛋白质二、三级结构中主要以α-螺旋为主。
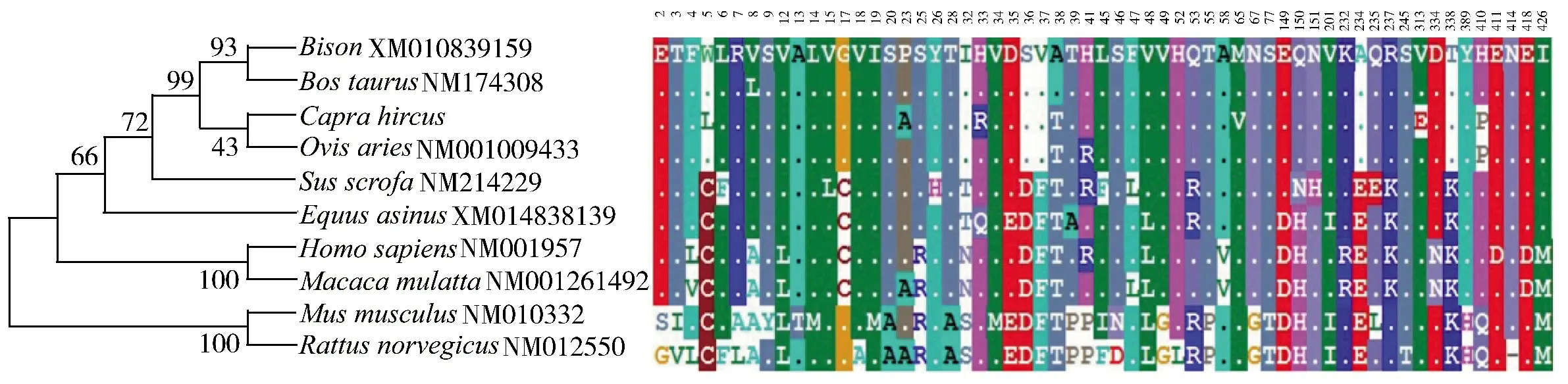
图8 哺乳动物EDNRA 基因系统进化树Figure 8 Phylogenetic tree of EDNRA gene in mammals
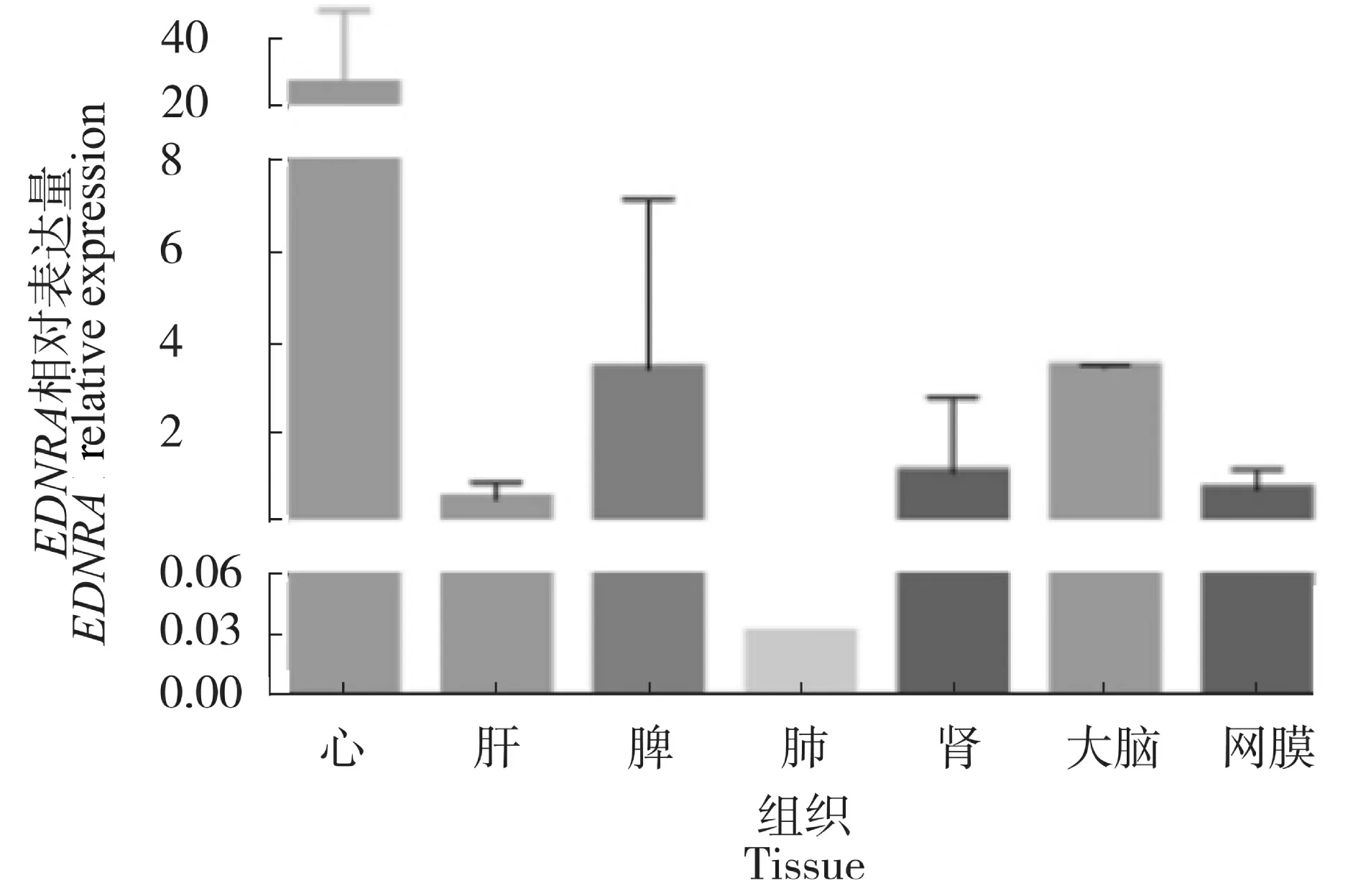
图9 EDNRA 基因在7 种组织中的表达Figure 9 Expression of EDNRA gene in 7 tissues
山羊EDNRA基因qPCR 检测结果表明,EDNRA基因在山羊心脏中高表达,在肝、脾、肾、大脑和网膜中低表达,在肺脏内几乎不表达。推测EDNRA在心脏行使其功能的过程中发挥重要,这与Honore Jean-Claude 等[14]的研究一致。内皮素是轴突生长的一般介质,指导由动脉构成的交感神经细胞轴突的发育,轴突支配和控制着大量的靶细胞,包括外分泌腺和内分泌腺的导管,肠和血管的平滑肌层,心肌和节点等[16]。心脏是动物的重要器官,参与血管中的血液循环,由心脏传导系统调节的自身的协调收缩是生存所必需的[17]。有研究表明,在发育中的鸡胚中,EDNRA在心肌细胞中表达,心肌细胞内皮素信号传导足以诱导鸡的心肌细胞转分化为外周浦肯野纤维,进而影响心脏传导系统[18]。EDNRA缺失的胚胎心脏常表现为心室壁发育不全,有丝分裂活性低,Tbx5表达降低,Tbx2表达呈倒数扩张[19]。EDNRA是对血管有舒张和收缩作用的因子[20]。EDNRA基因在内皮素通路中的作用较为关键,容易受到基因变异的影响,内皮素系统对血管内皮功能的任何改变都可能导致其病理生理学改变[21]。在人类和动物模型中的研究表明,ET-1和EDNRA信号在正常颅面发育过程中和咽弓的形成模式有重要作用[22-23]。在小鼠的试验中发现,转录因子SIX1通过抑制背部内胚层内皮素1 的表达来调控背弓发育,从而阻止背侧EDNRA信号的传递[24]。还有研究发EDNRA可能在藏鸡胚胎对缺氧的适应中发挥关键的调控作用[25],这可能与血管中红细胞数量有关。这些功能研究在山羊中还未见报道,因此,EDNRA的具体功能和作用机制还有待进一步研究。
4 结论
本研究成功获得山羊EDNRA基因CDS 序列1 284 bp,编码427 个氨基酸,在物种间保守程度较高。EDNRA 蛋白含信号肽序列(第1 到第20 位氨基酸),以及7 型跨膜受体同系物结构域,编码产物具有疏水性,属分泌蛋白,存在35 个潜在的磷酸化位点,分别位于丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)3种氨基酸位点上。其二级结构主要以α-螺旋,弯曲折叠后形成复杂的三级结构。亲缘关系进化树分析发现山羊EDNRA基因和绵羊、牛以及野牛的亲缘关系较近。 qPCR 检测结果表明,山羊EDNRA基因在心脏中高表达,在肝、脾、肾、大脑、网膜组织中的表达量较低,而在肺中表达最少。本试验为进一步研究EDNRA在山羊心脏中的功能作用奠定基础。
