甘薯盐胁迫响应基因IbNAC14的克隆、生物信息学及表达模式分析
2020-01-07孟小庆娜菲莎艾买提江李淑清朱明库
余 静,孟小庆,娜菲莎·艾买提江,李 格,张 颖,李淑清,朱明库
(江苏师范大学生命科学学院,江苏徐州 221116)
干旱、高盐、极端高温和低温等非生物胁迫往往会抑制作物的正常生长,从而对其产量造成重大损失。近年来,植物复杂的胁迫应答机制随着胁迫响应基因的鉴定而被逐渐揭示出来,这些基因编码着重要的代谢或调控蛋白,其中转录因子在植物胁迫响应过程中发挥着关键角色。比如AREBs(ABA响应元件结合蛋白),DREBs(脱水响应元件结合蛋白),MYB 蛋白,WRKY 蛋白,bZIP(碱性亮氨酸拉链蛋白)和NAC 蛋白等已被证实广泛参与了植物对环境胁迫应答的调控过程[1-3]。
NAC 蛋白是植物特异性转录因子中最大的家族之一,其成员的N 端含有一个长度约150 个氨基酸的保守NAC 结构域,C 端为非保守性的转录调控区,该区域可能具有转录激活活性或抑制活性[4-5]。NAC 蛋白的NAC 结构域和C 末端均具有蛋白结合活性,其能够以同源或异源二聚体的形式发挥作用,这种形式是实现稳定的DNA 结合所必需的[6-7]。现有研究表明,NAC 转录因子广泛地参与了植物生长发育以及对生物与非生物胁迫的响应等过程。生长发育方面,NAC 基因参与了侧根发育、茎尖分生组织发育、开花、衰老、次生壁增厚和种子形成等过程[8-9]。比如AtNAC1基因通过介导生长素信号从而参与了拟南芥的侧根发育[9]。
在生物和非生物胁迫响应方面,转录组分析显示在干旱、高盐、低温或ABA 处理下,至少有20%~25%的NAC 基因参与了其中一种处理的响应过程[10]。干旱、高盐或ABA 能够上调拟南芥ANAC019、ANAC055、ANAC072、ATAF1基因和水稻SNAC1、OsNAC5、OsNAC6等NAC 基因的表达,相应的超表达遗传转化或突变体的功能分析也验证了它们确实在耐盐或抗旱中扮演重要角色[11]。拟南芥RD26基因在非生物胁迫信号转导和病原菌防御中发挥重要作用,芯片分析结果表明ABA 和胁迫响应相关基因在RD26超表达转基因植株中表达上调,而在沉默RD26的转基因植物中表达下调[12]。超表达水稻SNAC1和OsNAC6基因的植物表现出明显增强的抗旱性和耐盐性,且SNAC1的超表达并不影响水稻的表型和产量,因而展现出很高的育种价值[13-14]。之前我们发现番茄SlNAC4基因的表达受高盐、脱水和高温等胁迫的诱导,SlNAC4基因沉默表达的植物抗旱性和耐盐性均变弱[15]。
甘薯[Ipomoeabatatas(L.) Lam.]是重要的粮食、饲料与工业原料,我国的甘薯种植面积和产量均为世界首位。甘薯在我国长期扮演着抗灾救荒、保命粮的角色,是保障粮食安全的底线作物[16]。因此,了解甘薯响应环境胁迫的机制将会为培育高抗性甘薯品种奠定基础。当前甘薯中涉及NAC 基因的研究报道极为有限。超表达IbNAC1基因增强了甘薯对机械损伤和虫害的抗性。研究发现转录激活因子IbbHLH3和转录抑制因子IbbHLH4 通过结合G-box 基序共同参与调节IbNAC1 介导的伤害信号响应[17]。最近我们利用RNA-seq 分析从耐盐性品种徐薯22 与盐敏感性品种徐薯32 分离得到12 个IbNAC基因,并将其命名为IbNAC1L和IbNAC3-IbNAC13,且大多数IbNAC基因的表达受高盐和干旱等胁迫的诱导[4]。通过进一步的检索,我们筛选到另一个新的甘薯NAC基因,并接着将其命名为IbNAC14。我们根据RNA-seq 的测序序列设计引物,从徐薯22 cDNA 中克隆出IbNAC14 基因的开放阅读框序列,并将其注册到NCBI 中(GenBank 登录号:MH660528)。本研究通过对IbNAC14基因及其编码蛋白进行系统的生物信息学分析,同时利用定量PCR 检测其在多种非生物胁迫和激素处理下的表达情况,旨在为进一步探究IbNAC14基因在甘薯胁迫应答中的功能奠定基础。
1 材料和方法
1.1 试验试剂
RNA 提取使用的Trizol 试剂,反转录使用的PrimeScript 酶,基因克隆使用的PrimeSTARRHS DNA 聚合酶、pMD19-T 载体;qRT-PCR 分析使用的TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)均购买自大连TaKaRa 公司。DNA marker 和抗生素Amp购买自sigma 公司。
1.2 试验方法
1.2.1 甘薯盐胁迫处理RNA-seq 数据中NAC 基因的筛选
待徐薯22 与徐薯32 水培植株生长至含有5~6个功能叶与8~10 cm 长的不定根时,选取生长一致的植株用150 mM NaCl 处理24 h,然后采集根和叶样品用于RNA-seq 分析。通过用关键词“NAC”和“NAM”在获得的转录组数据中进行搜索,检索到的序列利用生物学信息学工具进行分析确认,只有翻译的蛋白中包含有一个长度约150 个氨基酸的保守NAC 结构域的序列才被用于下一步对比分析。
1.2.2IbNAC14基因的克隆及测序
以培养的徐薯22 植株的根和叶组织进行混合取样,根据说明书提取总RNA 后通过反转录获得cDNA。根据转录组数据库中编号为c57745.graph_c0的序列设计引物F-IbNAC14-F/R(见表1),引物由南京金斯瑞生物科技有限公司合成。PCR 步骤如下:分别加入21 μL ddH2O、25 μL PrimeSTAR HS(Premix)、2 μL cDNA 及F-IbNAC14-F/R引物各1 μL(10 μmol/L),于98 ℃10 s,60 ℃5 s,72 ℃1 min,35个循环。经电泳检测大小正确后,目的片段连接到pMD-19 载体,送郑州擎科新业生物技术有限公司进行测序。
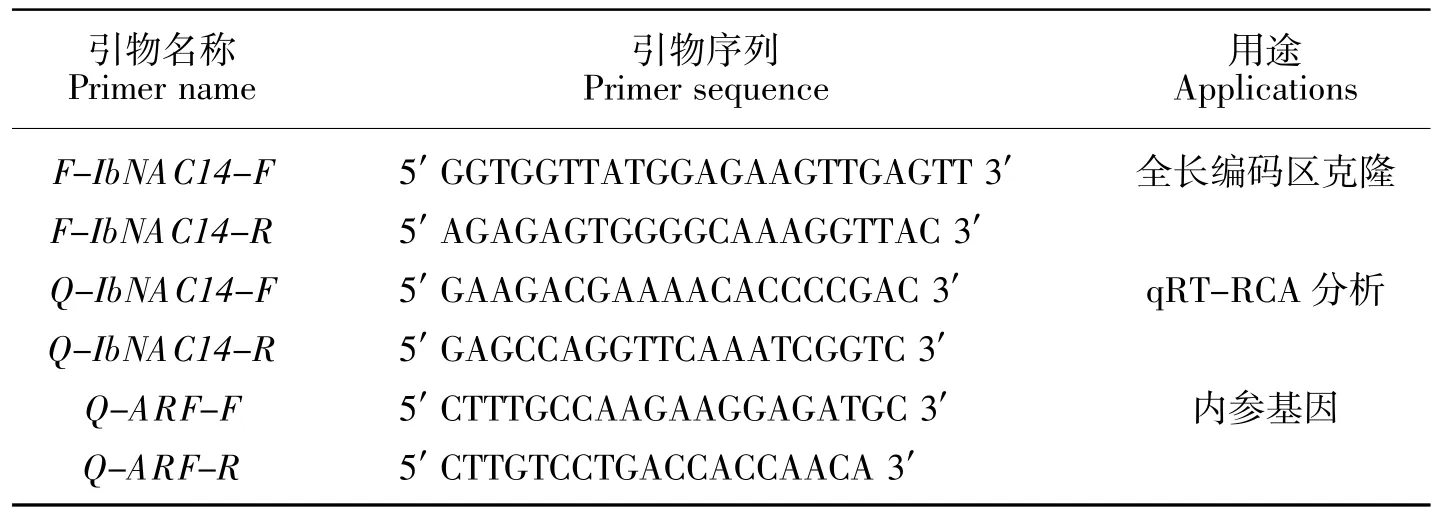
表1 克隆和qRT-PCR 表达分析引物Table 1 Primers used in cloning and qRT-PCR analysis
1.2.3IbNAC14基因生物信息学分析
IbNAC14基因的生物信息学分析通过相应的在线数据库或软件完成。核苷酸序列的翻译、蛋白保守结构域检索等应用NCBI(https://www.ncbi.nlm.nih.gov/)及ScanProsite(https://prosite.expasy.org/)数据库进行;利用SOPMA(http://www.prabi.fr/)、ExPASy(https://www.expasy.org/)和NetPhos(http://www.cbs.dtu.dk/index.html)等在线程序分析IbNAC14 蛋白的理化性质、磷酸化位点和二级结构等;利用MEME(http://meme-suite.org/)在线程序分析序列保守结构域,DNAMAN 软件(5.2.2)进行NAC 蛋白序列的多重比对分析,利用MEGA 软件(5.04)构建neighbor-joining系统进化树分析,参数为bootstrap replicates 1000,poisson model 和pairwise deletion。
1.2.4 非生物胁迫与激素处理以及qRT-PCR 表达分析
徐薯22 幼苗的非生物胁迫处理(高盐和干旱)以及激素处理(ABA、ACC、GA3和JA)的具体步骤参见我们之前的实验方法进行[4],所收取的所有叶片鲜样迅速用液氮速冻,保存于-80 ℃冰箱中备用。根据IbNAC14基因的测序序列设计用于定量PCR分析的特异性引物(见表1),分别以未处理、各胁迫和激素处理下的叶片cDNA 为模板,以甘薯ARF 基因(GenBank 登录号:JX177359)为内参基因[18],在CFX96 Real-Time System(Bio-Rad,USA)仪器上进行定量PCR 分析。具体体系和步骤如下:3.2 μL ddH2O、5 μL TB Green Premix Ex Taq Ⅱ(Tli RNaseH Plus)、1 μL cDNA 模板及Q-IbNAC14-F/R引物(10 μmol/L)各0.4 μL,反应程序为95 ℃10 s,然后95 ℃5 s,60 ℃45 s,40 个循环,然后进行融解曲线分析。
考虑到基因表达数据的生物学意义,我们采用两倍的阀值来判断IbNAC14 基因是否受到非生物胁迫和激素处理的诱导或抑制[19]。
2 结果与分析
2.1 甘薯盐胁迫响应IbNAC14 基因的筛选
从徐薯22 盐处理叶vs 徐薯22 叶对照的转录组数据中,我们搜索到1 条编号为c57745.graph_c0的序列,swissprotein 注释为NAC transcription factor(见表2),经进一步的生物学信息学分析确认,其包含有NAC 蛋白的典型结构域。因之前我们报道并注册完成了甘薯IbNAC1L和IbNAC3-IbNAC13基因[4],因此我们按顺序将其命名为IbNAC14。转录组数据分析显示,该基因的表达受盐胁迫处理后的诱导水平为1.98 倍,暗示IbNAC14基因可能参与了甘薯对盐胁迫的响应。
2.2 IbNAC14 基因的生物信息学分析
2.2.1IbNAC14基因及所编码蛋白的理化性质分析
序列分析表明IbNAC14基因的编码区长度为771 bp,编码256 个氨基酸。IbNAC14 蛋白分子量大小为28.73 kD,理论等电点pI 为8.89,说明其为碱性蛋白。其中含有29 个带负电荷的氨基酸残基(Asp+Glu),39 个带正电荷氨基酸残基(Arg+Lys),分别占氨基酸总数的11.33%和15.23%。利用ProtScale 程序分析表明IbNAC14 蛋白的平均疏水性为-0.732,表明其为亲水性蛋白,其中第237 位的Asp 亲水性最强(-3.2),第157 位的Cys 疏水性最强。

表2 甘薯IbNAC14 基因的转录组注释信息Table 2 The RNA-seq information of sweetpotato IbNAC14 gene
NetPhos 3.1b 磷酸化位点分析显示,IbNAC14蛋白可能的Ser 磷酸化位点、Thr 磷酸化位点和Tyr磷酸化位点分别为17、11 和3 个,暗示IbNAC14 蛋白的翻译后磷酸化修饰对其功能的实现有重要作用。
2.2.2 IbNAC14 蛋白二级结构及序列相似性分析
SOPMA 预测分析显示IbNAC14 蛋白具有16.02%的α 螺旋,19.14%的β 折叠,4.69%的β 转角和60.16%无规卷曲。通过ScanProsite 的功能域查找表明,IbNAC14 蛋白N 端具有1 个典型的NAC 结构域以及A-E 5 个保守的亚结构域,长度为149 个氨基酸残基,但是C 端是高度变异的(见图1)。IbNAC14蛋白序列的多重序列比对分析显示,其与已知的几个甘薯NAC 蛋白序列相似性并不是很高(见图1c),其中与IbNAC3 蛋白的序列相似性为42.1%,与IbNAC1 和IbNAC4 蛋白的序列相似性分别为39.4%和35.5%。尽管如此,甘薯IbNAC14 蛋白的A-E 亚结构域序列与其他甘薯NAC 蛋白序列依然具有高度的相似性(见图1)。
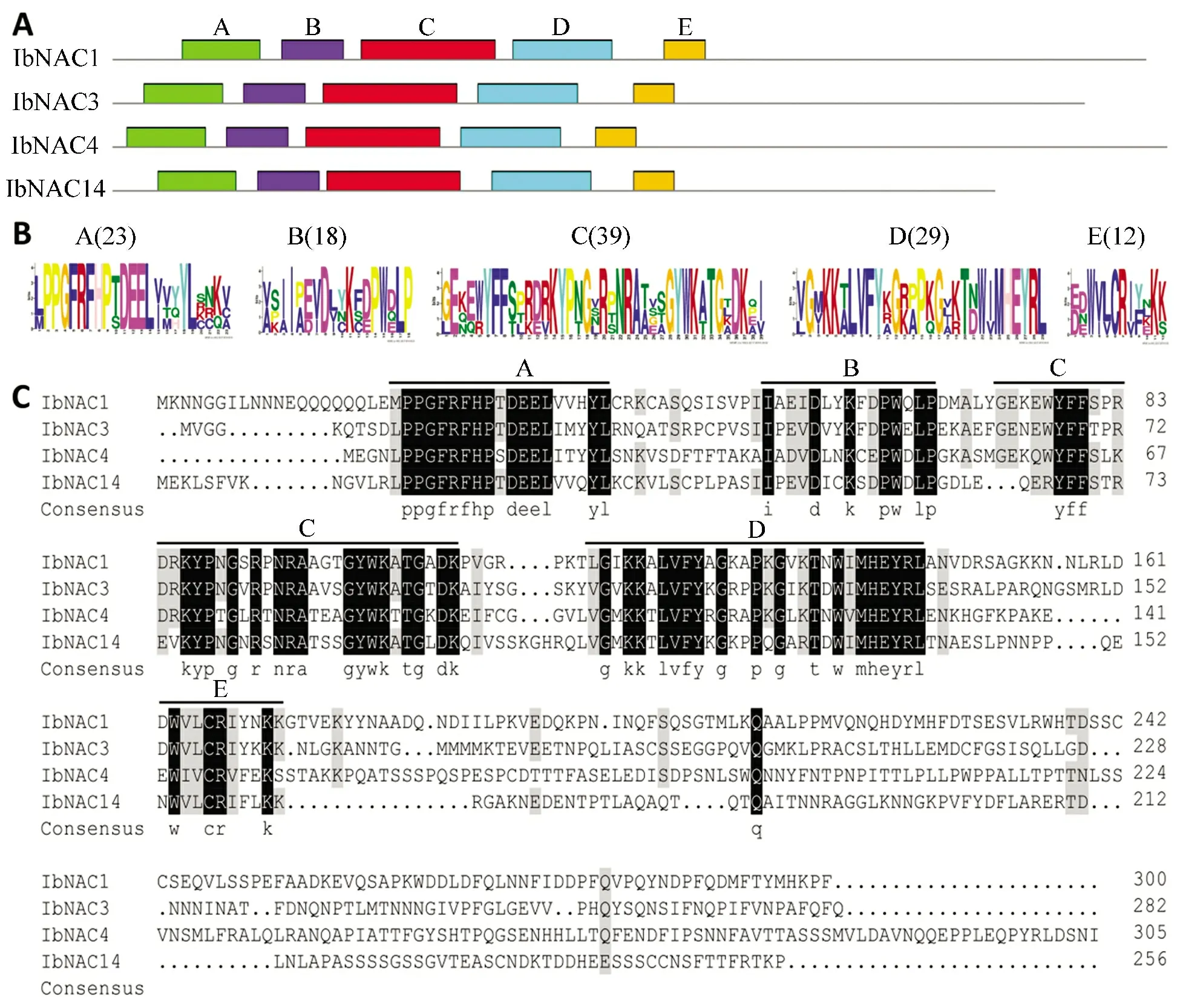
图1 甘薯IbNAC14 蛋白氨基酸序列的保守结构域分析Figure 1 Conserved domain analysis of IbNAC14 protein in sweetpotato
2.2.3 IbNAC14 蛋白的系统进化树构建
为了揭示甘薯IbNAC14 蛋白与其他植物NAC蛋白的进化关系,36 个来自拟南芥、甘薯和水稻等已报道的NAC 蛋白被用于构建系统发生树。图2 表明,IbNAC14 蛋白与IbNAC12、ANAC041 以及SENU5同在一个亚组。研究发现SENU5基因可能参与了番茄叶片的衰老[20],IbNAC12基因的表达受到低温、高温和ABA 的诱导[4],暗示IbNAC14基因可能参与甘薯生长发育与逆境响应过程。
构建系统进化树的蛋白序列登录号及参考文献如下:甘薯(Ipomoeabatatas):IbNAC1,ACT55332.1[17];IbNAC1L,MG657368;IbNAC3,MG657369;IbNAC4,MG657370;IbNAC5,MG657371;IbNAC6,MG657372;IbNAC7,MG657373;IbNAC8,MG657374;IbNAC9,MG657375;IbNAC10,MG657376;IbNAC11,MG6573 77;IbNAC12,MG657378 and IbNAC13,MG657379[4]。拟南芥(Arabidopsisthaliana):ANAC036,At2g17040.1;ANAC041,At2g33480.1;ANAC046,At3g04060.1;ANAC053,At3g10500.1;ANAC061,At3g44350.1[21];ATAF1,NP_171677.1[22];ATAF2,NP_680161.1[23];ANAC019,NP_175697.1;ANAC055,AAM61076.1;ANAC072,NP_567773[24];NAC1,AF198054[9];AtNAC2,AAO41710.1[25];AtNAC3,BAB20599.1[26];CUC1,BAB 20598.1[26];CUC2,BAA19529.1[27];NAP,AJ222713.1[28]。番茄(Solanumlycopersicum):SENU5,Z75524.1[20]。水稻(oryzasativa):OsNAC2,DQ520641[29];ONAC011,AK063648;ONAC022,AK107090[21]。烟草(Nicotiana tabacum):TERN,AB021178[30]。
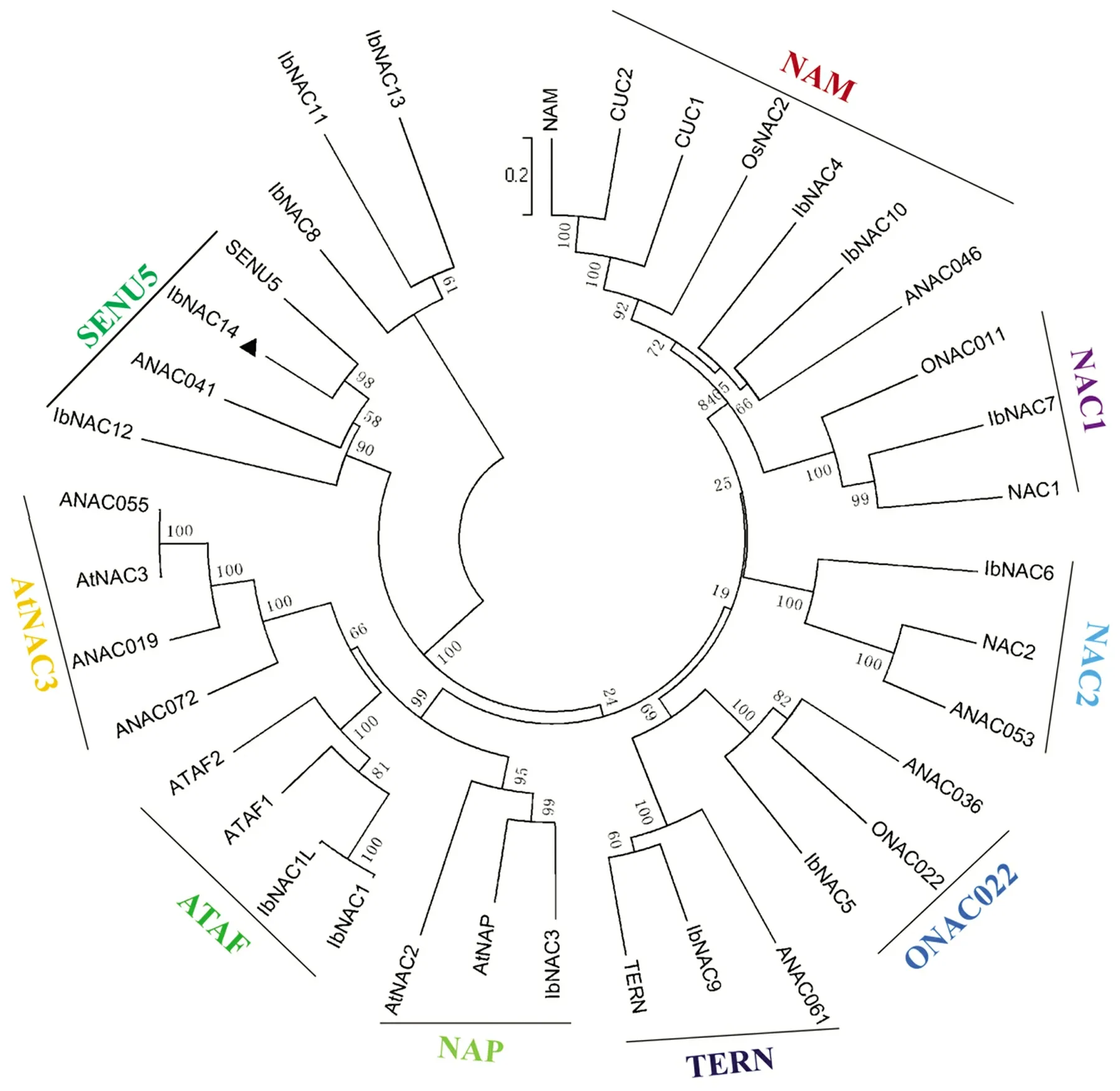
图2 甘薯IbNAC14 蛋白与其他植物NAC 蛋白的系统进化树分析Figure 2 Phylogenetic tree of sweetpotato IbNAC14 and other plant NAC proteins
2.3 IbNAC14 基因对盐和干旱胁迫处理的表达模式分析
我们从NaCl 处理下的RNA-seq 数据中筛选出IbNAC14基因,信息学分析表明IbNAC14基因可能参与响应胁迫应答。因此,我们进一步利用qRTPCR 检测其在高盐和干旱胁迫条件下的响应情况。结果表明盐胁迫能够上调IbNAC14基因的转录水平(见图3),这与转录组测序的结果相一致。此外,干旱胁迫也能显著诱导IbNAC14基因的表达,并在干旱胁迫处理48 h 后达到160 倍左右,进一步暗示其可能与甘薯胁迫响应密切相关。
2.4 IbNAC14 基因对各激素处理下的表达特性分析
为进一步检测IbNAC14基因的表达是否受激素处理的诱导,我们利用qRT-PCR 分析了IbNAC14基因在ABA、ACC、GA3和JA 处理下的表达情况(见图4)。结果显示,IbNAC14基因能够被ABA 和ACC诱导表达,但不受GA3和JA 处理的诱导表达(不足两倍的阈值标准)。
3 讨论
目前,有关NAC 转录因子在植物中的功能研究主要局限于拟南芥和水稻等模式植物中,而且NAC基因发挥作用的具体机理依然不清晰。因此,仍需后续的研究工作进一步探讨NAC 基因家族的功能和作用机理。甘薯作为保证我国粮食安全的底线作物,其NAC 基因的研究依然很有限。本研究中我们从徐薯22 盐处理叶vs 徐薯22 叶对照的RNA-seq 数据中分离得到一个新的甘薯NAC 基因IbNAC14,并对其进行系统的生物信息学分析,同时评估了其在非生物胁迫和激素响应中的可能功能。结构分析表明,IbNAC14 蛋白N 端含有一个典型的NAC 结构域,且5 个亚结构域A-E 是高度保守的,而作为转录调控区的C 端是高度变异的,暗示不同的甘薯NAC 基因可能起着不同的调控作用[4,19]。生物信息学分析表明,IbNAC14 蛋白含有多个可能的磷酸化位点,暗示该蛋白的翻译后磷酸化修饰在其功能实现中起着重要作用。这些生物信息学分析结果将为深入探究IbNAC14 基因在甘薯中的功能奠定一定的理论基础。此外,基于系统进化树分析,我们推测IbNAC14 蛋白可能参与甘薯生长发育与逆境响应过程。因为以前的进化分析表明,根据NAC 基因的功能,生长发育或胁迫相关的NAC 蛋白能够聚为一个亚类[31-32]。
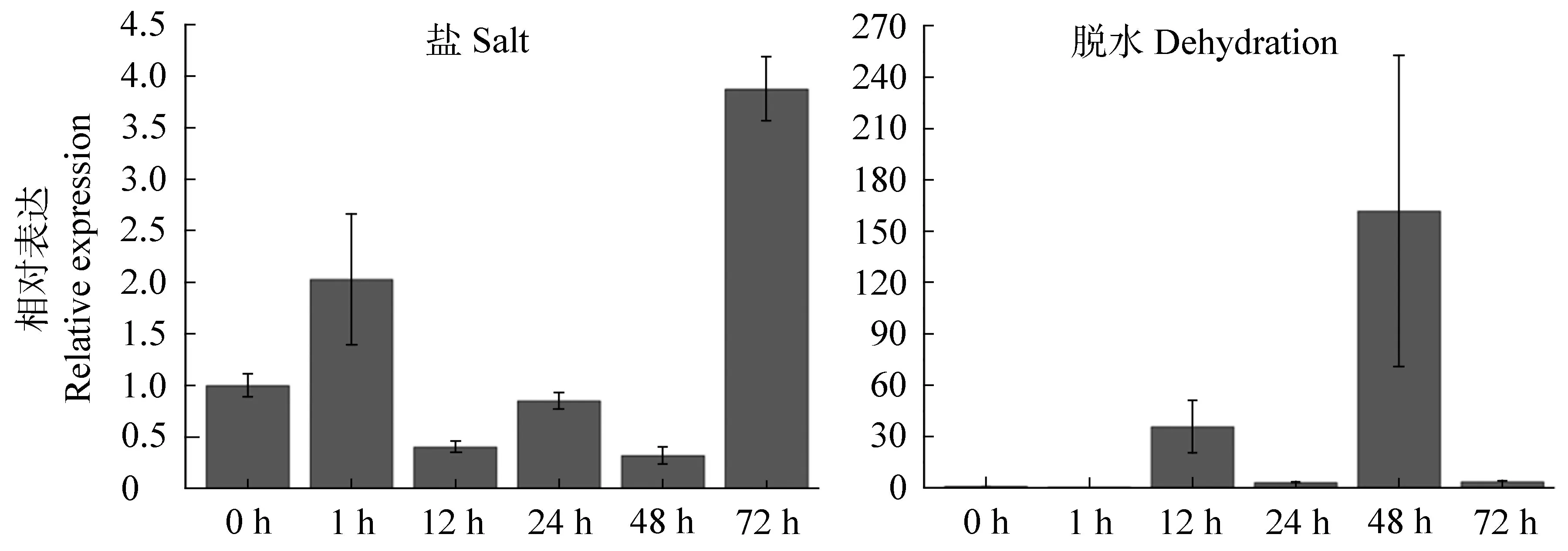
图3 甘薯IbNAC14 基因响应盐和干旱胁迫处理的表达分析Figure 3 The expression analysis of IbNAC14 under salt and drought stresses
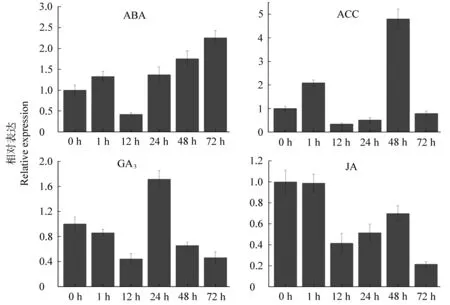
图4 甘薯IbNAC14 基因响应激素处理的表达分析Figure 4 The expression analysis of IbNAC14 under various hormone treatments
大量研究证实,许多NAC 基因在植物生长发育以及胁迫应答等方面发挥着重要作用[10],但具体的调控机制仍待进一步研究。拟南芥中NAC 基因的表达分析显示,大多数NAC 基因参与对高盐和极端温度的响应[33-34]。水稻SNAC1、OsNAC5和OsNAC6等基因的表达受干旱、高盐或ABA 的诱导[11]。我们发现高盐、高温和ABA 等处理均能上调IbNAC14基因的表达,这与拟南芥、水稻、番茄和大豆等植物中的研究结果相一致[19,32,35]。因此,我们的生物信息学和qRT-PCR 分析结果暗示IbNAC14基因可能在甘薯胁迫响应过程中扮演重要角色,但这有待进一步的功能分析和验证。
此外,NAC 蛋白既可通过依赖于ABA 的信号途径来调控逆境响应,也可通过不依赖于ABA 的信号途径[12,24]。研究表明,“胁迫激素”ABA 主要通过调控气孔关闭以及激活胁迫相关基因的表达进而在逆境响应中扮演重要角色,从而提高了植物的胁迫耐受性[5]。ABA 能够诱导IbNAC14基因的表达,暗示其可能通过依赖于ABA 的信号转导途径参与胁迫响应。之前,我们发现甘薯IbNAC1L、IbNAC5和IbNAC13基因的表达不受ABA 的诱导[4],这暗示甘薯中的NAC 转录因子也同时存在依赖于ABA 和不依赖于ABA 的信号调控途径。此外,ACC(乙烯前体)也能上调IbNAC14基因的表达,乙烯广泛也参与了植物胁迫响应[36],进一步说明IbNAC14基因可能在甘薯胁迫响应过程中发挥重要作用。
L.S.P.Tran 等[8]已指出NAC 基因是可用于提高转基因作物胁迫耐受性的重要候选基因,在今后具有很大的基因工程应用潜力。如水稻SNAC1的超表达明显提高了转基因植株的抗旱性和耐盐性,且转基因植株未出现表型变化和产量损失,因而具有很高的育种价值[37]。因此,胁迫诱导型NAC 基因的筛选和鉴定将能够为作物分子育种提供更为快捷和高效的候选基因资源。甘薯IbNAC14基因的生物信息学以及胁迫处理响应特征分析,为继续探究其在胁迫应答中的功能和调控机理奠定了基础。
