长链非编码RNA 与帕金森相关性的研究进展
2020-01-06张伊茗颜天华
张 雪,张伊茗,颜天华
中国药科大学 基础医学与临床药学学院生理教研室,南京 210009
随着全球人口老龄化发展,老年性疾病日益增多已是不可忽视的现实。帕金森(parkinson's disease,PD)作为一种常见的老年性神经退行性疾病,仅次于阿尔兹海默症,是全球第二大神经退行性疾病,同时也是最为常见的神经功能障碍引起的运动障碍的疾病[1]。其临床表现主要有:静止性震颤、肌强直、运动迟缓等,该病多见于老年人,并且随着年龄的增加患病率明显增高。目前全球60 岁以上的人群患病率为1%。我国65 岁以上人群患病率高达1.7%;50 岁以上者发病率为500/10 万,60 岁以上者发病率为1 000/10 万;男性稍多于女性[2]。PD 致病因素尚未明确,遗传因素、年龄因素、环境因素、氧化应激及线粒体功能障碍等,均可能参与PD 多巴胺能神经元变性凋亡过程;并且目前治疗手段(药物治疗为主,手术治疗为辅)仅能改善疾病症状,不能阻止病情进展,更不能治愈该病[3,4]。因此,深入探究PD 的发生机制,寻找其潜在的干预节点对控制PD 发生发展具有重要的临床意义。
长链非编码RNA(Long non-coding RNA,LncRNA)是一类长度在200~100 000 nt 范围、不编码蛋白质,具有特定二级结构,在表达上具有组织特异性和时空特异性的RNA。研究表明,LncRNA 主要通过转录水平、转录后水平和表观遗传水平参与基因表达调控,影响细胞增殖、迁移和凋亡等过程,从而在人类生理病理等过程发挥重要作用[5,6]。本文主要从LncRNA 角度出发,为PD 的预防、早期诊断和预后提供新的策略。
1 长链非编码RNA
转录组学研究结果显示,人类基因中1%~2%能够编码蛋白,其余约98%不能够编码蛋白,称为非编码RNA(non-coding RNAs,ncRNAs),包括microRNA(miRNA)、LncRNA 等,其中数量最多的是LncRNA[7]。NONCODE 等数据显示,人类LncRNA 基因数有96 308 种,其转录本有172 216 个(http://www.noncode.org/analysis.php);目前LncRNA 研究还处于初级阶段,仅鉴定其中约100 种功能[8]。与编码RNA 相比,LncRNA 长度较短,缺乏外显子和显著开放阅读框,编码蛋白能力弱[9]。随着高通量测序技术的应用与发展,大量具有丰富生物学功能LncRNA 被发现;LncRNA 可通过与DNA、RNA 和蛋白质相互作用,调控基因表达,进而发挥细胞效应。一般LncRNA 主要通过3 种水平参与基因表达调控:(1)转录水平,如调节转录因子与启动子结合、染色质重塑及组蛋白修饰等环节。(2)转录后水平,如:①LncRNA 可以作为内源性竞争物RNA(ceRNA),也称为miRNA 海绵,通过竞争性结合特定miRNA,干扰miRNA 与mRNA 相互作用,调节相关mRNA 翻译;②参与内含子的基因剪接,产生不同的mRNA;③通过miRNA 非依赖性方式,靶向mRNA 转录本,从而影响mRNA 稳定性。(3)表观遗传修饰水平,如DNA 及组蛋白甲基化、组蛋白乙酰化及泛素化等参与基因表达的调控[5,6]。见图1[10]。
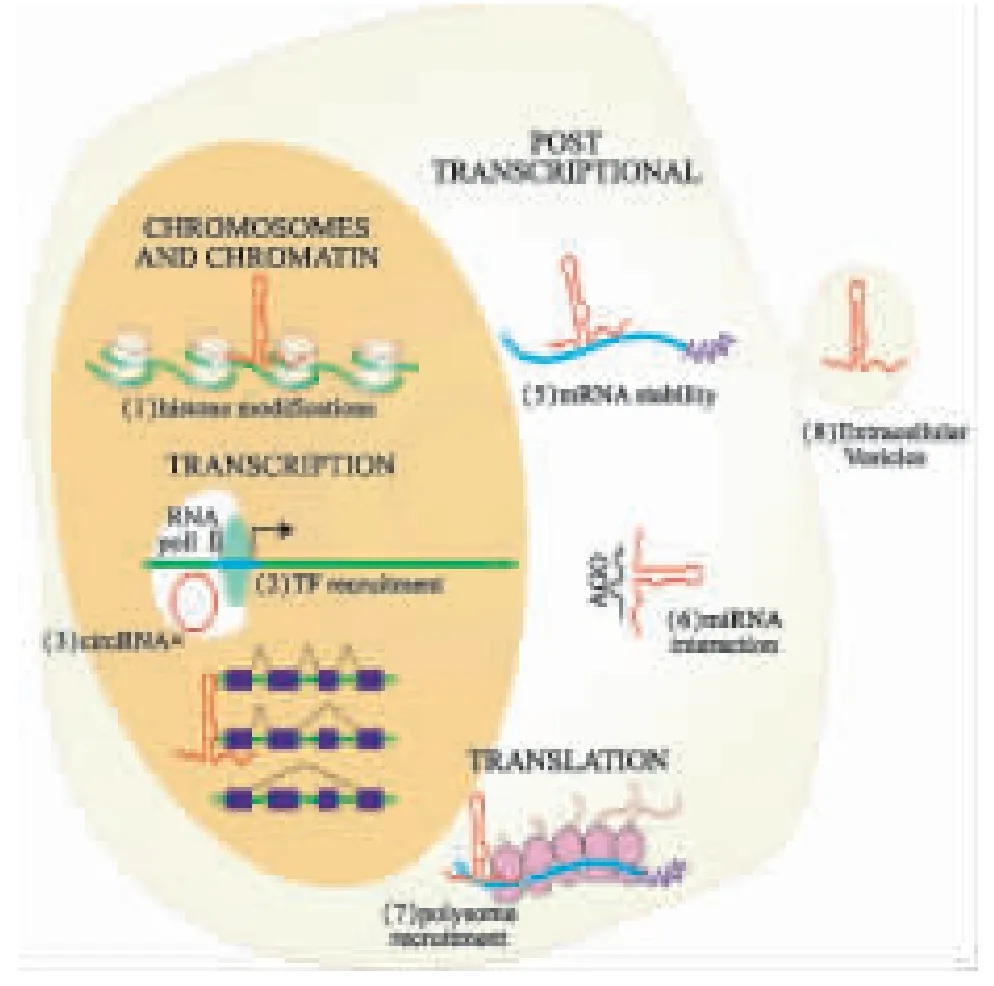
图1 LncRNA 参与基因表达调控[10]
LncRNA 调节基因表达的方式:(1)染色质和染色体通过组蛋白修饰凝聚;(2)转录因子(TF)直接募集;(3)与RNA 聚合酶(pol)Ⅱ结合;(4)可变剪接;(5)mRNA 稳定性;(6)miRNA 可获得性;(7)多核糖体募集;(8)通过包装到细胞外囊泡中调节邻近细胞中的基因表达。
2 LncRNAs 与帕金森
研究显示,LncRNAs 在哺乳动物脑内含量非常丰富;脑内LncRNAs 主要用来维持其生长发育及功能,包括神经元生长分化、突触的形成及维持、学习与认知及记忆等过程[11]。近些年研究发现,LncRNA 在PD 患者体内异常表达,提示LncRNA 可能在PD 的发生发展中起着重要的调控作用。下面结合近些年相关研究结果,对PD 相关LncRNAs 进行简要阐述。
2.1 AS Uchl1
泛素羧基末端水解酶L1(Ubiquitin carboxy-terminal hydrolase L1,Uchl1)的反义链转录本LncRNA AS Uchl1,是Uchl1/PARK5 的合成位置[12]。PD 模型鼠中LncRNA AS Uchl1表达下调,AS Uchl1 通过调控Uchl1 mRNA 促进Uchl1 蛋白表达,AS Uchl1 表达下调会诱导PD 疾病进程。Carrier C等[13]研究表明,AS Uchl1 可以在转录水平调控基因表达,其在一个与多巴胺能细胞的分化和维持有关的转录因子Nurr1调控下,从而调节Uchl1 蛋白表达,进而影响PD 进程。
2.2 AS MAPT
微管相关蛋白tau(microtubule-associated protein tau,MAPT)是胞内纺锤体主要组成部分,编码基因位于17q21.3,能促进细胞骨架微管聚合及稳定,与神经退行性疾病有关[14]。LncRNA AS MAPT 是由tau 蛋白(Microtubule-associated protein tau,MAPT)编码基因的反义转录的产物,可通过甲基化MAPT 启动子,进而下调MAPT 表达。Coupland KG 等[15]研究发现,在PD 中AS MAPT 可以通过在转录水平后调控tau 蛋白表达,AS MAPT 在PD 中表达显著降低,MAPT 启动子甲基化减少,从而使MAPT 表达增多,增多的MAPT 表达可能与PD 疾病状态有关,具体机制有待进一步研究。
2.3 LncRNA H19
H19 是目前研究较多的LncRNA 之一,位于染色体11p15.5 的H19/IGF2 的基因簇上,全长2.5 kb,含有5 个外显子及4 个内含子[16]。H19 基因编码一段没有明显开放阅读框mRNA 样的RNA 分子,但不编码蛋白。H19 一直以来是肿瘤研究中的热点,如H19 在多发性骨髓瘤患者血清中高表达,其通过抑制下游靶基因miR-29b-3p 的表达,从而解除后者对抗凋亡Bcl-2 家族中Mcl-1(Myeloid cell leukemia sequence 1,Mcl-1)转录的抑制,抑制肿瘤细胞凋亡,促进肿瘤细胞生长[17]。近些年有研究发现,其在PD 患者体内表达异常。Kraus TFJ 等[18]研究发现,PD 患者体内H19 上游保守序列1 和2(Huc 1 and 2)相较于对照组显著性降低2 倍。由此推测,H19 与PD 具有一定的相关性,根据其在肿瘤疾病中的研究,推测其在PD 中可能作为ceRNA 在转录后水平调控有关基因表达,但其中具体机制尚不明确,有待深入研究。
2.4 LincRNA-p21
基因间长链非编码RNA(Long intergenic noncoding RNA,LincRNA)-p21 是p53 依赖性通路的重要下游效应分子,位于细胞周期调节关键基因p21/Cdknla 上游约15 kb处,长3.0 kb,参与细胞凋亡和DNA 损伤应答等过程[19]。Kraus TFJ 等[18]研究发现,作为p53 和缺氧诱导因子1α(Hypoxia-inducible factor 1α,HIF-1α)转录靶LincRNA-p21 在PD 患者体内相较于正常组表达显著性上调2 倍。Ding XM等[20]研究显示,LincRNA-p21 作为ceRNA 在转录后水平调控TRPM2 表达,其通过miR-625 调控瞬时受体电位M2(transient receptor potential melastatin 2,TRPM2)通道蛋白表达,诱导细胞凋亡、氧化应激及炎症反应,至此,LincRNA-p21/miR-625/TRPM2 在PD 进程中起到重要作用。另有研究发现,在PD 发生发展过程中,活化的小胶质细胞内p53 依赖性的LincRNA-p21 表达上调,LincRNA-p21 竞争性吸附并下调miR-181,解除后者对蛋白激酶C-δ(Protein Kinase C-δ,PKC-δ)的抑制,间接上调PKC-δ 表达;同时PKC-δ 反过来促进p53 的表达,诱导LincRNA-p21 表达。至此,p53/LincRNA-p21/miR-181/PKC-δ 形成一个正反馈环路,协同促进小胶质细胞持续活化,加重PD 病理损伤[21]。
2.5 Malat1
肺癌转移相关转录本1(Metastasis associated lung adenocarcinoma transcript1,Malat1),位于染色体11q13.1,长 约6.7 kb,具有高度保守的LncRNA。最初研究发现,其在肿瘤组织中高表达,参与调节细胞生长、凋亡及迁移等[22]。研究显示Malat1 在神经元中表达丰富,并与突触的形成和维持有关。Kraus TFJ 等[18]研究发现,Malat1 在PD 患者的体内表达上调3 倍。Xia D 等[23]研究发现,Malat1 作为ceRNA 在转录后水平调控α-突触核蛋白表达,其与miR-129 存在一段互补序列;在PD 小鼠模型中,Malat1 通过与miR-129 结合,下调其表达,进而解除后者对SNCA(Synuclein-Alpha)基因表达的抑制,SNCA 参与负责α-突触核蛋白(α-synuclein,α-syn)合成;显示Malat1/miR-129/SCNA 通路在PD 发展中起重要作用。Chen Q 等[24]研究表明,Malat1 还可以通过与miR-205-5p结合,下调其表达,解除miR-205-5p 对LRRK2(Leucinerich repeat kinase,LRRK2)表达的抑制;LRRK2 进一步诱导氧化应激损伤及多巴胺能神经元凋亡,加重PD 病情的发展。
2.6 Snhg1
小核糖体管家基因RNA1(Small nucleolar RNA host gene1,Snhg1),由位于11 号染色体UHG 基因转录而来,约3.9kb[25]。Snhg1 主要参与调控细胞凋亡、转移等过程。Kraus TFJ等[18]研究发现,PD 患者体内Snhg1 表达显著性上调,表明Snhg1可能在PD 发生发展中起关键作用。研究显示,LncRNA Snhg1 作为ceRNA 在转录后水平调控有关基因表达,如其可通过直接与miR-15b-5p 结合,下调其表达,一方面促进miR-15b-5p 下游靶基因SIAH1(Seven in absentia homolog 1)表达,促使α-syn 聚集,诱导路易小体的形成,加重PD 病理损伤[26];另一方面逆转miR-15b-5p 对糖原合成酶激酶-3β(Glycogen synthase kinase-3β,GSK-3β)的抑制,促进氧自由基(Reastive oxygen species,ROS)生成,抑制自噬而加速PD的发生发展[27],表明Snhg1 在PD 发病中至关重要。Cao B 等[28]研究发现,PD 小鼠中Snhg1 与miR-7 结合,促进小胶质细胞及NLRP3 炎性小体的激活,使PD 病情发展;因此LncRNASnhg1/miR-7/NLRP3 在PD 发生中起重要作用。
2.7 HOTAIR
HOX 反义基因间RNA(HOX antisense intergenic RNA,HOTAIR),位于人类染色体12q13.13[29]。目前研究表明,HOTAIR 在多种疾病中表达上调,参与调控细胞分化及凋亡等过程[30,31]。Wang S 等[32]研究发现,在PD 小鼠模型中,HOTAIR表达上调;而HOTAIR 可在转录后水平调控基因表达,如与其通过增强LRRK2 mRNA 稳定性、促进多巴胺能神经元凋亡相关;沉默HOTAIR 抑制caspase-3 的激活,抑制神经细胞凋亡。Chen Z 等[33]研究表明,HOTAIR 作为内源性竞争物RNA(ceRNA)与miR-126-5p 相互作用,解除后者对Rab3a 相互作用蛋白(Rab3a interacting protein,RAB3IP)的抑制,从而促进多巴胺神经元丢失和细胞凋亡,加重PD 进程;敲减HOTAIR 后,PD 鼠体内TH 增多、α-syn 累积减少及多巴胺凋亡率下降,延缓PD 进程;因此HOTAIR/miR-126-5/RAB3IP在PD 发生发展中起重要作用。
2.8 Neat1
LncRNA Neat1(Nuclear paraspeckle assembly transcript1,Neat1),主要编码Neat1-1 和Neat1-2;Neat1 主要参与调控细胞凋亡、转移等过程[34,35]。Yan W 等[36]研究发现,Neat1 可在表观遗传水平调控基因表达,其可通过与磷酸酶张力蛋白诱导激酶1(PTEN induced putative kinase1,PINK1)结合,调节其泛素化水平,增加稳定性,促进MPTP 诱导的自噬,加重多巴胺能神经元损伤、诱导PD。Liu Y 等[37]研究发现,PD 小鼠Neat1 表达上调;敲减Neat1 后,Bax/Bcl-2、caspase-3 活性降低,减少α-syn 及其磷酸化水平。具体机制有待深入研究。
2.9 其他LncRNA
LncRNA PINK-AS 是PINK1 基因的反义转录产物,可通过增强其靶基因转录产物的稳定性、阻碍线粒体呼吸链功能,诱导神经细胞凋亡,加重PD 的发展[38]。已有研究表明,LncRNA AL049437 敲减可增加细胞活力、线粒体跨膜电位及酪氨酸羟化酶的分泌;LncRNA AK021630 敲减可产生相反效果,推测出LncRNA AL049437 可能促进PD 的发生发展,而LncRNA AK021630 可能参与抑制PD 的发生[39]。
3 小结与展望
随着技术发展及对LncRNA 深入研究,曾被认为是基因转录副产物或“暗物质”,不具有任何生物学功能的LncRNA,可以通过多种途径参与细胞生长、增殖、分化及稳态维持等重要生命活动的调节,与各种疾病的发生发展有着密切关系,已成为继miRNA 后又一新的研究热点。LncRNA 不仅为疾病机制的理解提供新视角,而且为疾病的诊断及治疗提供新方法;相对于编码蛋白的基因,其表达更具组织特异性和时空特异性,因此可作为疾病生物标记物和治疗靶标,在PD的预防、诊断及预后判断中有着不可忽视的应用前景。目前对LncRNA 研究还处于初步阶段,相信随着LncRNA 的深入研究,LncRNA 有望成为延缓PD 病情进展的潜在新靶点。