梓醇对高脂诱导小鼠非酒精性脂肪肝的干预作用
2020-01-03文若剑
田 香,熊 琪,陈 琳,文若剑,茹 琴
江汉大学武汉生物医学研究院,武汉 430056
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种无过量饮酒史、以肝实质细胞脂肪变性和脂质贮积为主要特征的临床病理综合征,包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化和脂肪性肝硬化4个病理过程[1- 2]。NAFLD的发病机制比较复杂,至今尚未完全阐明,目前最经典的理论是Day[3]提出的“二次打击”学说。其中“初次打击”是以胰岛素抵抗为中心而导致的肝脂肪变,包括肝脏脂肪积聚、脂代谢紊乱,使肝对外界刺激敏感性增加。“二次打击”主要是各种致病因素而引发的氧化应激使反应性氧化物和脂质过氧化物增多,导致细胞炎性因子释放增加,从而促进肝细胞发展为炎症和病变坏死。随着社会生活水平的提高和饮食结构的改变,NAFLD发病率逐年升高且呈低龄化趋势,已成为一种危害人类健康的常见慢性肝脏疾病[4- 5]。梓醇是从地黄中提取的环烯醚萜类化合物,是地黄主要有效活性成分之一,具有神经保护、抗炎、抗肝损伤等多种药理作用[6- 8],但关于梓醇对NAFLD干预作用的研究报道较少。本研究通过高脂饮食诱导小鼠NAFLD模型,探讨梓醇对NAFLD的干预作用及其可能的作用机制,为临床NAFLD的防治提供新的思路和实验依据。
材料和方法
试剂与仪器梓醇(纯度98%,成都德思特生物技术有限公司);阿托伐他汀钙(atorvastatin calcium,ATC)(湖北巨胜科技有限公司);脂肪供能比10%的低脂饲料和脂肪供能比45%的高脂饲料(货号:MD12031和MD12032)(江苏美迪森生物医药公司);丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒(货号:C009- 2)、天冬氨酸氨基转移酶(aspartate transaminase,AST)试剂盒(货号:C010- 2)、总胆固醇(total cholesterol,TC)试剂盒(货号:A111- 2)、三酰甘油(triglyceride,TG)试剂盒(货号:A110- 2)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)试剂盒(货号:A112- 1)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒(货号:A113- 1)(南京建成生物工程研究所);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(货号:JYM0218Mo)、白细胞介素(interleukin,IL)- 1β试剂盒(货号:JYM0531Mo)和IL- 6试剂盒(货号:JYM0012Mo)(武汉基因美生物科技有限公司);苏木素-伊红(hematoxylin-eosin,HE)染液(武汉谷歌生物科技有限公司);核因子κB(nuclear factor kappa-B,NF-κB)p65抗体(货号:8242P)、核因子抑制蛋白Bα(inhibitor of nuclear factor kappa-B α,IκBα)抗体(货号:4812S)、B淋巴细胞瘤- 2(B-cell lymphoma- 2,Bcl- 2)抗体(货号:3498)、Bcl- 2相关x蛋白(Bcl- 2 associated x protein,Bax)抗体(货号:2772)、半胱天冬酶- 3(Caspase- 3)抗体(货号:9662)和GAPDH抗体(货号:2118S)(美国CST公司);化学发光显色试剂(货号:34077)(美国Thermo公司);HM 340E石蜡切片机、EC 350包埋机(德国Microm 公司);CM 1860冰冻组织切片机(德国Leica公司);正置光学显微镜成像系统(BX51,日本Olympus株式会社);MULTISKAN GO全自动酶标仪、MULTIFUGF X1R低温高速离心机(美国Thermo公司);ChemiDoc Touch化学发光成像分析系统(美国Bio-Rad公司)。
实验动物6周龄SPF级C57BL/6J雄性小鼠60只,体重22~26 g,购自北京维通利华实验动物技术有限公司(合格证号为:11400700213032),饲养于江汉大学医学实验动物中心[许可编号:SYXK(鄂)2012- 0042]。实验获得江汉大学实验动物伦理委员会授权,实验前适应环境1周,自由采食和饮水。
分组及给药小鼠按各组体重无差异随机分为6组,每组10只。根据董韡等[9]对地黄中梓醇急性毒性实验研究及前期预实验结果,梓醇干预浓度设为低、中、高3个剂量,分别为100、200和400 mg/kg,分组与处理如下:(1)正常对照组:喂食低脂纯化配方饲料,灌胃给予等体积生理盐水;(2)模型组:喂食高脂纯化配方饲料,灌胃给予等体积生理盐水;(3)梓醇低剂量组:喂食高脂纯化配方饲料,灌胃给予梓醇100 mg/kg;(4)梓醇中剂量组:喂食高脂纯化配方饲料,灌胃给予梓醇200 mg/kg;(5)梓醇高剂量组:喂食高脂纯化配方饲料,灌胃给予梓醇400 mg/kg;(6)ATC组:喂食高脂纯化配方饲料,灌胃给予ATC 30 mg/kg。各组动物均自由采食和饮水,连续喂养18周。
小鼠体重及肝指数在实验周期内,每周对小鼠称重并记录,观察整体情况及变化趋势。实验结束后,称量小鼠体重及肝重,以肝脏湿重/小鼠体重×100%计算肝指数。
小鼠血清学指标检测干预18周后,禁食不禁水12 h,用1%戊巴比妥钠腹腔注射麻醉动物,摘眼球取血,静置2 h后4℃ 3000 r/min(转子半径8 cm)离心10 min,吸取上清液,按照试剂盒说明书分别检测小鼠血清TC、TG、HDL-C、LDL-C以及ALT和AST的含量。
小鼠肝脏病理组织学观察肝脏标本经10%福尔马林固定,油红O染色观察肝组织脂肪蓄积情况,HE染色观察肝组织脂肪变性及损伤程度并拍照。
小鼠血清炎症因子测定按照试剂盒说明书,采用ELISA法检测小鼠血清中TNF-α、IL- 1β和IL- 6的含量。
Western blot检测肝组织蛋白表达水平取适量放射免疫沉淀实验细胞裂解液匀浆肝组织并测定蛋白浓度上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白并转至聚偏二氟乙烯膜上,5%脱脂牛奶封闭1 h,与一定比例稀释后的一抗在4℃环境中孵育过夜(NF-κB p65抗体、IκBα抗体、Bcl- 2抗体、Caspase- 3抗体和GAPDH抗体按1∶1000稀释,Bax抗体按1∶500稀释),用三羟甲基氨基甲烷盐酸盐缓冲液洗膜后置于辣根过氧化酶标记的二抗中室温孵育1 h,洗涤后进行化学发光显色试剂显色,化学发光成像分析系统曝光成像。以GAPDH为内参,数据以正常对照组为参照进行归一化处理。
统计学处理所有数据采用SPSS 16.0软件进行统计分析,各组数据使用均数±标准差表示;采用单因素方差分析(One-way ANOVA)对数据进行统计学处理,P<0.05为差异有统计学意义。
结 果
梓醇对高脂饮食小鼠体重及肝指数的影响实验周期内各组小鼠摄食量基本保持一致,并于每6周记录各组小鼠体重情况(表1)。实验开始时,各组小鼠体重基本一致,差异无统计学意义(P>0.05)。饲养18周后,模型组小鼠体重显著高于正常对照组(P=0.001),梓醇各剂量组和ATC组小鼠体重及体重增重均显著低于模型组(P均=0.001)。与正常对照组相比,模型组小鼠肝脏指数显著升高(P=0.001),梓醇中、高剂量组(P均=0.001)和ATC组(P=0.001)小鼠肝脏指数比模型组显著降低(表2)。
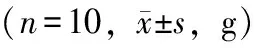
表1 各组小鼠0、6、12、18周体重情况Table 1 The body weight of mice in 0,6,12 and 18 weeks in each
ATC:阿托伐他汀钙;P1:模型组与正常对照组比较;P2:梓醇低剂量组与模型组比较;P3:梓醇中剂量组与模型组比较;P4:梓醇高剂量组与模型组比较;P5:ATC组与模型组比较
ATC:atorvastatin calcium;P1:model group was compared with control group;P2:catalpol low dose group was compared with model group;P3:catalpol middle dose group was compared with model group;P4:catalpol high dose group was compared with model group;P5:ATC group was compared with model group

表2 梓醇对小鼠体重和肝指数的影响Table 2 Effect of catalpol on body weights and liver index of
P1:模型组与正常对照组比较;P2:梓醇低剂量组与模型组比较;P3:梓醇中剂量组与模型组比较;P4:梓醇高剂量组与模型组比较;P5:ATC组与模型组比较
P1:model group was compared with control group;P2:catalpol low dose group was compared with model group;P3:catalpol middle dose group was compared with model group;P4:catalpol high dose group was compared with model group;P5:ATC group was compared with model group
梓醇对高脂饮食小鼠血脂和肝功能的影响与正常对照组相比,模型组小鼠血清TC(P=0.001)、TG(P=0.001)、LDL-C(P=0.001)水平显著升高,HDL-C(P=0.001)水平显著降低。与模型组相比,梓醇低剂量组小鼠血清TC、TG和LDL-C含量及梓醇低、中剂量组小鼠血清HDL-C含量差异无统计学意义(P>0.05),梓醇中、高剂量组小鼠血清TC(P=0.005,P=0.001)、TG(P均=0.001)和LDL-C(P均=0.001)含量显著降低,梓醇高剂量组HDL-C含量显著增加(P=0.009)。另外,模型组小鼠血清ALT和AST水平与正常对照组相比显著升高(P均=0.001)。与模型组相比,梓醇3个剂量组和ATC组小鼠血清ALT(P=0.004,P=0.001,P=0.001,P=0.001)和AST(P=0.008,P=0.001,P=0.001,P=0.001)水平均显著降低(表3)。
梓醇对高脂饮食小鼠肝组织病理形态学的影响HE染色结果显示正常对照组小鼠肝小叶结构完整,肝细胞结构清晰,细胞核位于细胞中央,清晰可见,少见脂肪变性。模型组小鼠可见肝小叶界限不清,肝细胞内出现大小不等的气球样脂肪空泡,呈现明显的脂肪变性,炎性细胞弥散分布在脂肪样变肝组织中。与模型组相比,梓醇各剂量组和ATC组小鼠肝脏脂肪变性减轻,胞浆内脂肪空泡数量减少,体积变小,病变程度有所缓解(图1A)。油红O染色结果显示正常对照组小鼠肝细胞胞浆中有少量红色物质,模型组小鼠肝细胞内沉积大量脂肪被染成红色,梓醇各剂量组和ATC组小鼠肝细胞内沉积脂肪与模型组相比有所减少(图1B)。
梓醇对高脂饮食小鼠血清炎症因子的影响模型组小鼠血清炎症因子TNF-α、IL- 1β和IL- 6与正常对照组相比显著升高(P均=0.001);梓醇各剂量组和ATC组小鼠血清炎症因子TNF-α、IL- 1β和IL- 6浓度较模型组显著降低(P均=0.001)(表4)。
梓醇对高脂饮食小鼠肝组织中NF-κB p65和IκBα蛋白表达水平的影响与正常对照组相比,模型组小鼠肝组织中NF-κB p65蛋白表达水平显著上升(P=0.007),IκBα蛋白表达水平显著下降(P=0.002)。与模型组相比,梓醇各剂量组及ATC组肝组织中NF-κB p65蛋白表达水平显著下调(P=0.014,P=0.001,P=0.001,P=0.001),IκBα的蛋白表达水平显著上调(P=0.028,P=0.001,P=0.001,P=0.001)(图2)。

表3 梓醇对小鼠血清TC、 TG 、LDL-C、HDL-C以及ALT和AST水平的影响Table 3 Effects of catalpol on serum TC,TG,LDL-C,HDL-C,ALT and AST levels in
TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;P1:模型组与正常对照组比较;P2:梓醇低剂量组与模型组比较;P3:梓醇中剂量组与模型组比较;P4:梓醇高剂量组与模型组比较;P5:ATC组与模型组比较
TC:total cholesterol;TG:triglyceride;LDL-C:low-density lipoprotein cholesterol;HDL-C:high-density lipoprotein cholesterol;ALT:alanine aminotransferase;AST:aspartate transaminase;P1:model group was compared with control group;P2:catalpol low dose group was compared with model group;P3:catalpol middle dose group was compared with model group;P4:catalpol high dose group was compared with model group;P5:ATC group was compared with model group

1.正常对照组;2.模型组;3.梓醇低剂量组;4.梓醇中剂量组;5.梓醇高剂量组;6.ATC组;箭头:炎性细胞
1.control group;2.model group;3.catalpol low dose group;4.catalpol middle dose group;5.catalpol high dose group;6.ATC group;arrows show inflammatory cells
图1小鼠各组肝组织HE染色(A)和油红O(B)染色结果(×400)
Fig1Hematoxylin-eosin staining(A)and oil red O staining(B)of the liver tissues in each group of mice(×400)

表4 梓醇对小鼠血清TNF-α、IL- 1β和IL- 6水平的影响Table 4 Effects of catalpol on serum TNF-α、IL- 1β and IL- 6 levels in
TNF-α:肿瘤坏死因子-α;IL:白细胞介素;P1:模型组与正常对照组比较;P2:梓醇低剂量组与模型组比较;P3:梓醇中剂量组与模型组比较;P4:梓醇高剂量组与模型组比较;P5:ATC组与模型组比较
TNF-α:tumor necrosis factor-α;IL:interleukin;P1:model group was compared with control group;P2:catalpol low dose group was compared with model group;P3:catalpol middle dose group was compared with model group;P4:catalpol high dose group was compared with model group;P5:ATC group was compared with model group

NF-κB:核因子κB;IκBα:核因子抑制蛋白Bα;Mr:相对分子质量;CG:正常对照组;MG:模型组;CLG:梓醇低剂量组;CMG:梓醇中剂量组;CHG:梓醇高剂量组;AG:ATC组;与CG组比较,aP< 0.01;与MG组比较,bP< 0.05,cP< 0.01
NF-κB:nuclear factor kappa-B;IκBα:inhibitor of nuclear factor kappa-B α;Mr:relative molecular mass;CG:control group;MG:model group;CLG:catalpol low dose group;CMG:catalpol middle dose group;CHG:catalpol high dose group;AG:ATC group;aP<0.01 compared with CG group;bP< 0.05,cP< 0.01 compared with MG group
A.小鼠肝组织中NF-κB p65和IκBα蛋白表达;B.NF-κB p65蛋白定量分析;C.IκBα定量分析
A.protein expression of NF-κB p65 and IκBα in the livers of mice;B.quantitative analysis of NF-κB p65 protein;C.quantitative analysis of IκBα protein
图2梓醇对高脂饮食小鼠肝组织中NF-κB p65和IκBα蛋白表达水平的影响
Fig2Effects of catalpol on the expression of NF-κB p65 and IκBα in the livers of high fat diet-fed mice
梓醇对高脂饮食小鼠肝脏组织中Bcl- 2/Bax和Caspase- 3蛋白表达水平的影响与正常对照组相比,模型组小鼠肝组织中Bcl- 2蛋白表达水平显著降低(P=0.009),Bax蛋白表达水平显著升高(P=0.001),二者比值(Bcl- 2/Bax)显著降低(P=0.001),凋亡蛋白Caspase- 3表达水平也显著升高(P=0.001)。与模型组相比,梓醇高剂量组及ATC组Bcl- 2蛋白表达水平显著升高(P=0.032,P=0.014),Bax蛋白表达水平显著降低(P=0.026,P=0.001),二者比值(Bcl- 2/Bax)显著升高(P=0.003),凋亡蛋白Caspase- 3表达水平随之显著降低(P均=0.001)(图3)。

Bcl- 2:B淋巴细胞瘤- 2;Bax:B淋巴细胞瘤- 2相关x蛋白;与CG组比较,aP<0.01;与MG组比较,bP< 0.01
Bcl- 2:B-cell lymphoma- 2;Bax:Bcl- 2 associated x protein;aP< 0.01 compared with CG group;bP< 0.01 compared with MG group
A.小鼠肝组织中Bcl- 2、Bax和半胱天冬酶- 3蛋白表达;B.Bcl- 2/Bax比值;C.半胱天冬酶- 3蛋白定量分析
A.protein expression of Bcl- 2,Bax and Caspase- 3 in the livers of mice;B.Bcl- 2/Bax ratio;C.quantitative analysis of Caspase- 3 protein
图3梓醇对高脂饮食小鼠肝组织中Bcl- 2/Bax和半胱天冬酶- 3蛋白表达水平的影响
Fig3Effects of catalpol on the expressions of Bcl- 2/Bax and Caspase- 3 in the livers of high fat diet-fed mice
讨 论
脂肪肝的产生是由于肝细胞质变和脂肪蓄积过多导致的,脂质代谢异常、细胞炎症反应和细胞凋亡等因素在NAFLD的发展中发挥至关重要的作用[10]。高脂饲料饲养的动物模型是目前最常用的NAFLD动物模型,它模拟了人类NAFLD的发生发展和病变特征,过程中可出现全身代谢紊乱特征,模型肝组织渐进性发展的病变过程符合人类肝病慢性发展的特点[11]。国内已有研究表明梓醇具有改善糖脂代谢的作用[12- 13],但对高脂饮食诱导的NAFLD的干预作用尚未见报道。本研究旨在探讨梓醇对高脂饮食诱导的小鼠NAFLD的预防作用,并初步分析其可能的作用机制。实验研究显示,高脂饮食诱导的NAFLD小鼠经梓醇干预后,体重及肝指数显著降低,血清TC、TG、LDL-C水平显著降低、HDL-C水平显著升高,病理组织切片结果显示肝细胞脂质蓄积及气球样脂肪病变程度降低;血清炎症因子TNF-α、IL- 1β和IL- 6释放减少,血清ALT及AST水平也显著降低。以上结果表明梓醇可预防高脂饮食诱导的NAFLD小鼠肝脏脂质蓄积、肝脏损伤及炎症反应。
已有研究显示1 g/kg梓醇干预后糖尿病db/db小鼠血清中TG水平显著降低,HDL水平显著升高,可能是由于梓醇使db/db小鼠肝组织中乙酰辅酶A羧化酶与羟甲基戊二酸单酰辅酶A还原酶蛋白表达下降,AMP依赖的蛋白激酶α(AMP-activated protein kinase α,AMPKα)磷酸化水平表达增加,从而改善鼠肝脏胰岛素抵抗,调节脂质代谢紊乱[14]。位于内质网上的固醇调节元件结合蛋白- 1c(sterol regulatory element binding protein- 1c,SREBP- 1c)是脂代谢的重要核转录因子,能调节肝内TG的合成和贮存,是肝脏脂质代谢的关键调控者,在NAFLD的发生、发展过程中发挥重要作用[15]。相关研究显示内质网应激通过调节SREBP- 1c表达与激活对肝细胞脂质沉积发挥重要的调节作用[16- 17]。本研究梓醇显著降低了高脂饮食小鼠血清中TC、TG、LDL-C水平,提高了HDL-C水平,并且降低了肝脏脂质蓄积,对NAFLD发病起到了预防作用,提示梓醇可能通过调控AMPKα磷酸化、影响内质网应激及下调SREBP- 1c基因的表达预防高脂饮食诱导的小鼠NAFLD,具体的作用机制仍需进一步研究。
NF-κB作为多种炎症介质产生的上游信号分子,在NAFLD发病过程中起到了重要的作用[18]。NF-κB信号通路的激活是关键调控环节,它通过促进多种炎症因子如TNF-α、IL- 1β、IL- 6的转录和表达增加炎性介质的释放,而这些炎性介质反过来作用于NF-κB的活化,继而进一步激活NF-κB的信号通路,导致炎症反应进一步放大[19- 20]。IκB抑制蛋白家族是NF-κB重要的内源性抑制因子,是调控NF-κB活性的主要因素之一[21]。长期的高脂饮食可通过上述途径诱发炎症反应,导致肝内的炎症因子水平升高,最终引起NAFLD[22]。陈芝芸等[23]研究显示在高脂饮食模型组大鼠肝组织中NF-κB p65表达高于正常对照组大鼠,推测NF-κB可能参与高脂饮食诱导的NAFLD损伤过程。刘庆生等[24]研究显示理气化痰祛瘀中药通过调控NF-κB的表达实现治疗脂肪肝的目的。本研究显示梓醇干预的小鼠肝组织中NF-κB p65的蛋白表达显著降低,IκBα的蛋白表达显著升高,且小鼠血清炎性因子TNF-α、IL- 1β和IL- 6释放显著降低。由此可推测梓醇对NAFLD预防作用可能通过抑制NF-κB的激活减少炎性因子的释放,从而减轻高脂饮食诱导的NAFLD小鼠肝组织炎症损伤实现。
近年来,越来越多证据表明在NAFLD中肝细胞凋亡可能是单纯非酒精性脂肪肝发展为非酒精性脂肪性肝炎的关键步骤,也是该过程的重要标志,与炎症程度和纤维化进展相关,肝细胞脂肪病变越严重,肝细胞凋亡越多[25]。NAFLD发生发展过程中,肝细胞凋亡的机制涉及一系列基因的表达和多种信号传导途径,Bcl- 2通路可能在NAFLD早期参与对肝细胞凋亡的调控作用,并贯穿于整个病变过程[26- 27]。Bcl- 2和Bax是细胞凋亡的两个重要调控基因表达产物,Bcl- 2高表达可抑制细胞凋亡的发生,Bax则发挥拮抗作用,二者比值(Bcl- 2/Bax)是启动细胞凋亡的“分子开关”[28]。已有研究显示白藜芦醇通过调节NAFLD大鼠肝细胞中Bcl- 2和Bax蛋白表达,增加二者比值,从而降低肝细胞的凋亡,保护肝组织,维持肝细胞的正常功能,改善或减缓NAFLD发展的进程[29]。Caspase- 3作为Caspase家族最重要的凋亡执行者之一,在细胞凋亡的过程中发挥重要的作用[30]。此外,在细胞凋亡过程中,线粒体通透转换孔(mitochondrial permeability transition pore,MPTP)的异常开放可导致线粒体电子传递链和氧化磷酸化解耦联、ATP衰竭、线粒体肿胀及内膜嵴消失,从而促使细胞色素C和相关凋亡诱导因子释放到胞浆,活化凋亡蛋白家族的主要成员胱冬肽酶,触发瀑布式级联反应,引起细胞凋亡[31]。吴方等[32]研究结果表明线粒体-细胞色素C途径在NAFLD引起的肝细胞凋亡中起到了一定的调控作用。与之研究结果相似,本研究显示梓醇干预组NAFLD小鼠肝组织中Bcl- 2蛋白表达增加,Bax蛋白表达降低,二者比值(Bcl- 2/Bax)增加,另外,Caspase- 3蛋白表达水平降低,推测梓醇可能通过调节MPTP开放降低线粒体损伤和细胞色素C的释放,从而起到预防肝细胞凋亡的作用。
肝脏脂质蓄积、炎性细胞产生炎性反应及肝细胞凋亡必会加重肝细胞损伤。ALT和AST是肝功能损害的生物标志物,当肝功能受损时,血液中ALT和AST水平升高[33]。本研究显示与模型组相比,梓醇干预后高脂饮食组小鼠血清中ALT和AST水平显著降低,提示梓醇可能通过减少肝脏脂质蓄积、炎症反应和抑制肝细胞凋亡降低高脂饮食对小鼠肝脏的损伤。
综上,本研究显示梓醇可有效调节高脂饮食诱导的NAFLD小鼠体重及肝指数的增加、脂代谢紊乱、肝脏脂肪变性及脂质蓄积,并能抑制炎性反应和肝细胞凋亡,对NAFLD的发病起到预防作用。本研究为梓醇应用开发提供了实验依据,具体作用机制有待进一步研究。
