最小表观扩散系数、表观扩散系数差及动态增强磁共振成像对乳腺导管微小浸润癌的诊断价值
2020-01-03郭宏兵王成瑶崔书君
吴 朋,崔 蕾,郭宏兵,王成瑶,崔书君
河北北方学院附属第一医院 1医学影像部 2乳腺外科,河北张家口 075000
乳腺导管原位癌伴微浸润(breast ductal carcinoma in situ with microinvasion,DCIS-Mi)是指乳腺癌细胞突破基底膜进入邻近组织或间质,并侵犯的最大直径不超过1 mm[1]。DCIS-Mi是具有逐步转移潜能的肿瘤,若不能早期诊断与治疗,最终发展为浸润性导管癌[2]。钼靶发现细小钙化而被怀疑DCIS-Mi需定位活检。目前功能磁共振及动态增强磁共振成像(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)广泛应用于乳腺癌检查,已成为乳腺癌患者重要确诊依据。临床上乳腺导管原位癌(breast ductal carcinoma in situ,DCIS)和DCIS-Mi的治疗方法截然不同,主要治疗不同点在于是否对前哨(腋窝)淋巴结进行清扫[3]。目前磁共振成像(magnetic resonance imaging,MRI)对DCIS-Mi研究报道较少,因此,如何早期诊断DCIS-Mi是临床医生研究难点和热点。本研究通过最小表观扩散系数(minimal apparent diffusion coefficient,ADCMin)、表观扩散系数差(difference between ratios of apparent diffusion coefficients,ADCDR)及分析DCE-MRI特征提高DCIS-Mi诊断和鉴别诊断,为临床治疗提供依据。
对象和方法
对象收集本院2016年10月至2018年6月行乳腺MRI检查的患者,检查前签署知情同意书。入选标准:(1)术前乳腺MRI检查诊断为可疑恶性[乳腺影像报告与数据系统(breast imaging reporting and data system,BI-RADS)≥4类];(2)MRI检查包括常规序列、扩散加权成像(diffusion-weighted imaging,DWI)及DCE-MRI;(3)MRI检查前未进行任何临床治疗,后经病理诊断为DCIS-Mi或DCIS。排除标准:(1)无病理诊断结果;(2)妊娠期或哺乳期的患者;(3)图像质量不佳,无法进行分析。最终27 例DCIS-Mi、27 个病灶和31 例DCIS、31 个病灶符合上述条件,所有患者均为女性,其中DCIS-Mi平均年龄(51.7±6.4)岁,DCIS平均年龄(50.9±7.3)岁。
方法应用Philips Ingenia 3.0T超导磁共振扫描仪和乳腺专用相控阵线圈。MRI检查前消除患者紧张情绪,训练患者平静呼吸,减少运动伪影,月经后1~2周检查。患者检查体位取俯卧位,双乳松弛并自然下垂于线圈洞内,紧贴线圈,双手取自然位。先常规MRI、DWI扫描,后DCE-MRI扫描。序列包括:(1)波谱衰减翻转恢复横轴面T2加权像(T2 weighted image,T2WI):回波时间(echo time,TE)90 ms,重复时间(repetition time,TR)3500 ms;层厚4 mm,层数36 层,层间距 0 mm;矩阵:480×480,有效视野(field of view,FOV):250 mm×340 mm,激励次数(number of excitation,NEX):2。(2)快速自旋回波横轴面 T1加权像(T1 weighted image,T1WI):TE 8 ms,TR 400 ms;层厚4 mm,层数36 层,层间距0 mm;矩阵:480×480,FOV:280 mm×340 mm,NEX:2。(3)自旋-平面回波横轴面DWI:TE 96 ms,TR 8000 ms;层厚4 mm,间隔0 mm;矩阵:128×101,FOV:340 mm×340 mm,采集时间132 s,扩散因子为0和800 s/mm2。(4)动态T1WI高分辨各向同性容积激发横轴面DCE-MRI:TR 4.5 ms,TE 2.2 ms;层厚1 mm,层间隔0 mm;矩阵:480×480,FOV:280 mm×340 mm,NEX:1,层数150。增强对比剂采用钆双胺0.5 mmol/ml(GE Healthcare Ireland公司生产;剂型:20 ml∶5.74 g;20 ml),注射流率2 ml/s,高压注射器开始注药后立即进行扫描,增强扫描前先扫描蒙片,连续扫描至少8~10 期,每期150 幅,每期时间61 s。
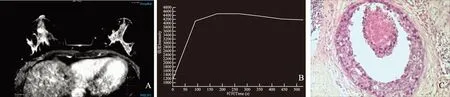
图像后处理及分析乳腺MRI图像信息均传至EWS 2.6.3.5工作站(2013版)进行分析。放射医师依据BI-RADS[4]进行评价。由2名放射主治医师在不知病理和临床结果下进行图像分析。对于医师分析DCE-MRI图像特点有意见分歧,由1名主任医师对DCE-MRI图像做出最终判定。两位主治医师测量最大表观扩散系数(maximum apparent diffusion coefficient,ADCMax)、 ADCMin、ADCDR、早期强化率(early enhanced rate,EER)一致性较好者,采用第一名医师数据,对于不一致,由主任医师进行测量判定。首先将扩散加权成像图像应用扩散校正软件包进行校正后生成校正DWI,使用生成序列功能自动生成ADC图,在ADC图上测量ADC值。感兴趣区(region of interest,ROI)大小为13~45 mm2,然后从多个ROI中选出ADCMin和ADCMax;同时计算ADCDR,ADCDR=ADCMax-ADCMin。ROI选取要避开肿瘤内囊变/坏死或出血等而选择肿块实质部分,减少测量误差,面积根据病变组织的大小而定,ROI小于病灶,以期ROI内病变组织具有较好的代表性(图1A、1B)。[注意事项:(1)从多个层面设置ROI并寻找ADCMin和ADCMax,以病灶ADCMin处做标本取材,与病理对照分析,具体步骤如下;患者俯卧于MRI乳腺线圈专用定位活检穿刺架上,根据MRI检查发现病灶的部位压迫定位,首先在DWI图上寻找病变,需结合DCE-MRI,病变位置上绘制ROI,并在ADC图测量ADC值,找出ADCMin和ADCMax。将ADCMin和ADCMax的ROI复制到DCE-MRI图像上,进一步确定ADC上ROI和DCE-MRI上ROI在同一病变位置上。在三维DCE-MRI(横轴位、冠状位、矢状位)确定靶定病灶所在位置,同时将栅格板上固定好的标记以及病灶中心的位置输入到磁共振乳腺穿刺定位软件中,经由软件自动计算穿刺点和穿刺深度(尽量避开所选最小ADC值病变以外的病变组织)。沿着预穿刺通道进针取样用以病理检查,然后再次扫描显示原病灶有空缺则提示取样成功。对于穿刺成功的病灶样本,用墨水蓝染,然后病理医师对蓝染标本单独取材,待病理明确诊断(图1C~1F);(2)对于小病灶ADC测量,先在DCE图像上寻找病灶增强最清晰一期,同时结合DWI高信号区域,勾画病变ROI图上(使DWI和DCE图上ROI吻合),然后通过自动空间配准定位,将ROI复制到DWI图和ADC图上,进行ADC值测量(扫描时候确保位置和分别率一致);(3)对于非肿块样强化ADC值测量必须结合DCE早期图像(90 s)具体分析,尽量选择增强早期的实性强化区(消除正常背景腺体组织干扰),增强早期出现强化的病变均需要进行ADC值测量,并且与病灶的DWI信号分布特点自动空间匹配,将ROI复制到DWI图和ADC图上进行ADC值测量(扫描时候确保位置和分别率一致)]。DCE-MRI图像上评价DCIS-Mi和DCIS包括:背景实质强化、肿块样强化特点(形态:圆形、卵圆形及不规则形;边缘:清晰、不清晰;内部强化特点:均匀、不均匀、环形强化)、非肿块样强化特点(分布:局灶、段样、区域;内部强化特点:均匀、不均匀、集簇状、成簇环样),同时计算早期强化率,EER=(SIpost-SIpre)/SIpre×100%,式中SIpost代表增强后第1期(注药后第120 s),SIpre代表增强前信号强度;测定时间-强度曲线(time-intensity curve,TIC),I型为流入型、Ⅱ型为平台型、Ⅲ型为流出型。ROI 大小为10~45 mm2,ROI大小尽可能覆盖病变大小,应避开脂肪和腺体干扰,减少平均容积效应。


DCIS-Mi:乳腺导管原位癌伴微浸润;ADCMin:最小表观扩散系数;ADCMax:最大表观扩散系数;DCE-MRI:动态增强磁共振成像;ROI:感兴趣区;圆圈代表ROI
DCIS-Mi:breast ductal carcinoma in situ with microinvasion;ADCMin:minimal apparent diffusion coefficient;ADCMax:maximum apparent diffusion coefficient;DCE-MRI:dynamic contrast-enhanced magnetic resonance imaging;ROI:region of interest;circle represents ROI
A、B.从多个层面设置 ROI并寻找ADCMin(A)和ADCMax(B);C~E.ADCMin参照三维DCE-MRI从横断位(C)、冠状位(D)及矢状位(E)进行空间定位;F.对应病理学取材
A,B.ROI was set from multiple levels and ADCMin(A)and ADCMax(B)were searched;C-E.the spatial localization of ADCMinwas performed in transverse(C),coronal(D),and sagittal(E)positions with reference to 3D DCE-MRI;F.corresponding pathological sampling
图1女,57岁,DCIS-Mi患者,寻找ADCMin和ADCMax,ADCMin参照DCE-MRI进行对应病理取材
Fig1A 57-year-old female with DCIS-Mi,the region of interest of ADCMinand ADCMaxwere searched,and pathological samples were obtained from ADCMinwith reference to DCE-MRI
结 果
一般资料DCIS-Mi患者病灶最大径为(3.2±1.8)cm,DCIS患者病灶最大径为(2.9±2.1)cm,差异无统计学意义(t=17.125,P=0.094)。DCIS-Mi患者最小为8 mm,4例<1 cm、6例1~2 cm、12例2~3 cm、5例>3 cm;DCIS患者最小为6 mm,5例<1 cm、8例1~2 cm、11例2~3 cm、7例>3 cm。2名医师测量DCIS-Mi和DCIS的ADCMin、ADCMax、ADCDR及EER结果一致性均非常好(表1)。
ADCMin、ADCMax、ADCDR、早期强化率两组ADCMax比较差异无统计学意义(P=0.753),DCIS-Mi的ADCMin明显低于DCIS(P=0.002),ADCDR值高于DCIS(P<0.001),DCIS-Mi早期强化率高于DCIS(P=0.007)(表2)。
DCE-MRI特点DCIS主要表现背景实质强化轻度强化、表现为肿块样强化或非肿块样强化,呈均匀或不均匀强化特点;肿块样强化,表现边缘清晰,内部强化特点表现为均匀强化,TIC呈Ⅰ/Ⅱ型(图2);DCIS-Mi表现背景实质强化为中度、重度强化、非肿块样强化,以节段为主,内部强化特点为不均匀,TIC呈Ⅱ/Ⅲ型(图3)或簇环状强化表现(图4),肿块样边缘不清晰,呈环形(图5)(表3)。

表1 2名医师测量两组患者ADCMin、ADCMax、ADCDR及EER的ICC结果Table 1 ICC results of ADCMin,ADCMax,ADCDR and EER were measured by two physicians in two groups
ADCDR:表观扩散系数差;EER:早期强化率;ICC:组内相关系数;DCIS:乳腺导管原位癌
ADCDR:difference between ratios of apparent diffusion coefficients;EER:early enhanced rate;ICC:interclass correlation coefficient;DCIS:breast ductal carcinoma in situ

表2 DCIS-Mi和DCIS的ADCMin、ADCMax、ADCDR及EER比较Table 2 Comparison of ADCMin,ADCMax,ADCDR,and EER between DCIS-Mi and DCIS groups
EER=(SIpost-SIpre)/SIpre×100%,式中SIpost代表增强后第1期(注药后120 s),SIpre代表增强前信号强度
EER=(SIpost-SIpre)/SIpre×100%,in the formula,SIpost represents the first phase after enhancement(120 s after contrast injection),and SIpre represents the signal strength before enhancement
TIC:时间-强度曲线
TIC:time-intensity curve
A.左乳腺外象限肿瘤,边界清晰,均匀强化,形态规则;B.TIC呈Ⅱ型;C.卵圆形癌巢,未见间质浸润,诊断为DCIS(HE染色,×400)
A.tumor in the outer quadrant of the left breast with clear boundary,uniform enhancement,and regular morphology;B.TIC is Ⅱ;C.oval nests with no interstitial infiltration and is diagnosed as DCIS(HE staining,×400)
图2女,48岁,DCIS患者
Fig2A 48-year-old female with DCIS

A.右乳腺可见非肿块强化肿瘤,呈节段性分布,内部强化不均匀,背景实质呈中度强化;B.TIC呈Ⅲ型;C.圆形癌巢,周围间质浸润,诊断为DCIS-Mi(HE染色,×400)
A.non-tumor enhanced tumor can be seen in the right breast with segmental distribution,uneven internal enhancement,and moderate background parenchyma enhancement;B.TIC is Ⅲ;C.circular nest with surrounding interstitial infiltration,the diagnosis is DCIS-Mi(HE staining,×400)
图3女,53岁,DCIS-Mi患者
Fig3Female,53 years old,with DCIS-Mi

A.左乳腺外象限显示肿瘤为簇环状强化;B.周围间质浸润,诊断为DCIS-Mi(HE染色,×400)
A.the tumor is clustered annular enhancement in the outer quadrant of the left breast;B.surrounding interstitial infiltration,diagnosed as DCIS-Mi(HE staining,×400)
图4女,60岁,为DCIS-Mi
Fig4A 60-year-old female with DCIS-Mi

图5女,59岁,DCIS-Mi患者,左乳可见环形强化伪彩影
Fig5A 59-year-old female with DCIS-Mi,ring enhanced pseudo-color shadow is visible in the left breast
多因素Logistic回归确定最佳变量及最佳变量对DCIS-Mi诊断效能单因素分析显示,背景实质强化、非肿块分布、非肿块内部特点、肿块边缘、肿瘤内部强化特点、TIC、早期强化率、ADCMin及ADCDR为诊断DCIS-Mi有统计学意义变量作为自变量,后继续保留纳入多因素Logistic回归分析。以病理结果作为因变量(y=0,1),赋值为:背景实质强化(0=轻度,1=中度,2=中度)、非肿块内部强化特点(0=局灶,1=节段或区域)、非肿块内部特点(0=均匀,1=不均匀或簇状)、肿块边缘(0=清晰,1=不清晰)、肿瘤内部强化特点(0=均匀,1=不均匀或环形)、TIC(0=Ⅰ,1=Ⅱ,2=Ⅲ)。多因素Logistic回归分析结果显示,非肿块内部特点、肿块边缘、肿瘤内部强化特点、TIC、早期强化率、ADCMin及ADCDR为诊断DCIS-Mi最佳变量(表4),后将上述最佳变量绘制ROC曲线,其中以非肿块内部强化特点、肿块内部强化特点、ADCMin及ADCDR的AUC、敏感性和特异性较高,另外,ADCDR曲线下面积大于ADCMin和EER(Z=2.266,P=0.023;Z=3.434,P=0.006),ADCMin曲线下面积大于EER(Z=2.153,P=0.019);非肿块内部强化特点曲线下面积大于TIC(Z=3.153,P=0.002),肿块内部强化特点、肿块边缘和TIC间曲线下面积比较差异无统计学意义(P>0.05)(表5、图6)。
讨 论
DCIS-Mi和DCIS均为乳腺癌的早期病变,美国国立综合癌症网络 2018版指出两者定义有明显不同,且两者治疗方法亦不同,若为DCIS-Mi需要对前哨高危淋巴结进行清扫[5]。本研究DCIS-Mi和DCIS均可表现为非肿块样强化病灶,对ADC值存在一定的平均效应干扰,笔者认为非肿块病灶ADC值测量应结合DCE-MRI图像,以早期DCE-MRI实性区域定位测量,并且与DWI信号分布的空间自动匹配,形成一致影像结果。另外,对于较小病变进行ADC值测量,也要与DCE-MRI图像结合,寻找病变强化最清晰一期实性部分进行测量,这样能够排除伪影和平均效应的影响。本研究利用穿刺活检对靶点进行取材,对于取材靶点与ADCMin基本一致,其误差在0.5 cm,因乳腺腺体松软,可存在一定误差,但所有标本进行整体病理切片观察,无遗漏,确保DCIS-Mi诊断准确性。

表3 DCIS-Mi和DCIS的DCE-MRI特点比较[n(%)]Table 3 Comparison of DCE-MRI characteristics between DCIS-Mi and DCIS[n(%)]
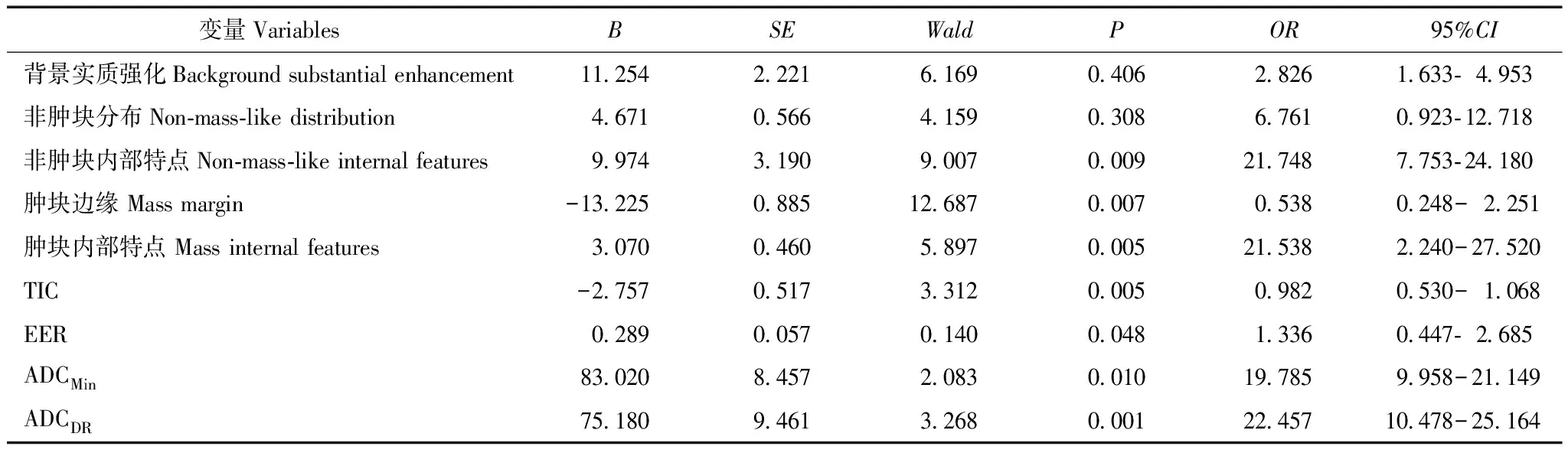
表4 运用多因素Logistic回归确定诊断DCIS-Mi最佳变量Table 4 Multivariate Logistic regression analysis of the best variables for diagnosis of DCIS-Mi
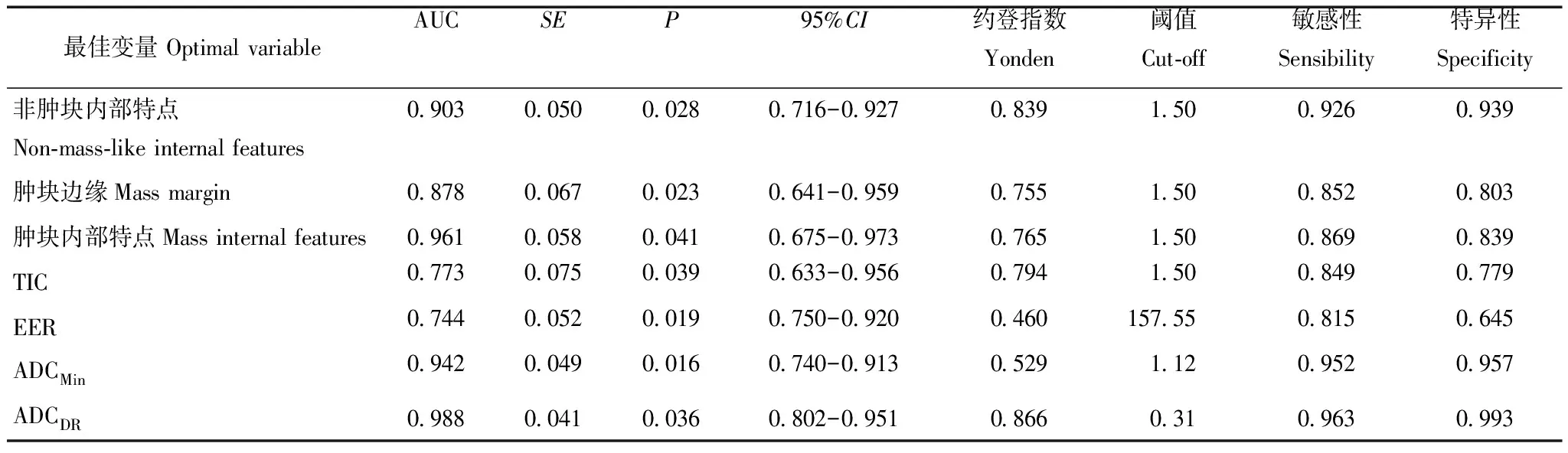
表5 采用ROC曲线对DCIS-Mi最佳变量的诊断效能比较Table 5 Comparison of diagnostic efficiency of DCIS-Mi optimal variables using ROC curve
ROC:受试者操作特性曲线;AUC:曲线下面积;P为与AUC 0.5相比较
ROC:receiver operating characteristic;AUC:area under the curve;Pis compared with AUC 0.5

图6ADCMin、ADCDR、早期强化率(A)及非肿块内部强化特点、肿块边缘、肿块内部强化特点、TIC(B)鉴别DCIS-Mi患者ROC曲线
Fig6ROC curve of ADCMin,ADCDR,early enhancement rate(A),and non-mass internal enhancement characteristics,mass margin,mass internal enhancement characteristics,TIC(B)for identifying patients with DCIS-Mi
ADCMin、ADCDR及EER在DCIS-Mi的诊断价值:本研究显示DCIS-Mi的ADCMin明显低于DCIS(t=-7.192,P=0.002),ADCDR明显高于DCIS,差异有统计学意义(t=-10.228,P<0.001)。通过ROC分析结果显示ADCMin<临界值1.12×10-3mm2/s,ADCDR>临界值0.31×10-3mm2/s,表明DCIS存在微浸润。笔者认为ADC值的大小与肿瘤细胞密度和细胞外间隙宽窄有关,在DCIS-Mi中肿瘤细胞密度明显增加,细胞外间隙明显变窄,限制水分子自由扩散,导致ADC值进一步降低,所以DCIS-Mi测量ADCMin低于DCIS,同时进一步确定ADCMin代表了病灶中细胞最高密度区和浸润性癌巢的位置[6]。ADCDR代表不同组织细胞密度,比如浸润的间质和微浸润间质、导管上皮组织,具有侵袭性的癌巢、慢性炎症细胞等组织细胞。DCIS-Mi患者ADCDR高于DCIS患者,且临界值>0.31×10-3mm2/s,强烈提示DCIS-Mi存在。通过ROC分析ADCDR值准确性、敏感性、特异性高于ADCMin。陈鹏等[7]利用差值ADC值鉴别乳腺良恶性肿瘤,其特异性、敏感性及准确性分别为96.9%、82.1%、90.0%,稍低于本研究结果。Mori等[8]对19个DCIS-Mi测量ADC值,未确定最佳诊断临界值。DCIS-Mi的EER高于DCIS,表明DCIS-Mi血流灌注增多,血管内皮通透性也明显增加,同时周围间质内血流灌注亦丰富,导致EER明显增高[9],但敏感性(81.5%)较高,特异性(64.5%)较低,笔者认为EER在DCIS和DCIS-Mi诊断中具有重叠性,因测量值呈偏态分布,所以标准差较大而导致。同时EER准确性也低于ADCMin和ADCDR,表明DCIS-Mi和DCIS微结构血流灌注也存在交叉,所以准确性下降。
DCE-MRI形态学改变在DCIS-Mi的诊断价值:本研究显示85.19% DCIS-Mi表现为非肿块样强化,同时伴有中度-重度背景实质强化,因DCIS-Mi具有侵袭性,常沿周围纤维腺体组织浸润,导致病变呈非肿块样强化。有报道DCIS-Mi常表现为非肿块样强化,与本研究结果一致[10- 12]。同时,本研究显示非肿块强化,病变多呈节段性或区域分布,内部强化特点呈不均匀或簇环状强化,其中簇环状强化为DCIS-Mi典型表现。仅14.81%表现为肿块样强化,形态不规则,边界不清晰,边缘可见毛刺状,内部强化不均匀或呈环形强化,笔者认为肿块型DCIS-Mi常为单纯DCIS伴发侵袭性成分,肿块边缘不清晰,呈毛刺状改变,即:向周围间质侵袭。DCIS多表现为非肿块强化呈局灶分布,非肿块内部强化特点和肿块内部强化特点相对均匀,边缘相对清晰。Lee等[13]对73例DCIS和55例DCIS伴微浸润进行MRI对照分析,结果显示DCIS伴微浸润主要表现为肿块样强化,内部强化特点呈不均匀或环形强化,但未提及非肿块样强化特点,同时认为形态特点的敏感性(37.04%)和特异性(83.33%)较低。通过Logistic回归和ROC结果分析,非肿块内部强化特点和肿块内部强化特点准确性、敏感性和特异性(分别为:90.3%、92.6%、93.9%;96.1%、86.9%、83.9%)明显高于肿块形态和肿块边缘,表明非肿块和肿块内部强化特点对DCIS-Mi具有较大诊断价值。DCIS的TIC多表现为Ⅰ/Ⅱ型和DCIS-Mi的TIC均表现为Ⅱ/Ⅲ型,本研究结果显示TIC诊断DCIS-Mi敏感性较高,但特异性较低,表明DCIS-Mi病灶微血管侵袭丰富,所以敏感性较高,但与DCIS微血管可能均有重叠,所以特异性较差。
本研究的局限性:(1)本研究DCIS-Mi样本量偏少,有待进行大样本研究;(2)在ADC值测量时较易受腺体干扰,所以采用多次测量;(3)DCE-MRI对DCIS-Mi未进行定量参数研究,仍需今后继续研究。
综上,本研究显示DCIS-Mi 倾向于节段分布,非肿块内部强化特点表现为不均匀或簇环状强化,肿块内部强化特点表现为不均匀或环形强化,TIC 曲线多为Ⅲ型,ADCMin<临界值1.12×10-3mm2/s,ADCDR>临界值0.31×10-3mm2/s,表明DCIS存在微浸润;DCIS趋向于局灶分布,非肿块内部强化特点和肿块内部强化特点相对均匀,TIC 常为Ⅱ型,ADCMin>临界值1.12×10-3mm2/s,ADCDR<临界值0.31×10-3mm2/s。DCE-MRI联合ADC值有助于DCIS-Mi和DCIS诊断与鉴别诊断。
