大鼠坐骨神经华勒氏变性相关分子通路初步研究
2020-01-02王婷于灏魏侃王宁
王婷 ,于灏 ,魏侃 ,王宁
(1.沈阳医学院,辽宁 沈阳 110034;2.沈阳医学院附属中心医院 手外科,辽宁 沈阳 110024;3.手外科研究所;4.骨科)
周围神经损伤后感觉和运动功能遭到破坏,容易造成伤残,严重降低患者的生活质量,大大增加了人们的经济负担[1-3]。所以寻求治疗策略必不可少。雪旺细胞(SC)在神经传导中和轴突再生过程中是必不可少的,在外周神经损伤后,会导致神经脱髓鞘以及轴突再生受损,可能造成周围神经病变和神经病理性疼痛[4]。它在Wallerian 变性中经历去分化、脱髓鞘、增殖迁移等一系列过程[5],形成的Bungner 带具有引导近端轴突再生的功能[6]。因此,在研究中发现雪旺细胞迁移能力增加即可认为是神经修复过程良好的表现。
在先前的体外实验中,我们已经了解到添加外源性PLGF 可提高雪旺细胞迁移能力,其中ERK1/2信号通路可能是介导SCs 迁移的重要因素,而AKT信号通路可能是促进SCs 运动的另一种途径[7]。MEK-ERK 是一种与细胞迁移相关的细胞通路[8],抑制该通路一般用于抑制肿瘤细胞凋亡保护机制,是一种较受欢迎的抗肿瘤治疗策略[9]。它还与细胞周期调控及增殖有关,在免疫系统中MEK/ERK 在适宜抗原刺激下还可以激活增强细胞周期进展和增殖,但过度刺激会诱导细胞周期阻滞[10]。AKT 在细胞生长和存活过程中起着关键作用[11]。在外源性神经保护药物作用下,神经元样细胞的核及核周区域以及少突胶质细胞和星形胶质细胞可发现高表达的磷酸化AKT[12]。同时有研究发现在中枢神经系统中抑制MEK/ERK 和PI3K/AKT 通路可以导致少突胶质细胞的迁移显著降低[13],表明ERK 和AKT 的确有可能对雪旺细胞的迁移产生影响,因此本实验通过体内实验将ERK 以及AKT 抑制剂直接作用于神经,进一步证实ERK 及AKT 调节雪旺细胞迁移的能力。
1 材料与方法
1.1 动物模型建立
SD 大鼠30 只作为实验对象,体重180~220 g,由沈阳医学院实验动物中心提供。所有程序均按照动物伦理审查委员会批准的协议进行。0.2%氯胺酮和0.2%地西泮混合溶液,予2.5 mL/100 g 腹腔注射麻醉,按照无菌原则暴露坐骨神经,以坐骨大孔处即闭孔内肌近端1.0 cm 平面为压断界面,使用恒力装置施加10 N 的力进行压迫,以压迫后复夹神经损伤处鼠呈无反应状态为宜。按说明配置工作液U0126(9903,Cell Signaling) 及 LY294002(9901,Cell Signaling)。此前实验证实其最适合浓度分别为30μM 和10μM[7]。规定大鼠右肢为实验组,左肢为对照组。对照组均仅作压伤处理,实验组在压伤处理后使用微量注射器(HAMILT)分别注入饱和量工作液。
1.2 样本取材
分别于术后 12 h、24 h、3 d、7 d、14 d 各时间点随机取出3 只大鼠,以空气栓塞的方法处死,切取双侧神经解合口两端至少0.5 cm 长的坐骨神经,于-80℃冷冻保存。
1.3 免疫组化化学染色
经脱蜡水化、0.01 M 的PBS 清洗后,正常兔血清封闭30 min 后倾掉,加入p-75 NGF Receptor 重组抗体(EP1039Y,Abcam,美国),在 4℃环境下孵育过夜。第 2 天经 0.01M 的 PBS 清洗,滴加兔 IgG(SA1022,博士德,中国),室温封闭30 min 后再以经0.01 M 的PBS 清洗。加入新鲜DAB 工作液湿盒封闭,于镜下监测到合适显色后水洗,再入苏木素复染后水洗,最后入酸乙醇分化后水洗,脱水封片。
1.4 组织学评价
应用Image Pro Plus 6.0 分析上述切片p-75 NFR 免疫组化阳性程度及Bungner 带数量。以平均光密度值[Density(mean)]表达免疫组化阳性程度;以3~5 个连成一线的细胞核作为Bungner 带来计数。每张切片均于高倍视野下(×200)随机取3 个视野进行分析计算。
1.5 统计学方法
1.6 Western blot 测定蛋白
1.6.1 细胞样本全蛋白提取
将组织尽量剪碎,在每1.0 mL 冷Lysis Buffer中加入10μL 磷酸酶抑制剂、1μL 蛋白酶抑制剂和5μL 100 mM PMSF,混匀,冰上保存数分钟待用。组织块转至新的预冷的离心管中,加入上述配制好的冷Lysis Buffer。置于4℃摇床平台上,温和振荡15 min,14 000 rpm/min,4℃离心 15 min,取上清为全蛋白提取物。
1.6.2 蛋白定量(Bradford 法)
根据凯基Braford 蛋白含量检测试剂盒说明书绘制标准曲线,取待测蛋白样品适量,加入考马斯亮兰 G250 染液 990 mL,混匀,测定 595 nm OD 值,然后在标准曲线上求所得浓度。
1.6.3 SDS-PAGE 电泳
成层胶聚合后,小心拔去样品梳子,然后加入lxTris-Gly 的电泳缓冲液。吸取适量样品上清加入样品孔中,在样品旁的孔中加入预染的蛋白Marker,未添加样品上清的孔中,加入l×SDS 上样缓冲液保持胶面平衡。电压开始设置为60 V,当蛋白样品进入分离胶后,电压可提高到 90 V。参照预染Marke 的位置,待目的条带进入凝胶最佳分离区(大约凝胶的2/3)时,停止电泳。预先将转膜液4℃预冷。托盘上打开转移盒,靠近阴极侧的内面铺上己经用转膜缓冲液浸湿的有孔维垫,其上放3 层浸有转膜缓冲液的Whatman3 MM 滤纸,注意排净气泡。小心撬开玻璃板,将胶放置含有转膜液的托盘内,将含有目的条带的分离胶切下,用转膜液浸泡后置于滤纸上。在凝胶上铺上经甲醇和转膜液浸湿的NC 膜,胶和膜之间不能存有气泡,膜、滤纸和凝胶的大小大致相同。在NC 膜上再放两层浸过转膜液的Whatman 滤纸,注意排净气泡。放上第二块海绵垫,使整个转印夹层依次形成“纤维垫-滤纸-凝胶-NC 膜-滤纸-纤维垫”层次,关闭转印夹,放入转移槽中,槽中灌满转膜液。打开电源,稳流200 mA,120 min。转膜结束后,取出NC 膜并作好标记,用TBST 洗膜10 min×3 次。

图1 Bungner 带形成情况

图1f 为术后 12 h、1 d、3 d、7 d、15 d 时 p-75 NGFR 半定量表达,可见3d 时p-75 NGFR 的表达达到峰值
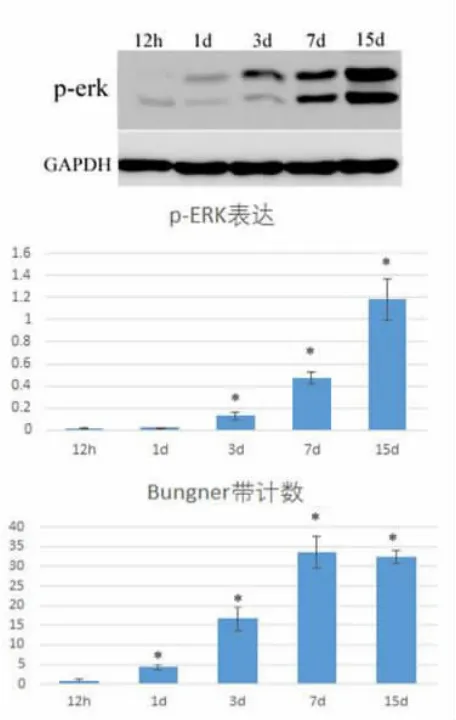
图2 对照组p-ERK1/2 及p-AKT 的表达及Bungner带的变化情况
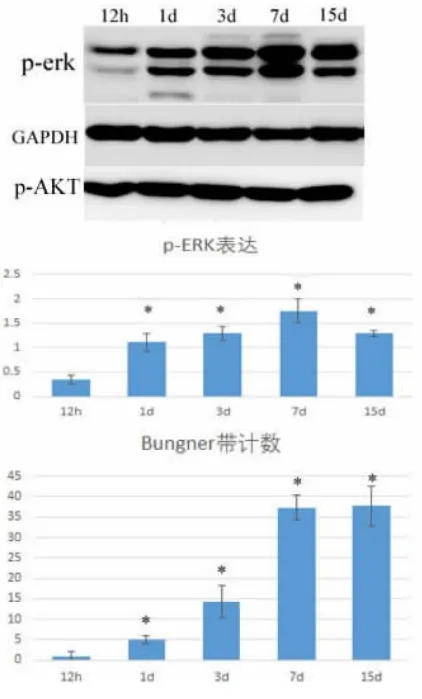
图3 U0126 干预下p-ERK1/2及 p -AKT 的 表 达 及Bungner 带的变化情况
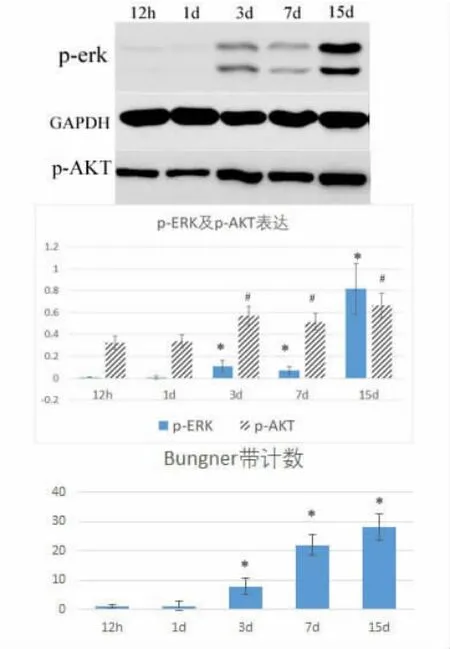
图4 U0126+LY294002 干预下 p-ERK1/2 及 p-AKT 的表达及Bungner 带的变化情况
1.6.4 封闭、抗原抗体反应
封闭:将NC 膜放入平皿中,加入含5%脱脂奶粉的封闭液,摇床振荡1.5~2 h。封闭结束后,用TBST洗膜10 min×3 次。将膜放入含一抗 (ERK (4695,Cell Signaling,USA),p-ERK(4370,Cell Signaling,USA),AKT(4691,Cell Signaling,USA),p-AKT(4060,Cell Signaling,USA) 的平皿中,4℃摇床振荡孵育过夜。第2 天取出,室温振荡30 min,吸弃一抗,TBST洗10 min×3 次。用5%脱脂奶粉封闭液稀释二抗,室温摇床振荡反应1~2 h。二抗反应结束后,回收二抗。然后用 TBsT 洗膜 5~10 min×3 次。将 EcL 化学发光试剂盒中的A、B 两种液体按l∶l 等体积混合,配置成工作液备用。将NC 膜从TBsT 中取出,甩掉多余的液体,将含有蛋白质的膜正面朝上,滴加适量工作液,用保鲜膜覆盖。使用G:BOX chemiXR5 成像。使用Gel-Pro32 软件对结果进行灰度分析。
2 结果
2.1 华勒氏变性远端神经p-75 NGFR 表达
大鼠坐骨神经损伤后远端各时间点的p-75 NGFR 的表达均呈阳性;随着时间推移而p-75 NGFR表达逐渐增加(图1a-e),至3 d 时表达达到峰值(图1f)。
2.2 Bungner 带的形成
大鼠坐骨神经损伤后,远端在损伤后1 d 观察到Bungner 带并未广泛形成,有多处3~5 个细胞核成行排列,Bungner 带尚处在形成过程中(图1b)。远端神经在损伤3 d 后各时间点p-75 NGFR 阳性染色的激活态雪旺细胞高度增值,细胞核呈条带状排列形成 Bungner 带(图 1c-e)。
2.3 Bungner 带形成与ERK1/2 及AKT 信号相关
随着华勒氏变性时间推移,Bunger 带形成数量增加并伴随着p-ERK1/2 表达明显增加,p-AKT 无明显改变(图2);在神经损伤远端注射MEK 抑制剂U0126(30μM),结果 Bungner 带形成数量趋势无明显改变(图3)。在神经损伤远端注射MEK 抑制剂U0126 及 LY294002(10μM),结果 Bungner 带形成数量明显减少(图4)。
3 讨论
大鼠坐骨神经损伤后,神经远端发生华勒氏变性,雪旺细胞由静息态被激活,特异性表达p-75 NGFR 经历去分化、增值,并迁移形成Bungner 带从而引导轴突再生。本研究中华勒氏变性神经远端各时间点的p-75 NGFR 表达均呈阳性,客观反映了华勒氏变性雪旺细胞被激活后p-75 NGFR 的持续表达状态。在此过程中由起初的激活态雪旺细胞3~5 成行,3 d 后各时间点形成Bungner 带形成由少至多,这与Vargas 等报道结果相符[14]。
神经损伤华勒氏变性中,Bungner 带形成数量与p-ERK 表达呈正相关,p-AKT 表达未见明显改变。但当在神经损伤远端单独注射MEK 抑制剂U 0126时,结果显示Bungner 带数量未见明显减少。而同时应用U 0126 及LY 294002 后Bungner 带形成数量在各时间点明显减少,说明ERK 信号途径及PI3K 途径可能与雪旺细胞迁移相关,并同时参与Bungner 带形成,其中具体机制有待我们进一步研究。另外,我们观察到p-ERK 及p-AKT 在抑制剂注射3 d 后逐渐开始表达,这可能与抑制剂在动物体内有效作用时段或有效作用剂量相关。
