建立仙台病毒实时荧光重组酶等温扩增检测方法
2020-01-02冯丽萍魏晓锋
冯丽萍,熊 炜,高 诚,魏晓锋∗
(1. 上海实验动物研究中心,上海 201203; 2. 上海海关,上海 200135)
20 世纪50 年代在日本仙台发现仙台病毒,该病毒是一种小鼠副流感病毒1 型,首先从用于传代人类患者样本的小鼠中分离到,引起病毒起源的混淆。 现在普遍认为仙台病毒是小鼠的病原体,而不是人类的。 仙台病毒是副粘病毒属的成员,与其他副粘病毒一样,它也是一种包膜病毒,具有非分段的负链RNA 基因组[1]。 仙台病毒可自然感染小鼠并引起小鼠肺炎或呈隐性感染,干扰实验结果,需要被严格控制。 国标规定清洁级和SPF 级实验小鼠必须定期检测仙台病毒,目前国标检测方法主要是血清学检测方法,包括酶联免疫吸附试验(ELISA),免疫酶试验(IEA),血凝抑制试验(HAI)和免疫荧光试验(IFA)等[2]。 这些方法通常耗时费力,灵敏度低。 随着分子检测技术的进步,大量基于基因扩增的分析应用于检测仙台病毒[3-5],如逆转录聚合酶链反应(RT-PCR),实时PCR,环介导等温扩增(LAMP)等。 此类方法需要昂贵的热循环仪和经验丰富的技术人员,检测时间较长很难在现场实施。
本研究中实时荧光重组酶等温扩增(real-time fluorescence recombinase polymerase amplification,real-time RPA)是一种快速灵敏的分子检测方法,适用于现场检测。 近年来已经成功开发多种实时荧光RPA 检测方法,用于快速检测不同病原体检测,如空肠弯曲杆菌、猪圆环病毒2 型、口蹄疫病毒、猪流行性腹泻病毒、单核细胞增生李斯特氏菌等[6-10]。该方法可通过简单的仪器在25 min 甚至更短的时间内进行实时检测。
1 材料和方法
1.1 实验材料
SeV 及阳性核酸来自本实验室保存。 本研究中使用的其他病原微生物如小鼠肝炎病毒(mouse hepatitis virus, MHV)、呼肠孤病毒Ⅲ型(reovirus type III, Reo-3)、 肺 炎 克 雷 伯 杆 菌(Klebsiella pneumoniae, KP)、金黄色葡萄球菌(Staphylococcus aureus, SA)、 嗜 肺 巴 斯 德 杆 菌( Pasteurella pneumotropica, PP )、 绿 脓 杆 菌( Pseudomonas aeruginosa, PA)等来自本实验室保存。
1.2 主要试剂与仪器
DNA Marker(DL1000)、RNA 酶抑制剂、dNTP、反转录试剂盒等购自TaKaRa 公司;病毒RNA 快速抽提试剂盒购自生工生物公司;TwistAmp exo 试剂盒购自英国TwistDx 公司;Genie® II 等温扩增荧光检测系统购自英国OptiGene 公司;PCR 仪Biometra T-gradient Thermoblock; 凝胶成像系统 Bio-Rad Universal Hood II。
1.3 实验方法
1.3.1 核酸提取及模板制备
核酸提取:取0. 2 mL 待检上清液或血清,加0. 6 mL buffer Rlysis-VG 试剂进行RNA 提取,室温放置10 min,震荡后加入0. 7 mL 异丙醇;离心15 min 后移除上清;加入1 mL 70%乙醇,震荡后离心5 min,移除上清;加入0. 2 mL RNase-free 水溶解RNA 沉淀,样品可直接取用,也可以保存于-80℃备用。
模板制备:取2 μL RNA 溶液,dNTP Mixture 1 μL、随机引物1 μL、RNase-free H2O 6 μL,PCR 仪上变性、退火反应:65℃5 min;4℃。 在此反应液中加入buffer 4 μL、RNA 酶抑制剂0.5 μL、RTase 0.5 μL、RNase-free H2O 5 μL,再次放回PCR 仪进行反转录反应:30℃10 min;42℃30 min;95℃5 min;4℃,即得cDNA 模板,样品可直接取用,也可以保存于-20℃备用。
1.3.2 实时荧光RPA 引物及探针设计
针对SeV 融合蛋白编码基因的保守序列设计引物及探针[1],实时荧光RPA 检测引物和探针由上海辉睿生物科技有限公司合成。 上游引物SENVFP: 5’-AAA TCT ATA GAA CTG CTG CAA AAC GCT GTG GG-3’;下游引物SENV-RP: 5’-TTG TGT CAG TTT TAT CCC CAG TCT TAA AGC GG-3’;RPA探针SENV-P: 5’-GAA CAA ATT CTT GCT CTA AAG ACG CTC CAG GAT (FAM) -T-T(BHQ1) CGT GAA TGA TGA GAT CAA AC-PO4-3’。
1.3.3 实时荧光RPA 反应体系及程序
反应体系为:使用TwistAmp exo 干粉试剂盒,总体积50 μL,29.5 μL 反应缓冲液、上下游引物各2.1 μL、10 μmol/L 荧光探针0.6 μL、模板2 μL、水11.2 μL,将预混液混合均匀;使用微型旋转离心机快速离心,混匀后加入干粉中;最后加入2.5 μL 280 mmol/L 醋酸镁,小心关闭盖子,上下颠倒混合10次,离心20 s。 参照说明书TwistAmp exo quick guide part number: TAEXO02Guide/ Revision B 即可。
反应程序为:39℃孵育25 min。 反应中即可同步呈现荧光扩增曲线,根据曲线进行结果判定。
1.3.4 SeV 实时荧光RPA 方法特性的分析
特异性分析:将SeV cDNA 和其他对照病原微生物(小鼠肝炎病毒、呼肠孤病毒Ⅲ型、肺炎克雷伯杆菌、嗜肺巴斯德杆菌、金黄色葡萄球菌、绿脓杆菌等),以及空白对照组(双蒸水替代模板),使用SeV实时荧光RPA 方法扩增,观察结果。
敏感性分析:将SeV cDNA 进行10 倍倍比稀释,获得浓度范围是100 ng/μL 到100 fg/μL 的浓度梯度,和空白对照组同时使用SeV 实时荧光RPA方法扩增,观察随时间推移的荧光信号累积。
稳定性和可靠性分析:在不同时间进行7 次独立的实时荧光RPA 检测,模板浓度范围是100 ng/μL 到100 fg/μL 的10 倍倍比稀释的浓度梯度,观察检出浓度及检出时间,并进行统计分析。 检出率应用SPSS 在线Probit 回归分析。 峰值时间应用Microsoft Excel 软件线性回归分析。
1.3.5 实时荧光RPA 方法的优势比较
选择实验动物仙台病毒PCR 检测方法的团体标准进行优势比较[3],实时荧光RPA 方法与团体标准PCR 方法使用相同浓度的模板进行扩增,比较其两种方法检出浓度的下限,以及检测全程所需的时间。
团体标准中的方法,PCR 上游引物Sev-F180 ∶5’-ATG AAG GAC AAA GCA TTA TCG CCT A-3’;上游引物Sev-R180 ∶5’-CAA CCA GTC TCC TGA TTC CAC GTA-3’。 PCR 反应体系和反应程序均参照团体标准[3]。
2 结果
2.1 实时荧光RPA 检测SeV 的特异性和敏感性
SeV 核酸为单股负链RNA,选择其融合蛋白编码基因,设计特异性扩增引物及探针并建立SeV 实时荧光RPA 检测方法。 为了评估方法的有效性及特异性,选用小鼠易感的小鼠肝炎病毒等六种病原微生物作为对照。 将所有的对照组和SeV 组同时扩增,SeV 在反应6 min 30 s 之后荧光信号迅速增强,而其他组在整个反应中均未观察到可见的荧光信号(图1)。 实验结果表明实时荧光RPA 能特异性检测SeV,无交叉反应。
本研究评估实时荧光RPA 的敏感性,使用10倍倍比稀释SeV cDNA 制备浓度梯度100 ng/μL 到100 fg/μL,作为反应的模板。 实时荧光RPA 反应中,前四个梯度能随着时间的推移有大量的荧光信号累积(图2)。
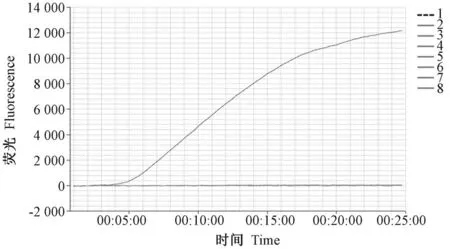
图1 实时荧光RPA 扩增中不同病原微生物的荧光信号Figure 1 Fluorescence data of different pathogenic microorganisms in real-time RPA amplification
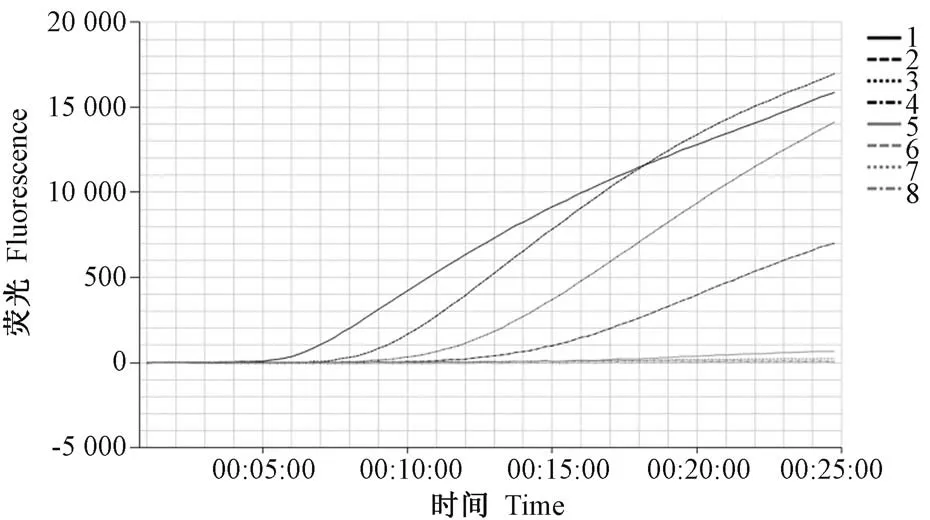
图2 实时荧光RPA 扩增中SeV 稀释梯度的荧光信号Figure 2 Fluorescence data of a dilution series of SeV in real-time RPA amplification
2.2 实时荧光RPA 检测方法的稳定性和可靠性
基于7 次不同时间独立的实时荧光RPA 检测结果,建立回归分析模型。 实验中浓度范围是100 ng/μL 到100 fg/μL 的浓度梯度,不同实验中最低检出浓度有一定波动,波动范围在1 ng/μL 到10 pg/μL 之间,应用SPSS 在线Probit 回归分析,预测浓度185 pg/μL 能达到95%检出率(图3),预测准确率为92.59%,达到此浓度水平实时荧光RPA 检出率能有很好的稳定性。
峰值时间建立线性回归分析模型,大约出现在6~20 min 之间(图4)。 从峰值时间来看,只要能检出均在20 min 内获知结果,超过20 min 还没有起峰则全部未检出,故本实验设计25 min 可以覆盖所有的有效结果,不会错失阳性结果,故结合之前特异性实验结果很好,可见达到其检出浓度实时荧光RPA 方法不会错判和漏判,可靠性很好。
2.3 实时荧光RPA 方法的优势比较
本研究PCR 方法为团体标准中的方法,反应模板浓度梯度100 ng/μL 到100 fg/μL 和实时荧光RPA 模板浓度梯度相同。 PCR 产物电泳图中,前四个泳道可见目标条道(图5)。 因此,如图2 和图5所示这两种方法检测下限一致。 PCR 反应完成需要100 min,跑胶及拍照耗时30 min,总计130 min,而实时荧光RPA 扩增和检测信号是实时呈现,全程仅需25 min,通常在6 ~20 min 之间即可观察到结果,大大缩短了检测时间。 另外,比起PCR 仪,实时荧光RPA 检测仪Genie II,更加小巧轻便且自带电池,适合现场检测。
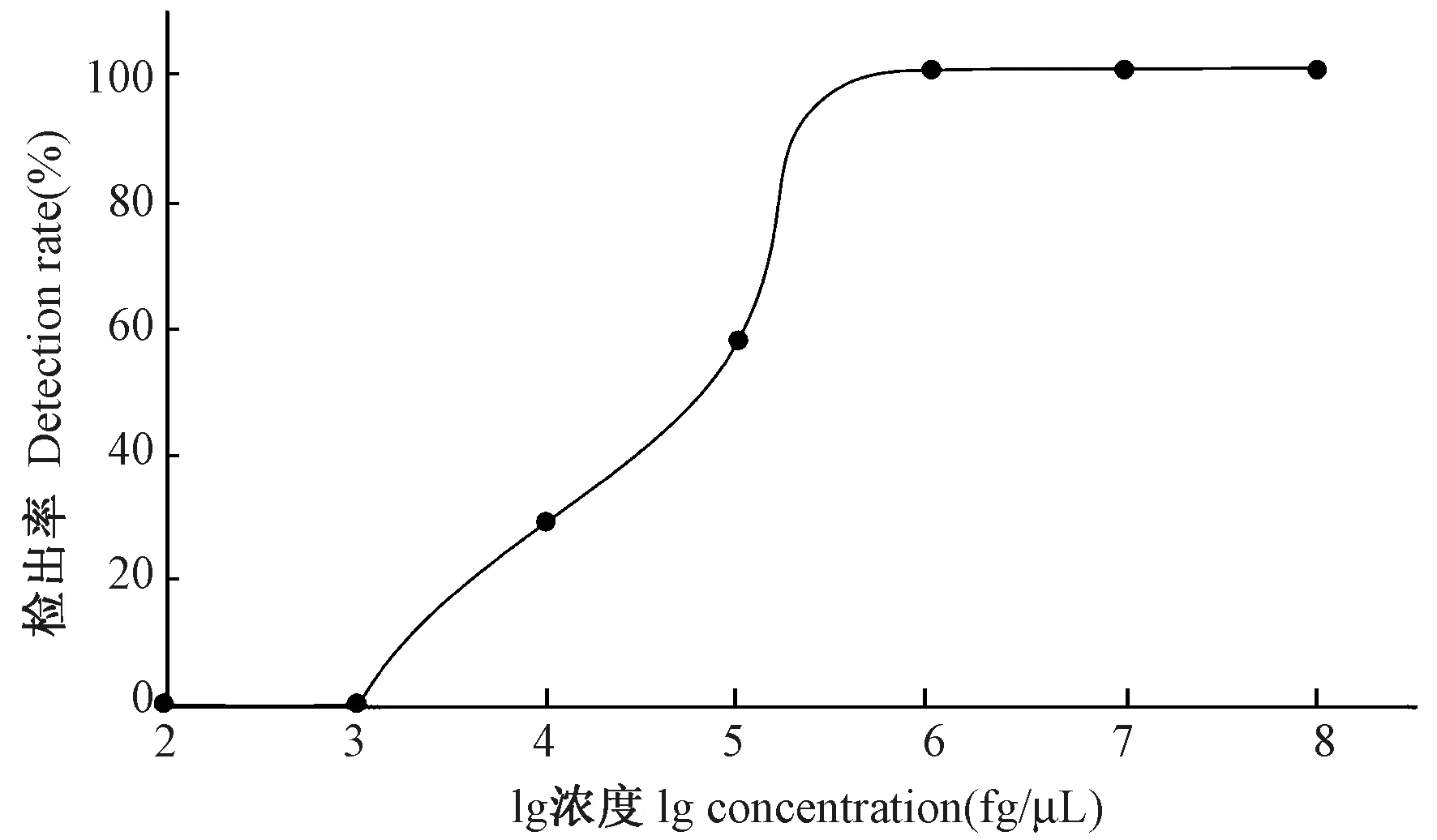
图3 SeV 实时荧光RPA 方法的检出率Figure 3 Positive detection rate of the SeV real-time RPA assay
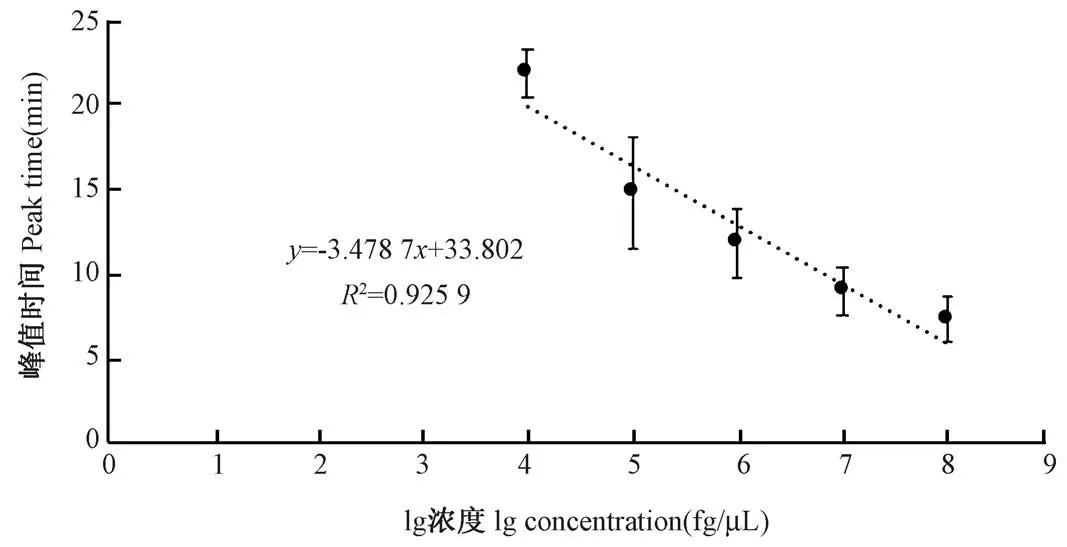
图4 SeV 实时荧光RPA 方法的峰值时间Figure 4 Peak time of the SeV real-time RPA assay

图5 PCR 扩增SeV 稀释梯度的电泳结果Figure 5 Electrophoretic results of a dilution series of SeV in PCR amplification
3 讨 论
实时荧光RPA 已被广泛用于多种病原体的分子检测,便于实地检测[11-12]。 本研究中开发了SeV实时荧光RPA 方法,其特异性、敏感性、稳定性和可靠性均可,该方法能够快速灵敏的检测出仙台病毒。 实验中SeV 实时荧光RPA 和PCR 方法检测下限一样,然而所需的时间相差很大,其中实时荧光RPA 全程仅需25 min,一般在6 ~20 min 内即可观察到结果,而PCR 则需要130 min 才能知晓结果。此外,研究中使用的便携式检测仪Genie II,小巧轻便,无需连接电脑,仪器自带电池,可全天户外无电环境工作。 实时荧光RPA 干粉试剂盒操作简单,仅需将引物、探针和模板DNA 伴随反应混合液和缓冲液加入干粉中即可,减少污染。 重组酶将寡核苷酸引物与模板退火,形成稳定的单链结合蛋白(SSB)结合的引物-重组酶复合物,不需要初始热变性步骤来解开双链DNA[13]。 总而言之,SeV 实时荧光RPA方法简单,快速,便携等特性,使其特别适用于在资源有限的环境中对可疑样品的现场筛查,对于实验动物质量控制具有重要的意义。
