沉默Rho GDIα 抑制矽肺上皮间质转化及其作用机制
2020-01-02陈莹莹姚婧昕李世峰高学敏徐丁洁魏中秋
耿 菲,陈莹莹,姚婧昕,李世峰,高学敏,徐丁洁,魏中秋,杨 方,徐 洪∗
(1.华北理工大学基础医学院,河北 唐山 063000; 2.华北理工大学医学实验研究中心,河北 唐山 063000;3.华北理工大学中医学院,河北 唐山 063000)
矽肺(silicosis)是长期吸入大量含有游离的二氧化硅(silicon dioxide, SiO2)粉尘而引起以矽结节和弥漫性肺间质纤维化为主要病变的慢性进行性尘肺病[1],矽肺的发病机制复杂,涉及多层面、多阶段、多种细胞的参与,特征性表达α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的肌成纤维细胞被认为是器官纤维化形成过程中产生过量细胞外基质(extracellularmatrix, ECM)的最主要和最重要的细胞[2-3],而上皮细胞可以通过上皮-间质转化(epithelial mesenchymal transitions, EMT)转化为成纤维细胞/肌成纤维细胞[4-6]。 Rho GDP 解离抑制因子 α (Rho GDP dissociation inhibitor α, Rho GDIα)是本课题组应用双向凝胶电泳技术在TGFβ1 诱导的大鼠原代肺成纤维细胞中筛选出来的一个差异性蛋白,Rho GDIα 作为蛋白伴侣,是Rho GTP 酶生物活性调节的关键因子,在细胞分化、骨架调控等方面起重要作用,并与细胞增殖、凋亡等生命活动密切相关[7]。 然而,Rho GDIα 能够通过调节EMT 从而调控矽肺纤维化的发生与发展尚无文献报道。
1 材料和方法
1.1 实验材料
人肺泡Ⅱ型上皮细胞株A549 购自中科院上海细胞库。
1.2 主要试剂
人重组TGF-β1(240-B)购置于美国R&D 公司;Rho GDIα 抗体(A1214)购置于武汉ABclonal 公司;RhoA 抗体(ab32046)购置于美国Epiyomics 公司;ROCK 抗体(ab4517)购置于美国Abcam 公司;α-SMA 抗体(1184-1)购置于美国Epiyomics 公司;Ecad 抗体(ab76055) 购置于美国Abcam 公司;Collagen-I 抗体(AF0134)购置于美国Affinity 公司;Tubulin-α 抗体(AF7010)购置于美国Affinity 公司。
1.3 实验方法
1.3.1 人肺泡Ⅱ型上皮细胞株A549 培养及分组
人肺泡Ⅱ型上皮细胞株A549 常规培养,分为:1)空载体慢病毒组(Lentivirus empty vector, LEV):感染空载体慢病毒;2)沉默Rho GDIα 慢病毒感染组(Lv-Rho GDIα-inhibition):感染沉默Rho GDIα 的慢病毒;3)TGF-β1 诱导LEV 组(LEV+TGF-β1):感染空载体慢病毒的稳定细胞株给予TGF-β1(5 ng/mL) 孵 育24 h;4) TGF-β1 诱 导Lv-Rho GDIαinhibition 组(Lv-Rho GDIα-inhibition+TGF-β1):感染沉默Rho GDIα 的稳定细胞株给予TGF-β1(5 ng/mL)孵育24 h。
1.3.2 Western blot 法 检 测Rho GDIα、 RhoA、ROCK、E-cad、α-SMA 及collagen-I 蛋白的表达
提取A549 细胞蛋白,Brafford 法测定蛋白浓度,聚丙烯酰胺凝胶电泳,电转至PVDF 膜,5%牛血清白蛋白封闭1 h,一抗Rho GDIα、RhoA、ROCK、Ecad、α-SMA 及collagen-I(1 ∶500)、Tubulin-α(1 ∶1000)4℃孵育过夜,二抗(1 ∶5000)37℃孵育30 min。 电化学发光显影(美国伯乐公司),用Image Lab 软件测定条带OD 值,以目标蛋白与内参蛋白的比值作为蛋白的相对表达量。
1.3.3 免疫细胞化学染色法检测α-SMA 的表达
每孔6×103个细胞密度制备细胞爬片,按实验设计刺激细胞,用4%多聚甲醛固定40 min,脱中性树胶染色。 孵育一抗α-SMA(1 ∶100)4℃过夜,二抗37℃1 h,DAB 显色,梯度酒精脱水,二甲苯透明,中性树胶封片。
1.3.4 CCK-8 法检测细胞增殖情况
细胞接种到96 孔板中,每孔细胞浓度约为5×104,约100 μL 细胞悬液。 在培养基中加10 μL CCK-8 试剂,加完试剂后轻慢敲击培养板帮助混匀。按实验设计培养相应的时间,酶标仪检测各组细胞在450 nm 处的吸光度(OD),以OD 值作为判断细胞增殖能力的指标。
1.4 统计学分析
采用SPSS 17.0 统计软件进行分析。 数据以平均数±标准差(±s)表示,用Levene 法行方差齐性检验,组间比较采用单因素方差分析;P<0.05 表示差异有统计学意义。
2 结果
2.1 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的Rho GDIα、RhoA、ROCK 蛋白表达的调节作用
Western blot 方法检测Rho GDIα、RhoA、ROCK蛋白表达水平(图1,表1),Lv-Rho GDIα-inhibition 组细胞中Rho GDIα、RhoA、ROCK 蛋白表达水平明显低于LEV 对照组,是LEV 对照组的19.99%、35.89%、36.60%(P <0.05);LEV+TGF-β1 组 细 胞 中Rho GDIα、RhoA、ROCK 蛋白表达水平明显高于LEV 对照组,是LEV 对照组的3.33 倍、3.99 倍、3.06 倍(P<0.05);Lv-Rho GDIα-inhibition+TGF-β1 组细胞中Rho GDIα、RhoA、ROCK 蛋白表达水平低于LEV+TGF-β1组,是LEV+TGF-β1 组的65.19%、53.69%、71.31%(P<0.05),差异均具有统计学意义。
2.2 沉默Rho GDIα 对TGF-β1 诱导的人肺泡Ⅱ型上皮细胞的上皮标志蛋白E-cad 和间质标志蛋白α-SMA 表达的调节作用
Western blot 方法检测上皮标志蛋白E-cad 表达水平(图2,表2),统计结果提示,Lv-Rho GDIαinhibition 组细胞中E-cad 蛋白表达水平明显高于LEV 对照组,是LEV 对照组的1.58 倍(P<0.05);LEV+TGF-β1 组细胞中E-cad 蛋白表达水平明显低于LEV 对照组,是LEV 对照组的6.26%(P<0.05);Lv-Rho GDIα-inhibition+TGF-β1 组细胞中E-cad 蛋白表达水平高于LEV+TGF-β1 组,是LEV+TGF-β1组的7.48 倍(P<0.05),差异均具有统计学意义。
表1 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的Rho GDIα、RhoA、ROCK 蛋白表达的调节作用( ± s, n=3)Table 1 Regulating effect of Rho GDIα knockdown on the expression of Rho GDIα, RhoA and ROCK in A549 cells induced by TGF-β1
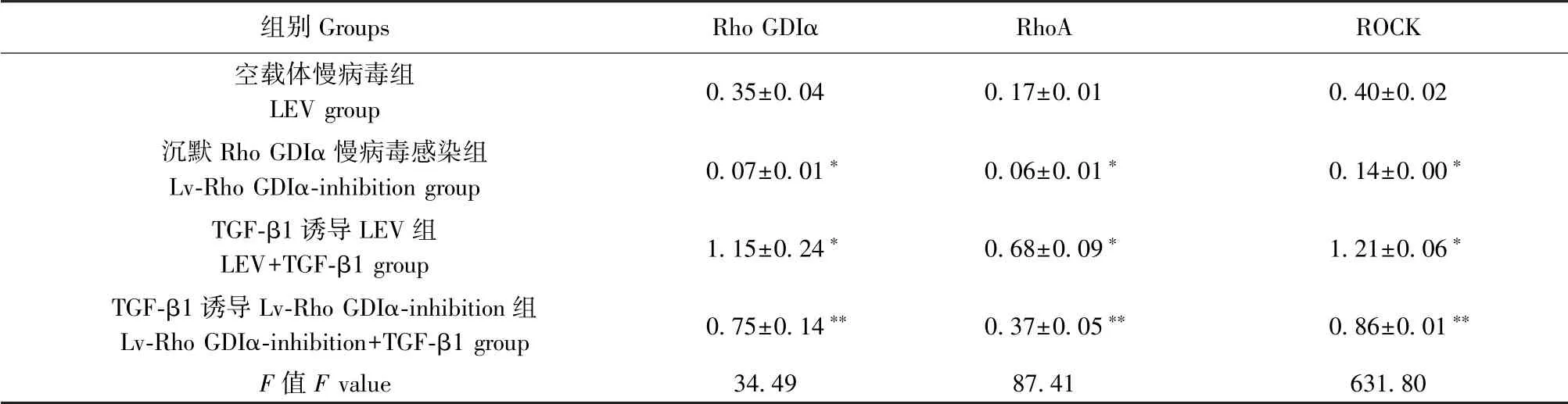
表1 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的Rho GDIα、RhoA、ROCK 蛋白表达的调节作用( ± s, n=3)Table 1 Regulating effect of Rho GDIα knockdown on the expression of Rho GDIα, RhoA and ROCK in A549 cells induced by TGF-β1
注:与空载体慢病毒组比较,∗P<0.05;与TGF-β1 诱导LEV 组比较,∗∗P<0.05。Note. Compared with the LEV group, ∗P<0.05. Compared with the LEV+TGF-β1 group, ∗∗P<0.05.
组别Groups Rho GDIα RhoA ROCK空载体慢病毒组LEV group 0.35±0.04 0.17±0.01 0.40±0.02沉默Rho GDIα 慢病毒感染组Lv-Rho GDIα-inhibition group 0.07±0.01∗ 0.06±0.01∗ 0.14±0.00∗TGF-β1 诱导LEV 组LEV+TGF-β1 group 1.15±0.24∗ 0.68±0.09∗ 1.21±0.06∗TGF-β1 诱导Lv-Rho GDIα-inhibition 组Lv-Rho GDIα-inhibition+TGF-β1 group 0.75±0.14∗∗ 0.37±0.05∗∗ 0.86±0.01∗∗F 值F value 34.49 87.41 631.80
Western blot 方法检测间质标志蛋白α-SMA 表达水平(图2,表2),统计结果提示,Lv-Rho GDIαinhibition 组细胞中α-SMA 蛋白表达水平明显低于LEV 对照组,是LEV 对照组的56.97%(P <0.05);LEV+TGF-β1 组细胞中α-SMA 蛋白表达水平明显高于LEV 对照组,是LEV 对照组的2.37 倍(P<0.05);Lv-Rho GDIα-inhibition+TGF-β1 组细胞中α-SMA 蛋白表达水平低于LEV+TGF-β1 组,是LEV+TGF-β1 组的78.54%(P<0.05),差异均具有统计学意义。
免疫细胞化学染色结果显示(图3),LEV+TGFβ1 组细胞胞浆中有较多的棕黄色肌丝样α-SMA 阳性表达,而Lv-Rho GDIα-inhibition+TGF-β1 组中α-SMA 阳性表达细胞数量明显减少。
2.3 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的collagen-I 蛋白表达的调节作用
Western blot 方法检测collagen-I 蛋白表达水平(图2,表2), Lv-Rho GDIα-inhibition 组 细 胞 中collagen-I 蛋白表达水平明显低于LEV 对照组,是LEV 对照组的22.48%(P<0.05);LEV+TGF-β1 组细胞中collagen-I 蛋白表达水平明显高于LEV 对照组,是LEV 对照组的4.44 倍(P <0.05);Lv-Rho GDIα-inhibition+TGF-β1 组细胞中collagen-I 蛋白表达水平低于LEV+TGF-β1 组,是LEV+TGF-β1 组的90.81%(P<0.05),差异均具有统计学意义。
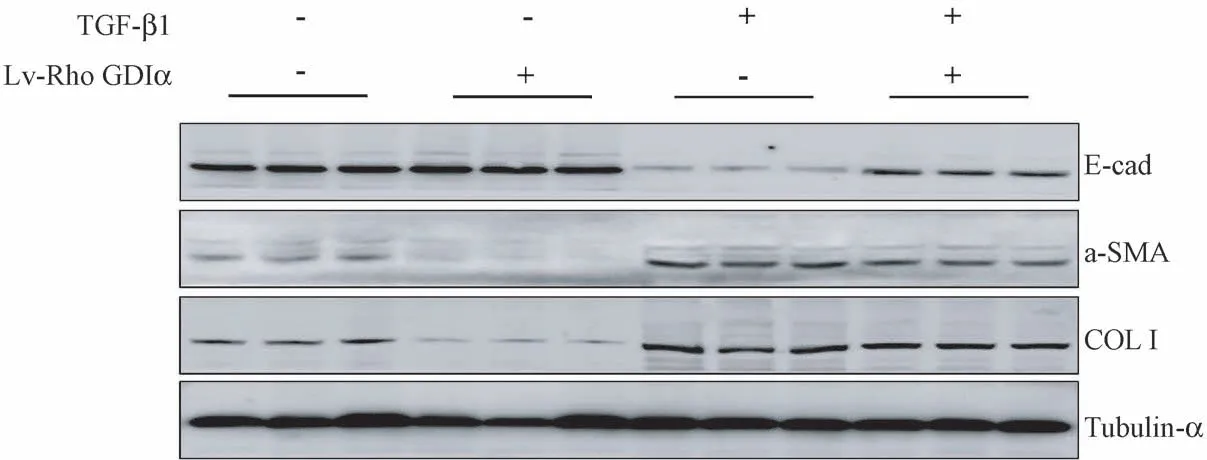
图2 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的E-cad、α-SMA、collagen-I 蛋白表达的调节作用Figure 2 Regulating effect of Rho GDIα knockdown on the expression of E-cad, α-SMA and collagen-I in A549 cells induced by TGF-β1
表2 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的E-cad、α-SMA、collagen-I 蛋白表达的调节作用( ± s, n=3)Table 2 Regulating effect of Rho GDIα knockdown on the expression of E-cad, α-SMA and collagen-I in A549 cells induced by TGF-β1
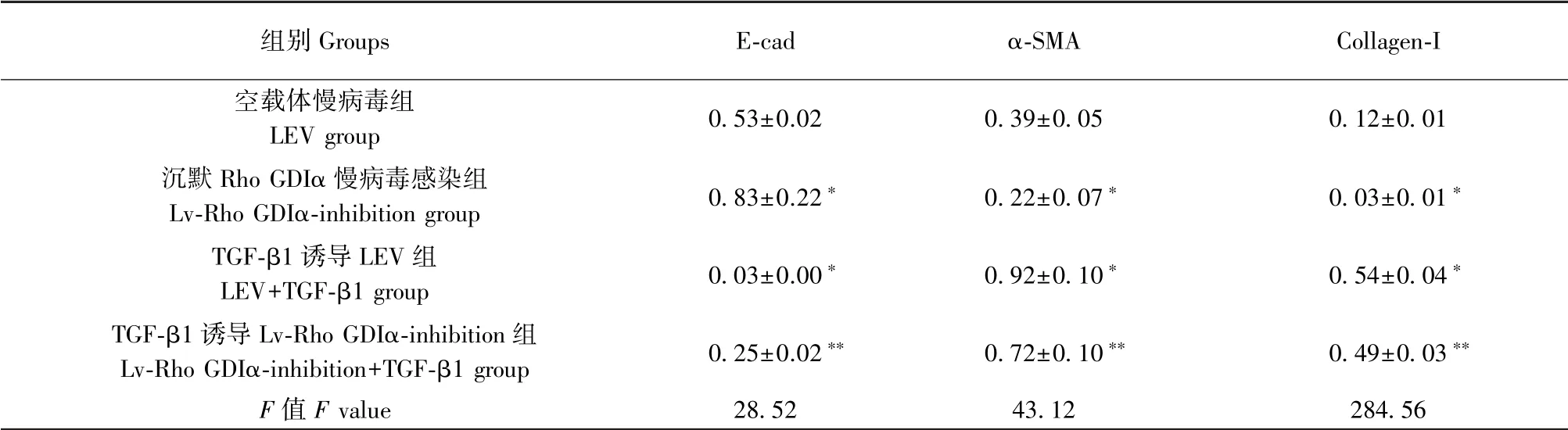
表2 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的E-cad、α-SMA、collagen-I 蛋白表达的调节作用( ± s, n=3)Table 2 Regulating effect of Rho GDIα knockdown on the expression of E-cad, α-SMA and collagen-I in A549 cells induced by TGF-β1
注:与空载体慢病毒组比较,∗P<0.05;与TGF-β1 诱导LEV 组比较,∗∗P<0.05。Note. Compared with the LEV group, ∗P<0.05. Compared with the LEV+TGF-β1 group, ∗∗P<0.05.
组别Groups E-cad α-SMA Collagen-I空载体慢病毒组LEV group 0.53±0.02 0.39±0.05 0.12±0.01沉默Rho GDIα 慢病毒感染组Lv-Rho GDIα-inhibition group 0.83±0.22∗ 0.22±0.07∗ 0.03±0.01∗TGF-β1 诱导LEV 组LEV+TGF-β1 group 0.03±0.00∗ 0.92±0.10∗ 0.54±0.04∗TGF-β1 诱导Lv-Rho GDIα-inhibition 组Lv-Rho GDIα-inhibition+TGF-β1 group 0.25±0.02∗∗ 0.72±0.10∗∗ 0.49±0.03∗∗F 值F value 28.52 43.12 284.56
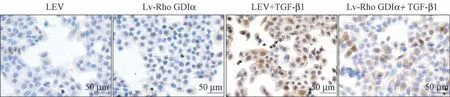
图3 沉默Rho GDIα 对A549 细胞α-SMA 蛋白表达的影响(免疫细胞化学染色)Figure 3 The effect of Rho GDIα knockdown on the expression of α-SMA in A549 cells(Immunocytochemical staining)
2.4 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的增殖能力的影响
CCK-8 法检测细胞增殖能力,结果显示(表3),与LEV 对照组相比,Lv-Rho GDIα-inhibition 组细胞生长明显受抑制,24 h、48 h、72 h Lv-Rho GDIαinhibition 组OD 值分别是LEV 对照组的75.88%、61.37%、72.37%(P <0.05);与LEV 对照组相比,LEV+TGF-β1 组细胞生长增强,12 h、24 h、48 h、72 h LEV+TGF-β1 组OD 值分别是LEV 对照组的1.52倍、1.77 倍、1.60 倍、1.73 倍(P <0.05);与LEV+TGF-β1 组相比,Lv-RhoGDIα-inhibition+TGF-β1 组细胞生长受抑制,12 h、24 h、48 h、72 hLv-Rho GDIαinhibition+TGF-β1 组OD 值是LEV+TGF-β1 组的72.09%、65.35%、60.38%、54.45%(P<0.05),差异均具有统计学意义。
Western blot 方法检测细胞周期蛋白(cyclin)D1蛋白表达水平(图4,表4),Lv-Rho GDIα-inhibition组细胞中cyclin D1 蛋白表达水平明显低于LEV 对照组,是LEV 对照组的29.21%(P <0.05);LEV+TGF-β1 组细胞中cyclin D1 蛋白表达水平明显高于LEV 对照组,是LEV 对照组的3.25 倍(P<0.05);Lv-Rho GDIα-inhibition+TGF-β1 组细胞中cyclin D1蛋白表达水平低于LEV+TGF-β1 组,是LEV+TGFβ1 组的70.69%(P<0.05),差异均具有显著性。
表3 CCK-8 实验结果( ± s,n=3)Table 3 Results of CCK-8 assay
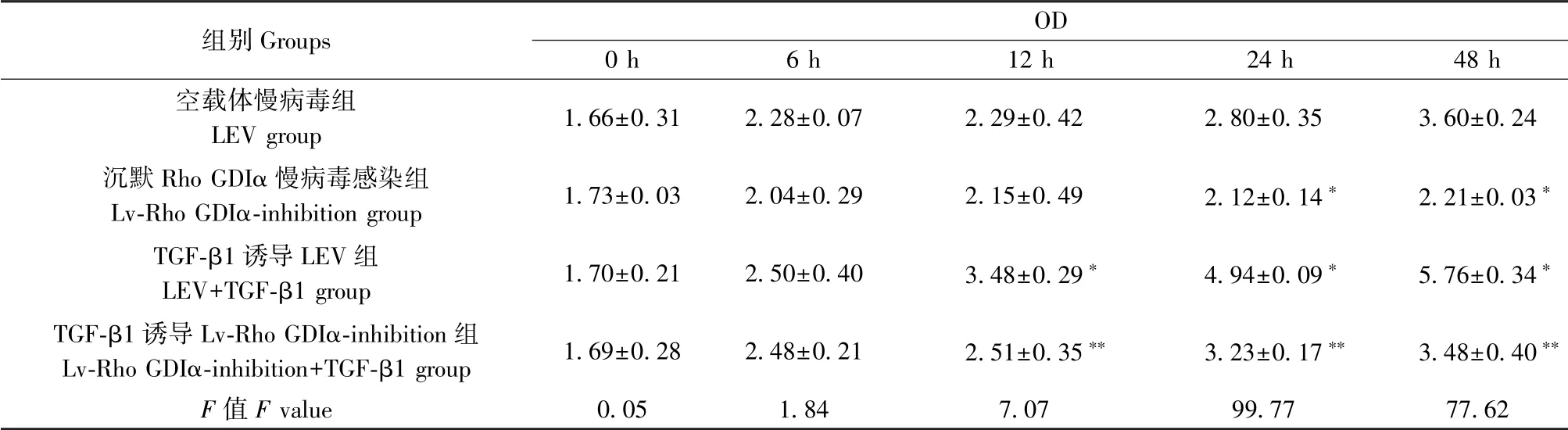
表3 CCK-8 实验结果( ± s,n=3)Table 3 Results of CCK-8 assay
注:与空载体慢病毒组比较,∗P<0.05;与TGF-β1 诱导LEV 组比较,∗∗P<0.05。Note. Compared with LEV group, ∗P<0.05. Compared with the LEV+TGF-β1 group, ∗∗P<0.05.
组别Groups OD 0 h 6 h 12 h 24 h 48 h空载体慢病毒组LEV group 1.66±0.31 2.28±0.07 2.29±0.42 2.80±0.35 3.60±0.24沉默Rho GDIα 慢病毒感染组Lv-Rho GDIα-inhibition group 1.73±0.03 2.04±0.29 2.15±0.49 2.12±0.14∗ 2.21±0.03∗TGF-β1 诱导LEV 组LEV+TGF-β1 group 1.70±0.21 2.50±0.40 3.48±0.29∗ 4.94±0.09∗ 5.76±0.34∗TGF-β1 诱导Lv-Rho GDIα-inhibition 组Lv-Rho GDIα-inhibition+TGF-β1 group 1.69±0.28 2.48±0.21 2.51±0.35∗∗ 3.23±0.17∗∗ 3.48±0.40∗∗F 值F value 0.05 1.84 7.07 99.77 77.62
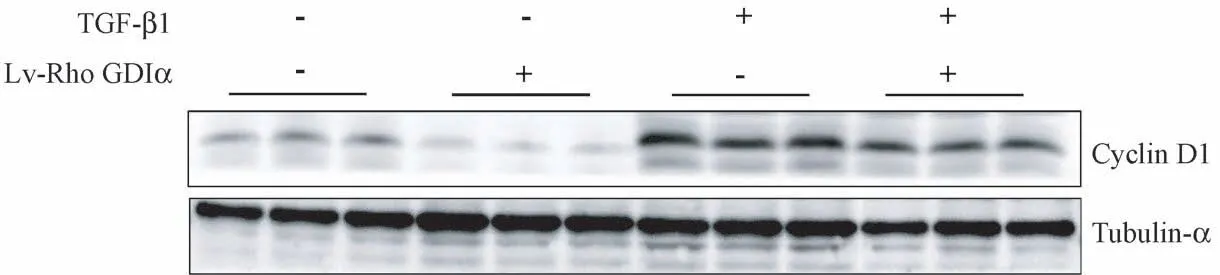
图4 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的cyclin D1 蛋白表达的调节作用Figure 4 Regulating effect of Rho GDIα knockdown on the expression of cyclin D1 in A549 cells induced by TGF-β1
表4 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的cyclin D1 蛋白表达的调节作用( ± s, n=3)Table 4 Regulating effect of Rho GDIα knockdown on the expression of cyclin D1 in A549 cells induced by TGF-β1

表4 沉默Rho GDIα 对TGF-β1 诱导的肺泡Ⅱ型上皮细胞的cyclin D1 蛋白表达的调节作用( ± s, n=3)Table 4 Regulating effect of Rho GDIα knockdown on the expression of cyclin D1 in A549 cells induced by TGF-β1
注:与空载体慢病毒组比较,∗P<0.05;与TGF-β1 诱导LEV 组比较,∗∗P<0.05。Note. Compared with LEV group, ∗P<0.05. Compared with the LEV+TGF-β1 group, ∗∗P<0.05.
组别Groups Cyclin D1空载体慢病毒组LEV group 0.07±0.01沉默Rho GDIα 慢病毒感染组Lv-Rho GDIα-inhibition group 0.02±0.00∗TGF-β1 诱导LEV 组LEV+TGF-β1 group 0.24±0.04∗TGF-β1 诱导Lv-Rho GDIα-inhibition 组Lv-Rho GDIα-inhibition+TGF-β1 group 0.17±0.03∗∗F 值F value 40.76
3 讨论
Rho GDP 解离抑制因子(Rho GDP dissociation inhibitor, Rho GDI)家族包括Rho GDIα、Rho GDIβ和Rho GDIγ 三个亚型,其中Rho GDIα 是表达最广泛、研究最深入的亚型[8]。 目前发现Rho GDIα 在肝癌中表达上升,且与肿瘤的浸润、转移及预后相关[9];另外一些研究也发现Rho GDIα 在胶质瘤、前列腺癌等恶性肿瘤中表达下降,且高表达者多分化好、不易转移、侵袭能力弱及预后较好[10-11]。 但Rho GDIα 在同一肿瘤中的表达水平也并不一致,Song 等发现Rho GDIα 是肺腺癌的转移抑制因子[12],韩昱晨等则表明Rho GDIα 在肺癌高转移亚型中表达上调[13]。 目前尚不清楚造成这一差异的确切原因,可能与肿瘤亚型、研究方法或是样本数量有关。 本实验研究发现,用TGF-β1 诱导A549 细胞后,Rho GDIα、RhoA、ROCK 蛋白表达明显上调,伴随上皮标记蛋白E-cad 的减弱与下调,间质标记蛋白α-SMA 和collagen-I 蛋白的表达增强和上调,而慢病毒感染沉默Rho GDIα 后,可下调Rho GDIα、RhoA、ROCK 蛋白表达,降低α-SMA 和collagen-I 蛋白的表达,逆转上皮细胞向肌成纤维细胞转化,提示TGF-β1 诱 导A549 细 胞 后,Rho GDIα/RhoA/ROCK 信号通路参与了肺泡Ⅱ型上皮细胞向肌成纤维细胞转化的调节过程。
近年来研究发现作为蛋白伴侣的Rho GDIα 是Rho GTP 酶生物活性调节的关键因子,在细胞分化、骨架调控等方面起重要作用,并与细胞增殖、凋亡等生命活动密切相关[14]。 Rho GTP 酶是重要的细胞内信号分子,参与许多细胞生理进程包括调控细胞形态改变、细胞骨架重组、细胞粘附、细胞周期、细胞凋亡、基因转录等[15]。 研究发现,RhoA/ROCK信号转导通路参与多种器官纤维发生、发展过程,通过激活RhoA/ROCK 信号转导通路,上调靶细胞α-SMA 蛋白的表达,可促进间质细胞和上皮细胞向肌成纤维细胞的转化[16-18]。 而Rho GDIα 通过调控RhoA/ROCK 信号转导通路,如何调节上皮细胞向肌成纤维细胞的转化呢? 本实验Western blot 和CCK-8 结果显示,TGF-β1 诱导A549 细胞后,cyclin D1 蛋白表达上升,细胞增殖能力增强,而沉默Rho GDIα 后,cyclin D1 蛋白表达下降,细胞增殖能力减弱,提示TGF-β1 诱导A549 细胞后,上皮细胞数量增多,向肌成纤维细胞转化增强,沉默Rho GDIα后,抑制RhoA/ROCK 信号转导通路,上皮细胞数量减少,向肌成纤维细胞转化减弱。
