人参皂苷Rg3 联合顺铂抑制小鼠肝细胞癌转移及微血管生成的机制研究
2020-01-02王爱红赵菊梅庞秋霞王明全
王爱红,赵菊梅,杜 娟,庞秋霞,王明全
(1.延安大学医学院,陕西 延安 716000; 2.延安大学附属医院介入放射科,陕西 延安 716000)
肝癌是一种常见的消化道肿瘤,在全球范围内,其发病率呈明显升高趋势,在我国,由于乙肝人群众多,肝癌的发生率也一直居高不下[1-4]。 肝癌的恶性度极高,患者的5 年生存率仅为10%左右,如何提高肝癌患者的临床疗效及远期生存一直是临床研究的难点[5]。 人参皂苷属于固醇类化合物,是人参中的活性成分,可影响机体多重的代谢通路,在机体内发挥修复损伤、抗肿瘤、抗氧化等多种效应[6-9]。 研究显示[10],人参皂苷Rg3 可通过下调βcatenin 磷酸化水平有效抑制HCT116 和SW480 细胞生长,发挥抗肿瘤活性。 但关于人参皂苷Rg3 对肿瘤转移机制及微血管生成的研究较少,因此我们试图探讨人参皂苷Rg3 联合顺铂可能对小鼠肝细胞癌转移及微血管产生的抑制作用,以期为肝癌患者改进治疗方案提供更多依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
60 只SPF 级雄性KM 小鼠购于西安交通大学实验动物中心[SCXK(陕)2017-003],分笼饲养于延安大学医学院动物中心[SYXK(陕)2018-009],平均(6.2±1.4)周,平均体重(20.5±2.4)g。 均自由饮水及饮食,环境温度18℃ ~22℃,相对湿度(50±2)%。 本研究符合3R 原则并经延安大学实验动物伦理委员会批准同意,动物使用的伦理审批号(20181107167)。
1.1.2 细胞系
H22 肝癌细胞株由延安大学医学院医学研究实验中心保存。
1.2 主要试剂
人参皂苷Rg3 单体制剂(参一胶囊)购于吉林亚泰制药股份有限公司,生产批号050623;顺铂购于锦州九泰药业有限责任公司, 国药准字H21020213;单克隆抗鼠CD34、基质金属蛋白酶2(matrix metalloproteinase-2,MMP2)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP9)、血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体购于美国Cell Signaling Technology 公司,批号 分 别 为 LS-C202085、 ZM-0330、 AM1975a、CXSL1400014。
1.3 实验方法
1.3.1 动物模型制备及分组
复苏培养H22 细胞株24 h,吹打成悬液,当细胞株生长状态良好,处于对数生长期,收集细胞。稀释细胞至1.5×104/L,吸取细胞悬液后,在裸鼠右侧腋下进行皮下注射。 将60 只小鼠随机分为6 组,根据处理方式的不同,分为:(1)模型组:造模后,纯净水灌胃,不做其他处理。 (2)顺铂组:0.05 g/0.2 L,每周2 次,尾静脉注射2 周。 (3)Rg3 低剂量组:5 mg/kg 皂苷液灌胃,每天一次,连续2 周。 (4)Rg3高剂量组:10 mg/kg 皂苷液灌胃,每天一次,连续2周。 (5)Rg3 低剂量组联合顺铂(低剂量联合组):按照5 mg/kg 皂苷液灌胃,每天一次,连续2 周,同时尾静脉注射0.05 g/0.2 L 顺铂,每周2 次,注射2周。 (6)Rg3 高剂量组联合顺铂(高剂量联合组):按照10 mg/kg 灌胃,每天一次,连续2 周,同时尾静脉注射0.05 g/0.2 L 顺铂,每周2 次,注射2 周。
1.3.2 观察指标
(一)小鼠一般状况
每天定时观察记录小鼠饮食饮水、二便状态、毛发亮度及精神状态等情况。 (2)肿瘤质量及抑瘤率:在实验结束后,处死小鼠,称取肿瘤组织质量。根据公式,抑瘤率(%)= (模型组肿瘤质量- 治疗组瘤重)÷ 模型组肿瘤质量× 100%,单位g。
(二)小鼠血清CD3+、CD4+、CD8+水平
小鼠处死前取血,加单克隆抗体FITC CD4/PECD8/ProcPCD3 20 μL,室温避光12 min, 离心。PBS 洗涤2 次,加0.5 mL 1%多聚甲醛,通过流式细胞仪T001CYT 定量检测,488 nm 激光激发Cell Quest 软件获取,计算阳性细胞的百分数。
(三)Western-blot 检测移植瘤中相关蛋白表达
处死小鼠后,摘取肿瘤组织,液氮研磨,裂解,提取总蛋白,BCA 发测定蛋白浓度。 电泳、转膜、封闭、一抗二抗孵育、ECL 法显影定影。 通过Quantity One 软件分析条带强度,以GAPDH 为内参,检测MMP2、MMP9、VEGF 蛋白表达。
(四)肿瘤微血管密度(microvascular density,MVD)检测
肿瘤组织均经甲醛固定后,石蜡包埋,厚切片,厚度约4 μm。 常规脱蜡、水化,高温修复抗原,PBS冲洗,滴加CD34 单克隆抗体(1 ∶100),4℃冰箱孵育过夜。 PBS 冲洗。 滴加二抗(1 ∶100 稀释),PBS冲洗,DAB 显色,苏木精复染,脱水,二甲苯透明,中性树胶封片。 被CD34 染成棕褐色单个内皮细胞(簇)计为一个微血管,在400 倍视野下计数5 个视野的MVD 水平,取平均值。
1.4 统计学分析
应用SPSS 20.0 软件进行统计分析。 计量资料采用平均数±标准差(±s)表示,组间比较的统计分析采用重复因素方差分析检验,方差不齐采用Dunnett’s 检验,组内比较采用配对t 检验。 检验水准α=0.05。
2 结果
2.1 小鼠一般情况比较
所有小鼠均造模成功,成瘤率100%。 接种肿瘤细胞约3 d 后,小鼠腋下可触及黄豆大小结节,小鼠活动减少,进食量及饮水量均下降。 随着实验时间的延长,顺铂组小鼠体重急剧下降,进食量及饮水量明显减少,对外界刺激反应性下降,自由活动少,毛发稀疏。 Rg3 联合顺铂组的上述症状相对较轻,模型组及单纯Rg3 组的上述症状出现最早。
2.2 各组小鼠体重及抑瘤率比较
造模前,各组小鼠体重无明显差异(P>0.05)。治疗14 d 后,与模型组比较,各治疗组小鼠的体重增长速度均出现不同程度下降。 两两比较后发现,高剂量联合组、顺铂组的体重增长幅度最小,Rg3 低剂量组及高剂量组的体重增长幅度最为显著(P<0.05)。 与模型组比较,各治疗组瘤重显著降低,差异有统计学意义(P<0.05)。 抑瘤率方面,高剂量联合组的抑瘤率最高,顺铂组及低剂量联合组次之,Rg3 低/高剂量组抑瘤率最低,差异具有统计学意义(P<0.05)。 见表1。
2.3 肿瘤组织病理学检查
HE 染色显示,模型组与Rg3 低剂量组的肿瘤细胞紧密排列,巢状分布,核浆比例失衡,病理性核分裂多见,新生血管丰富,伴有炎细胞浸润。 Rg3 低剂量及低剂量联合组的肿瘤细胞鼠量相对较少,细胞排列较为分散,炎性细胞数量更多。 高剂量联合组肿瘤细胞细胞核体积小,细胞质染色不均匀,病理性核分裂明显少于模型组,新生血管较少。 见图1。
2.4 小鼠血清CD3+、CD4+、CD8+水平比较
与模型组比较,各治疗组小鼠血清CD3+、CD4+水平均显著升高,CD8+水平均显著下降(P<0.05)。两两比较后发现,高剂量联合组CD3+、CD4+水平最高,低剂量联合组次之,Rg3 低/高剂量组低于低剂量联合组,模型组水平最低,差异具有统计学意义(P<0.05)。 见表2。
2.5 小鼠肿瘤组织中肿瘤转移相关蛋白表达
与模型组比较,各治疗组小鼠肿瘤组织中MMP2、MMP9、VEGF 蛋白表达量均显著下降(P <0.05),且高剂量联合组MMP2、MMP9、VEGF 蛋白表达量最低(P<0.05)。 见图2。
2.6 小鼠肿瘤组织中MVD 比较
免疫组化结果显示,模型组、顺铂组、Rg3 低剂量组、Rg3 高剂量组、低剂量联合组、高剂量联合组的MVD 分别为(12.64±1.96)、(7.73±1.65)、(9.92±1.45)、(7.13±1.64)、(8.16±1.44)、(6.28±1.49),差异具有统计学意义(P<0.05)。 见图3。
表1 各组小鼠体重及抑瘤率比较(±s,n=10)Table 1 Comparison of body weight and tumor inhibition rate in the different groups of mice
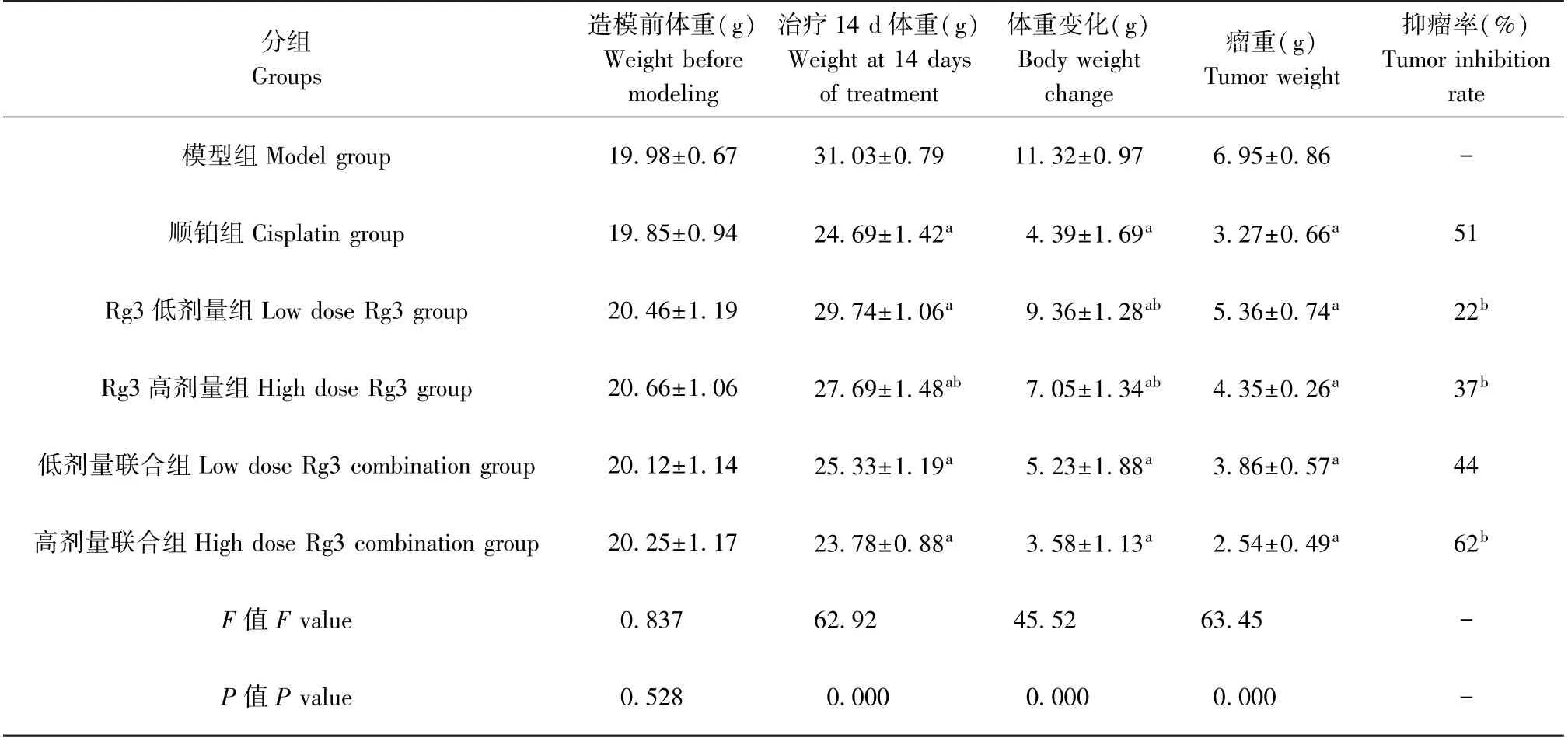
表1 各组小鼠体重及抑瘤率比较(±s,n=10)Table 1 Comparison of body weight and tumor inhibition rate in the different groups of mice
注:与模型组比较,aP<0.05;与顺铂组比较,bP<0.05。Note. Compared with the model group, aP<0.05. Compared with the cisplatin group, bP<0.05.
分组Groups造模前体重(g)Weight before modeling治疗14 d 体重(g)Weight at 14 days of treatment体重变化(g)Body weight change瘤重(g)Tumor weight抑瘤率(%)Tumor inhibition rate模型组Model group 19.98±0.67 31.03±0.79 11.32±0.97 6.95±0.86 -顺铂组Cisplatin group 19.85±0.94 24.69±1.42a 4.39±1.69a 3.27±0.66a 51 Rg3 低剂量组Low dose Rg3 group 20.46±1.19 29.74±1.06a 9.36±1.28ab 5.36±0.74a 22b Rg3 高剂量组High dose Rg3 group 20.66±1.06 27.69±1.48ab 7.05±1.34ab 4.35±0.26a 37b低剂量联合组Low dose Rg3 combination group 20.12±1.14 25.33±1.19a 5.23±1.88a 3.86±0.57a 44高剂量联合组High dose Rg3 combination group 20.25±1.17 23.78±0.88a 3.58±1.13a 2.54±0.49a 62b F 值F value 0.837 62.92 45.52 63.45 -P 值P value 0.528 0.000 0.000 0.000 -
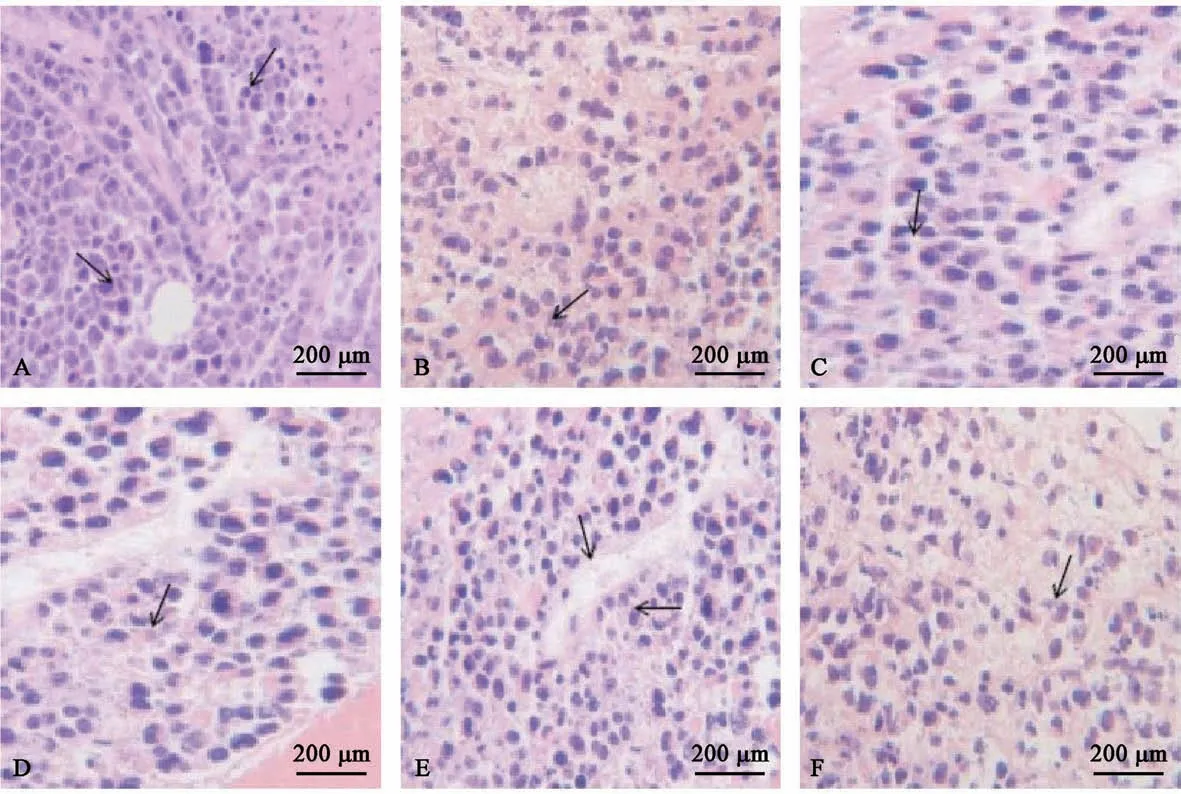
图1 各组小鼠肿瘤组织的病理学改变Figure 1 Histopathological changes of tumor tissues in each group
3 讨论
肝癌的发生受感染、遗传、环境等多种因素的影响,是一个多阶段、多步骤的过程。 手术切除是治疗早期肝癌的首选方法,但能否实施手术取决于肿瘤大小、位置、肝储备功能等多种因素[11-13]。 大多数患者在首次确诊时已处于中晚期,已失去了最佳手术时机,即使接受了标准根治术,部分患者仍然会在短期之内出现复发或转移。 皂苷Rg3 是参一胶囊的主要组分,是一种四环三萜皂苷[14]。 买二辉等[15]研究发现,人参皂苷Rg3 与化疗对抑制小鼠肝癌生长具有协同作用,同时还可改善免疫功能。在关于肺癌、结肠癌、乳腺癌等恶性肿瘤的研究中,人参皂苷Rg3 也有明显的抑制作用[16]。 其机制主要包括抑制肿瘤新生血管形成,发挥化疗增效减毒效应。
表2 小鼠血清CD3+、CD4+、CD8+水平比较(±s,n=10)Table 2 Comparison of serum CD3+, CD4+, CD8+levels in the mice
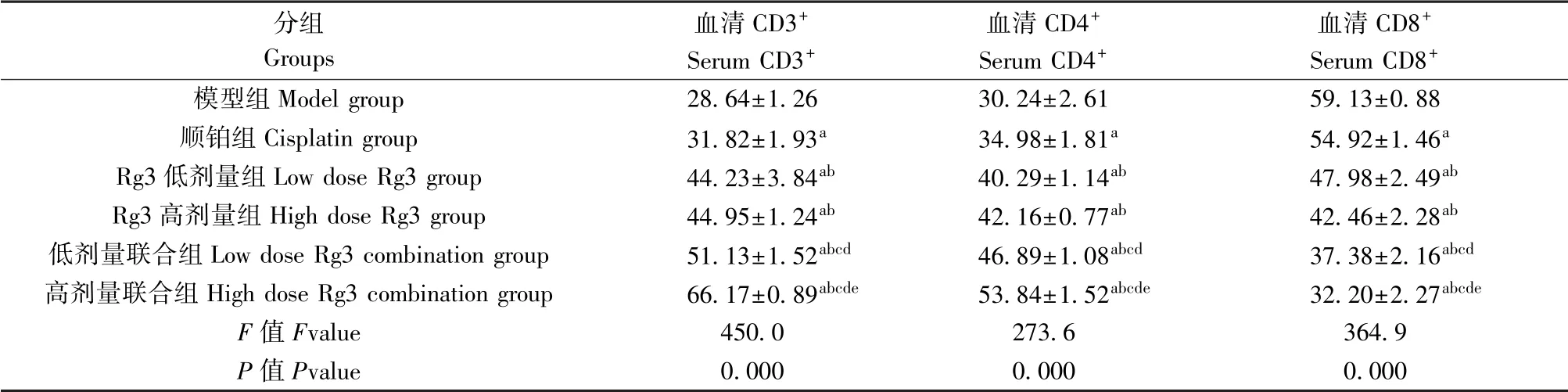
表2 小鼠血清CD3+、CD4+、CD8+水平比较(±s,n=10)Table 2 Comparison of serum CD3+, CD4+, CD8+levels in the mice
注:与模型组比较,aP<0.05;与顺铂组比较,bP<0.05;与Rg3 低剂量组比较,cP<0.05;与Rg3 高剂量组比较;dP<0.05;与低剂量联合组比较,eP<0.05。Note. Compared with the model group, aP<0.05. Compared with the cisplatin group, bP<0.05. Compared with the low dose Rg3 group, cP<0.05.Compared with the high dose Rg3 group, dP<0.05. Compared with the low dose Rg3 combination group, eP<0.05.
分组Groups血清CD3+Serum CD3+血清CD4+Serum CD4+血清CD8+Serum CD8+模型组Model group 28.64±1.26 30.24±2.61 59.13±0.88顺铂组Cisplatin group 31.82±1.93a 34.98±1.81a 54.92±1.46a Rg3 低剂量组Low dose Rg3 group 44.23±3.84ab 40.29±1.14ab 47.98±2.49ab Rg3 高剂量组High dose Rg3 group 44.95±1.24ab 42.16±0.77ab 42.46±2.28ab低剂量联合组Low dose Rg3 combination group 51.13±1.52abcd 46.89±1.08abcd 37.38±2.16abcd高剂量联合组High dose Rg3 combination group 66.17±0.89abcde 53.84±1.52abcde 32.20±2.27abcde F 值Fvalue 450.0 273.6 364.9 P 值Pvalue 0.000 0.000 0.000
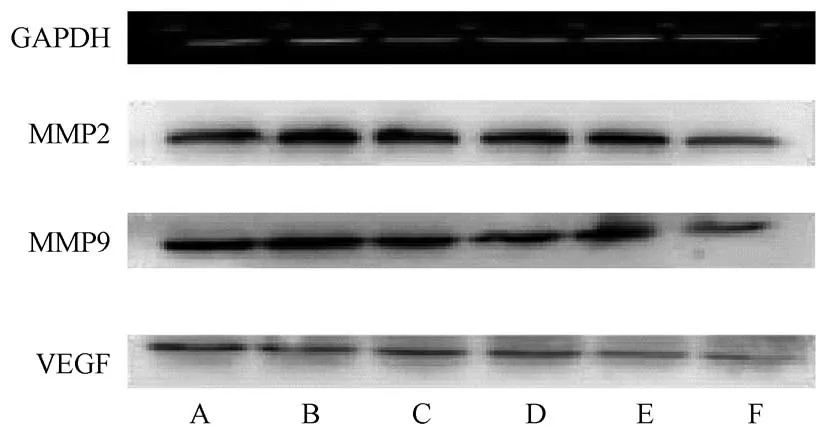
图2 各组小鼠肿瘤组织相关蛋白表达Figure 2 Expression of tumor related proteins in each mouse group
CD3+、CD4+及CD8+是T 细胞较为常见的细胞亚群,在调节机体免疫反应方面发挥着重要作用。CD3+是T 细胞的特有标志,而CD4+负责辅助T 细胞,增强体液免疫反应。 CD8+能够识别肿瘤抗原,分泌杀伤性因子,发挥抗肿瘤效应[17]。 本研究发现,各治疗组CD3+、CD4+水平显著高于模型组,且高剂量联合组最高。 本研究结果与买二辉等[15]研究结果一致。 说明人参皂苷Rg3 可通过降低CD8+水平,提高CD3+、CD4+水平,发挥抗肿瘤的免疫调节作用,且高剂量联合组效果最为显著。 分析原因,人参皂苷Rg3具有明显的改善免疫的功能,且与顺铂联合使用,发挥协同作用,提高CD3+、CD4+水平,降低CD8+水平,进而显著提高肿瘤小鼠的免疫功能。
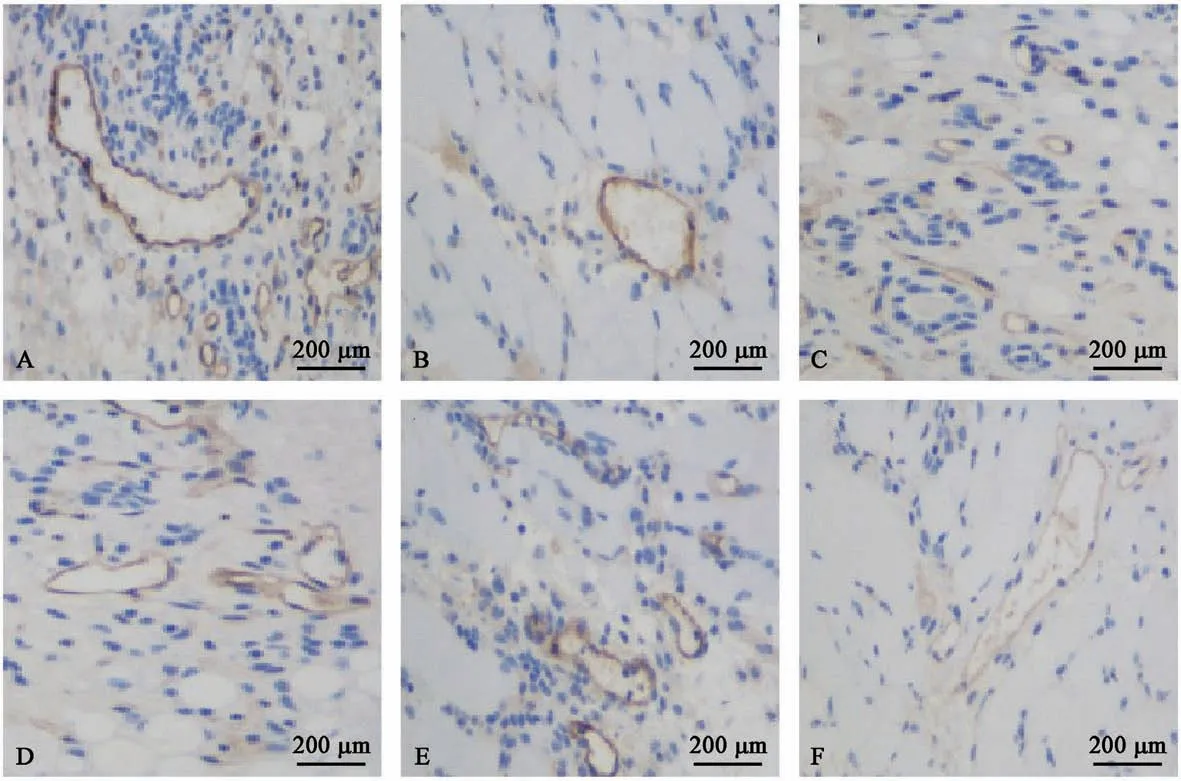
图3 各组小鼠肿瘤组织中MVD 比较Figure 3 Comparison of MVD in tumor tissues of the mice in each group
基质金属蛋白酶(MMPs)几乎能降解细胞外基质中的所有蛋白成分,破坏肿瘤细胞侵袭的组织学屏障,在肿瘤侵袭转移中起关键性作用[18]。 根据作用底物以及片断同源性,MMPs 被大致分为6 类,包括胶原酶、明胶酶、基质降解素、基质溶解素、furin 活化的MMP 和其他分泌型MMP[19]。 而血管内皮生长因子(VEGF)是内皮细胞的特异性有丝分裂原,也是肿瘤新生血管生长的重要标志物,是肿瘤患者预后不良的强烈标志物,其对血管形成及血管通透性有诱导作用,在肿瘤形成早期,VEGF 可诱导内皮细胞产生组织因子和MMPs,使凝血酶原转化为凝血酶,使细胞增殖[20]。 本研究发现,各治疗组小鼠肿瘤组织中MMP2、MMP9、VEGF 蛋白表达量较模型组均显著下降,且高剂量联合组相关蛋白表达量最低。 马英等[21]研究结果表示,人参皂苷Rg3 可抑制肝癌细胞血管生成,其可能机制是抑制VEGF 表达,与本文结果一致。 这表明,联合用药可显著降低肿瘤转移及血管生成相关蛋白的表达量。 为了更直观验证药物对新生血管的抑制作用,研究人员进一步采用免疫组化检测了肿瘤组织中的微血管密度,结果发现,各治疗组MVD计数显著低于模型组,且高剂量联合组的MVD 计数最低。 这与VEGF 蛋白量检测量的结果一致,表明,二者联合用药对肿瘤血管生成的抑制作用最为显著。 且尹天翔等[22]研究也发现,Rg3 能抑制人肝癌细胞增殖、黏附、侵袭转移并诱导细胞凋亡,其功能VEGF 蛋白表达密切相关。 研究结果与本研究一致。
综上所述,本研究发现,人参皂苷Rg3 可有效抑制H22 肝癌细胞的侵袭转移,并与顺铂有一定的协调作用,其机制可能与下调肿瘤转移相关蛋白表达水平、减少肿瘤微血管密度有关。
